КУРС ЛЕКЦИЙ ПО ТЕПЛОТЕХНИКЕ
Часть 1 ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Раздел 1 Введение
Теплотехника – общетехническая дисциплина, которая изучает способы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепло- и парогенераторов, тепловых и холодильных машин, аппаратов и устройств.
Теоретическими основами теплотехники являются техническая термодинамика и теория тепло- и массообмена.
Теплотехническая подготовка студентов различных специальностей имеет ряд особенностей, которые обусловлены характером их будущей практической деятельности. Большинство технологических процессов, применяемых на предприятиях нефтегазовой промышленности, протекают с выделением или поглощением теплоты, а также с широким использованием электрической и механической энергии, которые вырабатываются в различных теплосиловых установках и тепловых двигателях.
Инженер в своей практической деятельности имеет дело с различными тепловыми процессами и с их конструктивным оформлением в виде теплотехнического оборудования. Поэтому он должен уметь грамотно и эффективно использовать тепловое оборудование и, как руководитель эксплуатацией энерготехнологических систем производства, заниматься выявлением и использованием вторичных энергоресурсов.
Курс теплотехники состоит из трех частей: ч.1. Техническая термодинамика; ч.2. Теория тепло- и массообмена; ч.3. Промышленные теплоэнергетические установки.
Основная задача курса теплотехники — дать необходимую теплотехническую подготовку будущему квалифицированному инженеру.
Раздел 2 Основы технической термодинамики
Основные понятия
Совокупность макроскопических тел, которые обмениваются энергией друг с другом и с окружающей средой, называются термодинамической системой (ТС).

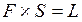 ,
,
где F – сила;
S – пермещение;
L - работа
Термодинамика изучает тепловое движение, т.е. движение в системах, состоящих из большого числа частиц, а отдельные частицы совершают механическое движение.
ТС называют изолированной, если она не взаимодействует с окружающей средой. Например, жесткий сосуд с тепловой изоляцией.

Термо динамический процесс
Переход ТС из одного равновесного состояния в другое называется термодинамическим процессом.
Если при этом промежуточные состояния являются равновесными, то и весь процесс называют равновесным.
Если это условие не выполняется, то и весь процесс - неравновесный. 
Равновесные процессы можно изображать графически:
 а - равновесный процесс,
а - равновесный процесс,
b - неравновесный процесс.
Пример 1. Рассмотрим двигатель внутреннего сгорания.
Дано: n = 3000 об/мин, S = 0,1м (ход поршня)
Найти: среднюю скорость поршня - W
Решение:
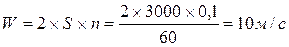
С такой скоростью в данном случае создаются возмущения давления в цилиндре двигателя. Известно, что скорость волн давления в газовой среде равна скорости звука (≈ 340 м/с).
Таким образом, исходя из того, что скорость звука, т.е. скорость рассеивания возмущений, значительно больше скорости поршня с достаточной степенью точности (≈ 3%) процесс можно считать равновесным.
Рабочее тело
В процессах превращения тепла в механическую работу всегда участвует некоторое промежуточное вещество (например, продукты сгорания в ДВС; пар в паровой турбине; воздух в компрессорах). Это вещество и называют рабочим телом.
Все рабочие тела делят на 2 группы: идеальные и реальные газы:
1. Идеальный газ
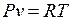 - уравнение Клайперона (1.2)
- уравнение Клайперона (1.2)
где R - газовая постоянная, которая зависит от природы газа,
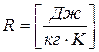
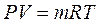 - уравнение для произвольной массы (1.3)
- уравнение для произвольной массы (1.3)
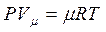 - уравнение Менделеева-Клайперона (1.4)
- уравнение Менделеева-Клайперона (1.4)
где V μ - объем одного моля;
μ - молекулярная масса, кг/кмоль
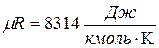 - универсальная газовая постоянная (1.5)
- универсальная газовая постоянная (1.5)
Из (1.5) можно определить R для каждого конкретного газа:
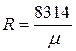 (1.6)
(1.6)
Пример 2. Определить массу воздуха в комнате.
Пусть Р = 105Па, t = 20°C, V = 200м3
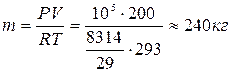
Смесь идеальных газов
Смесь идеальных газов также подчиняется уравнению Клайперона, как и отдельные газы.
Существуют три способа задания смесей:
1. Массовый состав:
m = m 1 + m 2 +…+ mi +…+ mn
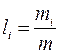 - массовая доля (2.1)
- массовая доля (2.1)
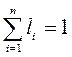
2. Объемный (парциальный) состав:
Парциальным объемом газа, входящего в смесь, называется объем, который занял бы этот газ при давлении и температуре всей смеси.
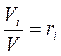 - объемная доля газа, входящего в смесь (2.2)
- объемная доля газа, входящего в смесь (2.2)
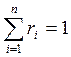
3. Мольный состав:
М - число киломолей всей смеси
M i - число киломолей газа, входящего в смесь
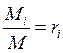 - мольная доля (2.3)
- мольная доля (2.3)
Формула (2.3) определяет мольную долю, однако она численно равна объемной.
Реальные газы
Для реальных газов необходимо учитывать взаимодействие между молекулами, т.к. обычно это достаточно плотные газы.
Различные способы задания уравнения состояния реальных газов.
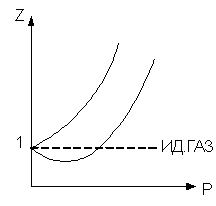
1 способ. Уравнение состояния с коэффициентом сжимаемости:
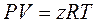 (2.7)
(2.7)
Здесь z - коэффициент сжимаемости (иногда его называют сверхсжимаемостью газа).
Недостаток этого способа в том, что коэффициент z находится чисто экспериментально, притом он зависит не только от природы газа, но и от давления и температуры.
2 способ. Параметрические уравнения. Одно из первых таких уравнений:
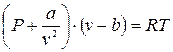 - уравнение Ван-дер-Ваальса (2.8)
- уравнение Ван-дер-Ваальса (2.8)
где a, b - параметры, которые зависят только от природы газа.
Это уравнение описывает свойства реальных газов с погрешностью 10¸20%.
В настоящее время появились аналогичные уравнения - Редлиха-Квонга, Пенга-Робинсона и т.д., которые дают меньшую погрешность.
3 способ. Уравнения с вириальными коэффициентами.
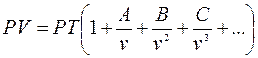 (2.9)
(2.9)
А,В,С - вириальные коэффициенты, 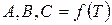
Уравнение (2.9) считается наиболее точным для определения свойств реальных газов.
Помимо этих трех аналитических способов существуют графические методы расчета реальных газов с помощью различных диаграмм: Pv, Ts, Is.
Внутренняя энергия
Под внутренней энергией в термодинамике понимают кинетическую энергию движения молекул, а также потенциальную энергию их взаимодействия.
|
|
Существенно, что другие виды энергии (химическая, ядерная) в конечном итоге превращается во внутреннюю энергию.
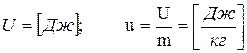
Внутренняя энергия является функцией состояния:
 (3.1)
(3.1)
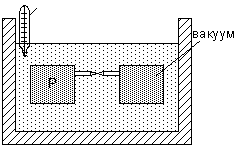 Опыт Джоуля: в термостат поместили два сосуда, между которыми есть трубка с краном.
Опыт Джоуля: в термостат поместили два сосуда, между которыми есть трубка с краном.
Из опыта Джоуля следует, что для идеального газа внутренняя энергия является функцией только температуры:
U = ¦ ( T ) (3.2)
3.2 Теплота
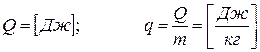
Энергия, предаваемая от одного тела к другому за счет разности температур, называется теплотой.
Содержать тело может только энергию, т.е. пока нет движения – нет теплоты.
3.3 Работа
Энергия, передаваемая от одного тела к другому при изменении объема этих тел или перемещение в пространстве, называется работой.
Как вычисляется работа рассмотрим на примере цилиндра с поршнем. Сначала для случая с постоянным, а затем с переменным давлением.
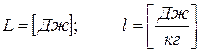
P = const
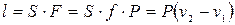
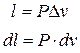 (3.3)
(3.3)
Формула (3.3) – работа изменения объема
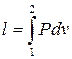 - работа для конечного процесса (3.4)
- работа для конечного процесса (3.4)
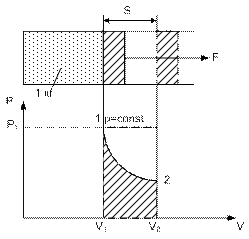
Таким образом, в координатах P v работа численно равна площади между кривой процесса и осью объема. Работа, как и теплота, является функцией процесса.
Энтальпия
Этот параметр широко используется в технике. Дадим сначала его математическое определение.
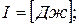
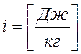
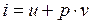 - энтальпия (3.10)
- энтальпия (3.10)

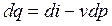 - первый закон термодинамики через энтальпию (3.11)
- первый закон термодинамики через энтальпию (3.11)
Рассмотрим газ в цилиндре с поршнем. Давление газа уравновешивается
грузом G. Это позволяет выяснить физический смысл энтальпии
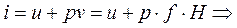
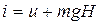

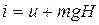 (3.12)
(3.12)
Из формулы (3.12) следует, что энтальпия равна внутренней энергии данной системы плюс потенциальная энергия взаимодействия с окружающей средой. Сравнивая (3.11) и (3.9) и при этом учитывая (3.12) можно сделать вывод, что величина
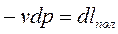 (3.13)
(3.13)
имеет смысл работы.
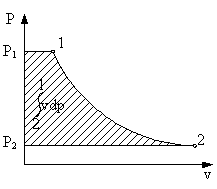 Формула (3.13) представляет собой полезную (располагаемую) работу.
Формула (3.13) представляет собой полезную (располагаемую) работу.
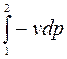
Таким образом, полезная работа в координатах (P-V) численно равна площади между кривой процесса и осью Р.
Теплоемкость
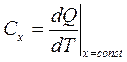 (3.14)
(3.14)
Формула (3.14) - математическое определение теплоемкости, где х - условие процесса
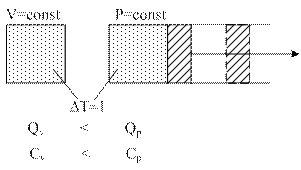
3.7 Зависимость теплоемкости от количества вещества
1. Массовая - теплоемкость, отнесенная к одному килограмму масс.
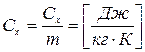
2. Объемная - 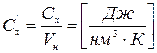
3. Мольная - теплоемкость, отнесенная к одному молю газа
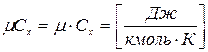
Энтропия
Это одно из наиболее сложных понятий термодинамики. Физический
смысл его мы рассмотрим в дальнейшем, а пока дадим математическое определение.
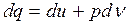
Рассмотрим частный случай идеального газа: 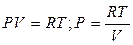
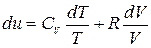 (4.12)
(4.12)
Формула (4.12) не является полным дифференциалом, поэтому умножим левую и правую часть на интегрирующий множитель (1/Т)
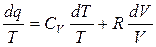 (4.13)
(4.13)
(4.13) - полный дифференциал
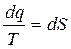 (4.14)
(4.14)
(4.14) - здесь вводится новый параметр - S. Клаузиус назвал его энтропией. В переводе это означает - «преобразование»
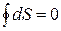 (4.15)
(4.15)
Т.е. энтропия является функцией состояния, также как и внутренняя энергия.
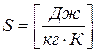
Энтропия является аддитивной величиной (экстенсивной), т.е. ее можно складывать. Пример аддитивных величин: S,U,V, m и др.
Величины, которые нельзя складывать, называют неаддитивными (интенсивными)
Пример: Т, Р, ρ, v.
Формулу (4.13) проинтегрируем:
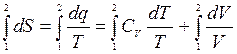 , если
, если 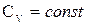 , то
, то
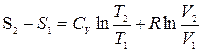 (4.16)
(4.16)
Формула (4.16) служит для вычисления изменения энтропии.
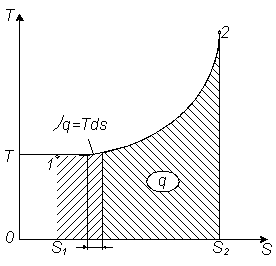
В координатах (T,S) площадь между кривой процесса и осью энтропии численно равна теплоте, поэтому такую диаграмму называют тепловой.
Второй закон термодинамики
Второй закон термодинамики, как и первый, - обобщение большого количества опытных данных.
Основные формулировки второго закона термодинамики:
1. Формулировка Клаузиуса: теплота самопроизвольно передается только от более нагретого тела к менее нагретому.
2. Формулировка Томпсона (Кельвина): невозможно создать циклически работающую тепловую машину, которая превращала бы в работу все подводимое тепло.
3. Формулировка Планка: вечный двигатель второго рода невозможен!
Круговые процессы (циклы)
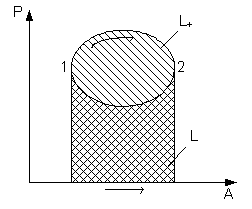 Совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние, называется круговым процессом или циклом.
Совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние, называется круговым процессом или циклом.
Цикл, в котором работа расширения больше работы сжатия, т.е. за счет подводимого тепла совершается полезная работа, называется прямым циклом, или циклом тепловой машины (двигателя). Oн совершается по часовой стрелке и в P - v, и в T - s координатах.
Цикл, в котором наоборот, работа сжатия больше работы расширения, т.е. за счет затраченной работы от рабочего тела отводится теплота, называется обратным циклом или циклом холодильной установки. Он совершается против часовой стрелки.
1. Нулевой цикл
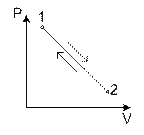
Рассмотрим процесс в P - v координатах.
 1-а-2:
1-а-2: 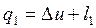
2-в-1: 
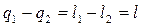
Величину l – называют работой цикла.
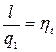 (7.1)
(7.1)
Формула (7.1) определяет термический КПД теплового двигателя. Эта величина определяет принципиальную возможность превращения тепла в работу.
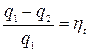 ;
; 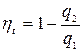 (7.2)
(7.2)
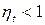 (7.3)
(7.3)
Формула (7.3) - следствие второго закона термодинамики
2. Холодильный цикл

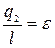 - холодильный коэффициент
- холодильный коэффициент
Прямой обратимый цикл Карно


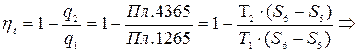
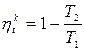 (7.5)
(7.5)
Формула (7.5) для КПД цикла Карно.
Рассмотрим произвольный цикл в том же интервале температур, что и цикл Карно.


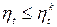 (7.6)
(7.6)

Теорема Карно. Термический КПД тепловой машины не зависит от вида рабочего тела и определяется только разностью температур источника тепла T 1 и приемника тепла Т2 (7.5). КПД любого цикла не может быть больше цикла Карно в том же интервале температур.
Пример :
1) Паровоз: t 1 = 200 °C, t 2 = 100 °C
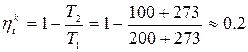 - это максимально возможный КПД.
- это максимально возможный КПД.
Внутренние потери учитывает эффективный КПД 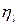 .
.
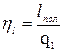 - эффективный КПД
- эффективный КПД 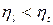
Для паровоза 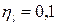
2) Тепловоз (ДВС, дизель) - 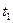 = 2000 ºС ,
= 2000 ºС , 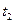 = 800 ºС
= 800 ºС
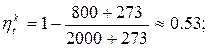
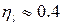
Обратный цикл Карно
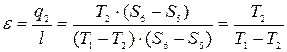 (7.7)
(7.7)

Формула (7.7) – для холодильного коэффициента
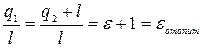 (7.8)
(7.8)
Формула (7.8) определяет отопительный коэффициент. Установка, использующая холодильный цикл для получения тепла, называется тепловым насосом.
Раздел 6. Реальные газы
Термодинамика потока
В технике существует большой класс двигателей и установок, в которых газ или жидкость приобретают значительную скорость. При этом необходимо определять связь между термодинамическими параметрами, потока и площадью сечения канала.
Рассмотрим эту задачу при следующих предложениях:
1. Течение газа или пара стационарное
2. Течение газа одномерное
Это предположение можно обосновать тем, что в каналах энергетических установок за счет больших скоростей, режим течения турбулентный.
3. Выполняется уравнение неразрывности

 – площадь сечения, (
– площадь сечения, (  )
)
 – массовый расход, (кг/с)
– массовый расход, (кг/с)
 – удельный объем, (
– удельный объем, (  /кг)
/кг)
 – скорость, (м/с)
– скорость, (м/с)
4. На поток газа не действуют внешние силовые поля (поле силы тяжести, электромагнитные поля)
Анализ формулы (10.5)

Дифференцируя выражение (10.5) по величине  и приравнивая производную к нулю можно получить следующие значения
и приравнивая производную к нулю можно получить следующие значения
 (11.1)
(11.1)
1 ат k = 1,67 βкр = 0,49
2 ат k = 1,4 β кр = 0,528
3 ат k = 1,3 β кр = 0,546
Т.к. Ркр это относительное давление
Давление в выходном сечении канала, при котором расход становится максимальным, называется критическим давлением.
 (11.2)
(11.2)
Подставляя (11.1) в формулу (10.4)и проводя ряд преобразований, получим выражение для критической скорости:
 (11.3)
(11.3)
Формула (11.3) определяет так называемую критическую скорость, т.е. скорость в выходном сечении канала, когда давление равняется критическому. Из физики известно, что скорость звука в газовой среде:
 (11.4)
(11.4)
Таким образом, критическая скорость в выходном сечении сужающегося канала равна местной скорости звука.
Таким образом, в сужающемся канале нельзя получить скорость, больше скорости звука.
Анализ уравнения (11.8)
1)  (канал сужается)
(канал сужается)
Случай 1.1:  (скорость на входе в канал меньше звуковой), тогда из выражения (11.8) следует, что
(скорость на входе в канал меньше звуковой), тогда из выражения (11.8) следует, что 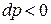 из выражения (11.7)
из выражения (11.7)  .
.
Канал, в котором давление падает, а скорость растет называется дозвуковым соплом.
Случай 1.2: 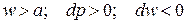
Такой канал, в котором давление растет, а скорость падает (оставаясь
сверхзвуковой) называется сверхзвуковым диффузором.
2) 
а) 
Такой канал называется дозвуковым диффузором.
б) 
Такой канал называется сверхзвуковым соплом.
Сопло Лаваля

 (11.9)
(11.9)
Выражение (11.9) является необходимым условием для получения сверхзвуковой скорости.
Скорость звука падает, т.к. температура падает.

КУРС ЛЕКЦИЙ ПО ТЕПЛОТЕХНИКЕ
Часть 1 ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Раздел 1 Введение
Теплотехника – общетехническая дисциплина, которая изучает способы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепло- и парогенераторов, тепловых и холодильных машин, аппаратов и устройств.
Теоретическими основами теплотехники являются техническая термодинамика и теория тепло- и массообмена.
Теплотехническая подготовка студентов различных специальностей имеет ряд особенностей, которые обусловлены характером их будущей практической деятельности. Большинство технологических процессов, применяемых на предприятиях нефтегазовой промышленности, протекают с выделением или поглощением теплоты, а также с широким использованием электрической и механической энергии, которые вырабатываются в различных теплосиловых установках и тепловых двигателях.
Инженер в своей практической деятельности имеет дело с различными тепловыми процессами и с их конструктивным оформлением в виде теплотехнического оборудования. Поэтому он должен уметь грамотно и эффективно использовать тепловое оборудование и, как руководитель эксплуатацией энерготехнологических систем производства, заниматься выявлением и использованием вторичных энергоресурсов.
Курс теплотехники состоит из трех частей: ч.1. Техническая термодинамика; ч.2. Теория тепло- и массообмена; ч.3. Промышленные теплоэнергетические установки.
Основная задача курса теплотехники — дать необходимую теплотехническую подготовку будущему квалифицированному инженеру.
Дата: 2018-12-21, просмотров: 699.