правила (законы) наследования, сформулированные Г. Менделем: 1) единообразие признака у гибридов первого поколения; 2) расщепление альтернативных вариантов признака среди особей второго поколения; 3) независимое комбинирование признаков родителей в потомках. Генетические закономерности, впервые открытые Г. Менделем, описывают правила независимого наследования, в основе которого лежит наличие дискретных единиц наследственности генов.
Основные понятия генетики:
Аллельные гены – гены, определяющие развитие альтернативных признаков. Они располагаются в одинаковых локусах гомологичных хромосом.
Локус – место локализации гена в хромосоме.
Альтернативный признак и соответствующий ему ген, проявляющийся у гибридов первого поколения, называется доминантным, а не проявляющийся – рецессивным, т. е.:
Доминантность – это способность подавлять одним аллелем действие другого в гетерозиготном состоянии.
Аллель – форма существования (проявления) гена.
Фенотип – совокупность всех свойств и признаков организма. Фенотип развивается на базе определенного генотипа в результате взаимодействия организма с условиями окружающей среды. Организмы, имеющие одинаковый генотип, могут отличаться друг от друга в зависимости от условий развития и существования.
Фен, признак или свойство организма – это единица морфологической, физиологической, биохимической дискретности, позволяющей отличать один организм от другого.
Геном – совокупность численности и формы хромосом и содержащихся в них генов для данного вида.
Генофонд – это совокупность всех аллелей генов, содержащихся в популяции
3. Вши. Систематическое положение, морфология, циклы развития, эпидемиологическое значение, меры борьбы. . Вши (Класс Насекомые). К постоянным кровососущим паразитам человека из класса насекомых относятся только вши. Человек для них - единственный хозяин, поэтому и трансмиссивные заболевания, возбудителей которых переносят вши, являются типичными антропонозами.
Вши характеризуются выраженными адаптациями к эктопаразитизму: размеры их невелики, конечности снабжены аппаратом фиксации к коже, волосам и одежде, ротовой аппарат колюще-сосущего типа, цикл развития упрощен (развитие с неполным метаморфозом), все стадии жизненного цикла обитают и питаются на хозяине.
Человеческая и лобковая. Вид человеческая вошь представлен двумя подвидами: головная, платяная вошь. Зараженность лобковыми вшами - фтириаз.
Вши отличаются друг от друга морфологическими и физиологическими признаками и особенностями жизненного цикла. Самая крупная вошь — платяная, размеры до 4,7 мм. Головная достигает длины 3 мм, а лобковая—не более 1,5 мм. Платяная и головная вши имеют четко отграниченные друг от друга головку, грудь и брюшко, а у лобковой грудь и брюшко слиты. Платяная вошь живет около 50, головная — около 40, а лобковая —до 30 сут. Головная и платяная вши питаются кровью по 2—3 раза в сутки, а лобковая —почти постоянно малыми порциями. Самка платяной и головной вшей откладывает до 300 яиц за всю жизнь, лобковой —до 50. Яйца приклеиваются к волосам или нитям одежды- гниды, очень устойчивы.
Слюна вшей обладает токсическими свойствами, вызывает ощущение жжения и зуда. Лобковая вошь является только паразитом, а головная и платяная — еще и специфическими переносчиками спирохет - возбудителей возвратного тифа, риккетсий - возбудителей эпидемического сыпного тифа, возбудителей волынской лихорадки.
Профилактика - борьба с педикулезом, соблюдение правил личной гигиены, особенно в местах массового скопления людей. Из химических средств используют мази и шампуни, содержащие инсектициды, лекарственные препараты, применяемые внутрь и действующие через кровь, которой питаются эти паразиты. Наиболее эффективны короткая стрижка для уничтожения гнид и обработка белья в дезинфекционных камерах.
Экзаменационный билет №5
1. Репарация генетического материала. Фотореактивация. Эксцизионная, рекомбинационная, SOS-репарация. Мутации, связанные с нарушением репарации и их роль в патологии. Репарация генетическая — процесс устранения генетических повреждений и восстановления наследственного аппарата, протекающий в клетках живых организмов под действием специальных ферментов. Различают 3 системы репарации генетического материала: эксцизионная репарация (репарация путём «вырезания»), фоторепарация и пострепликативная репарация.Механизм эксцизионной репарации заключается в ферментативном разрушении изменённого участка молекулы ДНК с последующим восстановлением на этом отрезке нормальной последовательности нуклеотидов. Такой механизм включает следующие этапы (рис. 81): а) разрыв спирали ДНК у места повреждения при участии эндонуклеаз; б) удаление поврежденного участка с запасом в обе стороны с помощью эндонуклеаз; в) синтез при участии ДНК-полимеразы на месте дефекта нормального участка ДНК; г) «сшивание» последнего с образовавав-шимися концами спирали ДНК при помощи фермента ДНК-лигазы (восстановление непрерывности ДНК). Пострепликативная репарация «включается» тогда, когда эксци-зионная репарация «не справляется» с устранением всех повреждений, возникших в ДНК до её репликации. При репликации во второй спирали ДНК возникают бреши - однонитевые пробелы, соответствующие изменённым нуклеотидам первой спирали. Бреши заполняются участками цепи с нормальной последовательностью нуклеотидов уже в ходе пострешгикативной репарации при участии ДНК-полимеразы.Фоторепарация заключается в расщеплении ферментом (дезоксирибо-пиримидинфотолиазой), активируемым видимым светом, циклобутановых димеров, возникающих в ДНК под действием ультрафиолетового излучения. Фотореактив а ция, уменьшение повреждающего действия ультрафиолетового излучения на живые клетки при последующем воздействии на них ярким видимым светом. Ф. открыта в 1948 И. Ф. Ковалевым (СССР), А. Келнером и Р. Дульбекко (США) в результате опытов, проведённых на инфузориях парамециях, коловратках, конидиях грибов, бактериях и бактериофагах. В основе Ф. лежит ферментативное расщепление на мономеры пиримидиновых димеров, образующихся в ДНК под влиянием ультрафиолетового излучения.Рекомбинационная репарация.В случае сильного повреждения ДНК - образования двуцепочечных разрывов, обширных однонитевых брешей, сшивок между цепочками - функционирует система рекомбинационной репарации, при которой поврежденная ДНК исправляется за счет рекомбинации с полноценной копией генетического материала, если та присутствует в клетке. Межцепочечные сшивки, вызванные бифункциональными алкилирующими агентами ( цисплатин , иприты , псоралены ) репарируются по пути рекомбинационной репарации. SOS-репарация: В клетках Е. coli сигналом для индукции SOS -репарации служит замедление синтеза ДНК. Ответом на этот сигнал является ингибирование клеточного деления, индукция эксцизионной репарации с длинными вырезаемыми фрагментами и затем — рекомбинационной репарации. По-видимому, непосредственным стимулом к запуску механизмов SOS -репарации служит накопление одноцепочечных разрывов ДНК, индуцирующее протеазную активность белка RecA который специфически взаимодействует с белком LexA -репрессором для генов rec (В, С, Е, F,J) и uvr B. Разрезание белка LexA приводит к снятию репрессии и запуску синтеза белковых продуктов указанных выше генов. Кроме того, разрезание белка LexA приводит к кратковременному увеличению его синтеза в клетке, поскольку данный белок является репрессором собственного гена (аутогенный контроль). Далее в результате работы репарационных систем происходит уменьшение количества одноцепочечных разрывов в ДНК, тем самым снижается индуцирующий SOS-репарацию сигнал, белок RecA теряет протеазную активность, и механизмы SOS-репарации выключаются. Считается, что нарушение механизмов репарации ДНК в целом приводит к различным патологическим процессам, в число которых входят канцерогенез, дефекты развития и старение. На сегодняшний день известен ряд наследственных заболеваний, причиной которых служат нарушение репарации ДНК. Дефекты системы эксцизионной репарации нуклеотидов приводят к возникновению пигментной ксеродермы , синдрома Кокейна и трихотиодистрофии . Наследственный неполипозный рак толстой кишки может вызываться мутациями некоторых генов системы репарации гетеродуплексов. Многие синдромы предрасположенности к онкологическим заболеваниям - ретинобластома , семейный аденоматозный полипоз ит.п. - связаны с нарушениями систем ответа на повреждение ДНК.
2. Клетка – элементарная структурно-функциональная биологическая единица. Прокариотические и эукариотические клетки. Клетка - элементарная единица живой системы. Элементарной единицей она может быть названа потому, что в природе нет более мелких систем, которым были бы присущи все без исключения признаки (свойства) живого. Известно, что организмы бывают одноклеточными (например, бактерии, простейшие, некоторые водоросли) или многоклеточными.
Клетка обладает всеми свойствами живой системы: она осуществляет обмен веществ и энергии, растет, размножается и передает по наследству свои признаки, реагирует на внешние раздражители и способна двигаться. Она является низшей ступенью организации, обладающей всеми этими свойствами.
Специфические функции в клетке распределены между органоидами, внутриклеточными структурами, имеющими определенную форму, такими, как клеточное ядро, митохондрии и др. У многоклеточных организмов разные клетки (например, нервные, мышечные, клетки крови у животных или клетки стебля, листьев, корня у растений) выполняют разные функции и поэтому различаются по структуре. Несмотря на многообразие форм, клетки разных типов обладают поразительным сходством в своих главных структурных особенностях.
Все организмы, имеющие клеточное строение, делятся на две группы: предъядерные (прокариоты) и ядерные (эукариоты).
Клетки прокариот, к которым относятся бактерии, в отличие от эукариот, имеют относительно простое строение. В прокариотической клетке нет организованного ядра, в ней содержится только одна хромосома, которая не отделена от остальной части клетки мембраной, а лежит непосредственно в цитоплазме. Однако в ней также записана вся наследственная информация бактериальной клетки.
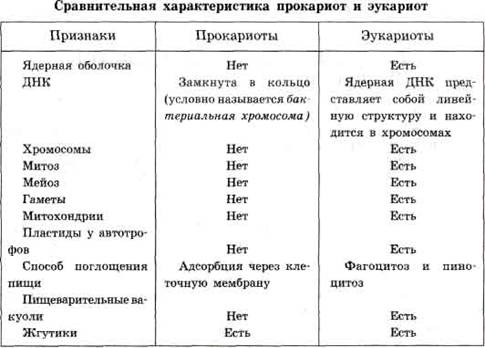
Для растительной клетки характерно наличие различных пластид, крупной центральной вакуоли, которая иногда отодвигает ядро к периферии, а также расположенной снаружи плазматической мембраны клеточной стенки, состоящей из целлюлозы. В клетках высших растений в клеточном центре отсутствует центриоль, встречающаяся только у водорослей. Резервным питательным углеводом в клетках растений является крахмал.
В клетках представителей царства грибов клеточная стенка обычно состоит из хитина - вещества, из которого построен наружный скелет членистоногих животных. Имеется центральная вакуоль, отсутствуют пластиды. Только у некоторых грибов в клеточном центре встречается центриоль. Запасным углеводом в клетках грибов является гликоген.
В клетках животных отсутствует плотная клеточная стенка, нет пластид. Нет в животной клетке и центральной вакуоли. Центриоль характерна для клеточного центра животных клеток. Резервным углеводом в клетках животных также является
3. Острица. Систематическое положение, морфология, цикл развития, обоснование методов лабораторной диагностики, профилактика
| Острица (Enterobius vermicularis) — возбудитель энтеробиоза. Жизненный цикл Паразитирует только у человека. Локализация: нижний отдел тонкой и верхний отдел толстой кишки Заражение обычно происходит через грязные руки. Инвазионная стадия — яйцо. Ползание остриц вызывает мучительный кожный зуд. Человек расчесывает зудящие места, яйца остриц попадают под ногти и могут быть проглочены больны- ми (аутореинвазия). Поэтому, хотя продолжитель- ность жизни остриц всего около месяца, человек мо- жет болеть энтеробиозом длительно. Возможна также ретроинвазия — выход личинок из созревших яиц в перианальной области и миграция их через анус в ки- шечник. Патогенное действие Токсико-аллергическое; повреждение слизистой обо- лочки кишечника и кожи перианальной области и при- соединение вторичной инфекции; развитие вульвоваги- нита при заползании остриц в женские половые пути. | 14:39:27 | |
| Лабораторная: овоскопия соскоба с перианальных складок либо использование метода «липкой ленты» Профилактика Личная: соблюдение правил личной гигиены. Общественная: ежегодное обследование детей и персонала в детских садах, младшей школе, тщатель- ное соблюдение санитарного режима в детских учреж- дениях, санитарно-просветительная работа. Очень важна профилактика аутореинвазии у боль- ного ребенка. Необходимо коротко стричь ногти, мыть руки с мылом, утром после сна постельное и нательное белье проглаживается утюгом, в комнате ежедневно проводят влажную уборку. |
Экзаменационный билет №6
1. Цитогенетический метод. Кариотип человека. Характеристика методов дифференциального окрашивания хромосом. . Цитогенетический метод. Цитогенетический метод состоит в исследовании под микроскопом хромосомного набора клеток больного. Как известно, хромосомы находятся в клетке в спирализованном состоянии и их невозможно увидеть. Для того же, чтобы визуализировать хромосомы клетку стимулируют и вводят ее в митоз. В профазе митоза, а также в профазе и метафазе мейоза хромосомы деспирализуются и визуализируются.
В ходе визуализации оценивают количество хромосом, составляют идиограмму, в которой все хромосомы записывают в определенном порядке согласно Денверской классификации. На основании идиограммы можно говорить о наличии хромосомной абберации или изменении числа хромосом, а соответственно о наличии генетического заболевания.
Каждый организм характеризуется определенным набором хромосом, который называется кариотипом. Кариотип человека состоит из 46 хромосом – 22 пары аутосом и две половые хромосомы. У женщины это две X хромосомы (кариотип: 46, ХХ), а у мужчин одна Х хромосома, а другая – Y (кариотип: 46, ХY). В каждой хромосоме находятся гены, ответственные за наследственность. Исследование кариотипа проводится с помощью цитогенетических и молекулярно-цитогенетических методов.
Кариотипирование – цитогенетический метод - позволяющий выявить отклонения в структуре и числе хромосом, которые могут стать причиной бесплодия, другой наследственной болезни и рождения больного ребенка Все методы дифференциальной окраски хромосом позволяют выявлять их структурную организацию, которая выражается в появлении поперечной исчерченности, разной в разных хромосомах, а также некоторых других деталей.
Дифференциальное окрашивание хромосом. Разработан ряд методов окрашивания (бэндинга), позволяющих выявить комплекс поперечных меток (полос, бэндов) на хромосоме. Каждая хромосома характеризуется специфическим комплексом полос. Гомологичные хромосомы окрашиваются идентично, за исключением полиморфных районов, где локализуются разные аллельные варианты генов. Аллельный полиморфизм характерен для многих генов и встречается в большинстве популяций. Выявление полиморфизмов на цитогенетическом уровне не имеет диагностического значения.
А. Q -окрашивание. Первый метод дифференциального окрашивания хромосом был разработан шведским цитологом Касперссоном, использовавшим с этой целью флюоресцентный краситель акрихин-иприт. Под люминесцентным микроскопом на хромосомах видны участки с неодинаковой интенсивностью флюоресценции — Q -сегменты. Метод лучше всего подходит для исследования Y-хромосом и потому используется для быстрого определения генетического пола, выявления транслокаций (обменов участками) между X- и Y-хромосомами или между Y-хромосомой и аутосомами, а также для просмотра большого числа клеток, когда необходимо выяснить, имеется ли у больного с мозаицизмом по половым хромосомам клон клеток, несущих Y-хромосому.
Б. G -окрашивание. После интенсивной предварительной обработки, часто с применением трипсина, хромосомы окрашивают красителем Гимзы. Под световым микроскопом на хромосомах видны светлые и темные полосы — G -сегменты. Хотя расположение Q-сегментов соответствует расположению G-сегментов, G-окрашивание оказалось более чувствительным и заняло место Q-окрашивания в качестве стандартного метода цитогенетического анализа. G-окрашивание дает наилучшие результаты при выявлении небольших аберраций и маркерных хромосом (сегментированных иначе, чем нормальные гомологичные хромосомы).
В. R -окрашивание дает картину, противоположную G-окрашиванию. Обычно используют краситель Гимзы или флюоресцентный краситель акридиновый оранжевый. Этим методом выявляют различия в окрашивании гомологичных G- или Q-негативных участков сестринских хроматид или гомологичных хромосом.
Г. C -окрашивание используют для анализа центромерных районов хромосом (эти районы содержат конститутивный гетерохроматин) и вариабельной, ярко флюоресцирующей дистальной части Y-хромосомы.
Д. T -окрашивание применяют для анализа теломерных районов хромосом. Эту методику, а также окрашивание районов ядрышковых организаторов азотнокислым серебром (AgNOR-окрашивание) используют для уточнения результатов, полученных путем стандартного окрашивания хромосом.
2. Генетическая (генная) инженерия, её задачи, методы, возможности, перспективы использования. Генетическая инжене́рия (генная инженерия) — совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма (клеток), осуществления манипуляций с генами и введения их в другие организмы.
Генетическая инженерия не является наукой в широком смысле, но является инструментом биотехнологии, используя методы таких биологических наук, как молекулярная и клеточная биология, цитология, генетика, микробиология, вирусология.
Генная инженерия служит для получения желаемых качеств изменяемого организма
Цель генной инженерии - не воплощение в реальность мифов о кентаврах (человеко-конях) и русалках (человеко-рыбах), а получение клеток (в первую очередь бактериальных), способных в промышленных масштабах нарабатывать некоторые «человеческие» белки. Так, с 1980 г. гормон роста человека - соматотропин получают из бактерии Е. coli (кишечной палочки). Соматотропин представляет собой полипептидную цепь, состоящую из 191 аминокислоты. Он вырабатывается в гипофизе и контролирует рост животного; его недостаток приводит к карликовости. До развития генной инженерии его выделяли из гипофизов от трупов. Соматотропин, синтезированный в специально сконструированных клетках бактерий, имеет очевидные преимущества: он доступен в больших количествах, его препараты являются биохимически чистыми и свободны от вирусных загрязнений.
Основной задачей генной инженерии является выделение, идентификация и направленное изменение генетического материала из одного организма таким образом, чтобы его можно было ввести в новый организм -«хозяин». Цель ее - создание новых генетических структур и организмов с новыми наследственными свойствами.
Задачи генной инженерии:
1.создание рекомбинантных ДНК для переноса в другие клетки
2.разработка методов введения рекомбинанатной ДНК в клетку
3.создание условий для нормальной экспрессии генов , введенных в клетку
Основные направления генетической модификации организмов:
– придание устойчивости к ядохимикатам (например, к определенным гербицидам);
– придание устойчивости к вредителям и болезням (например, Bt-модификация);
– повышение продуктивности (например, быстрый рост трансгенного лосося);
– придание особых качеств (например, изменение химического состава).
Методы генной инженерии
Методы основаны на получении фрагментов исходной ДНК и их модификации.
Для получения исходных фрагментов ДНК разных организмов используется несколько способов:
– Получение фрагментов ДНК из природного материала путем разрезания исходной ДНК с помощью специфических нуклеаз (рестриктаз).
– Прямой химический синтез ДНК, например, для создания зондов (см. ниже).
– Синтез комплементарной ДНК (кДНК) на матрице мРНК с использованием фермента обратной транскриптазы (ревертазы).
Определение нуклеотидного состава фрагментов ДНК по классической методике производится с помощью радиоактивных зондов – молекул ДНК с заранее известной структурой, в состав которых входят радиоактивные изотопы фосфора или водорода. Если структура выделенного фрагмента хотя бы частично комплементарна структуре зонда, то происходит ДНК-ДНК-гибридизация, и на микрофотографии препарата появляется засветка от радиоактивного изотопа. В настоящее время для определения нуклеотидных последовательностей ДНК широко используют флуоресцентные метки.
Выделенные участки ДНК встраивают в векторы переноса ДНК. Векторы ДНК – это небольшие молекулы ДНК, способные проникать в другие клетки и реплицироваться в них. В качестве векторов часто используют плазмиды (кольцевые молекулы ДНК прокариотических клеток), а также ДНК вирусов.
В состав вектора ДНК входит не менее трех групп генов:
1. Целевые гены, которые интересуют экспериментатора.
2. Гены, отвечающие за репликацию вектора, его интеграцию в ДНК клетки-хозяина и экспрессию требуемых генов.
3. Гены-маркеры (селективные, репортерные гены), по деятельности которых можно судить об успешности трансформации (например, гены устойчивости к антибиотикам или гены, отвечающие за синтез белков, светящихся в ультрафиолетовом свете).
Для внедрения векторов в прокариотические или эукариотические клетки используют различные способы:
1. Биотрансформация. Используются векторы, способные сами проникать в клетки.
2. Микроинъекции. Используются, если клетки, подлежащие трансформации, достаточно крупные (например, икринки, пыльцевые трубки).
3. Биобаллистика (биолистика). Векторы «вбивают» в клетки с помощью специальных «пушек».
После внедрения векторов получают трансгенные клетки. В ходе размножения трансгенных клеток происходит клонирование требуемых фрагментов ДНК.
Возможности генной инженерии
Значительный прогресс достигнут в области создания новых продуктов для медицинской промышленности и лечения болезней человека.Возможности генной инженерии простираются так широко, что она может транспортировать ген не только из одного растения в другое растение, но и из организма животного в организм растения, или переносить человеческий ген в организм животного.
В 1982 г. создали первое генетически измененное растение. Это был табак.
Интересы исследователей могут быть направлены и на другие цели. Например, с помощью бактерий, нуждающихся в ртути, создаются деревья, очищающие почву. Созданы даже деревья, позволяющие снизить количество токсичных химикатов, необходимых для переработки древесины в бумагу Применение методов генной инженерии позволяет увеличить продуктивность сельскохозяйственных животных. В этой области намечаются два пути: использование генно-модифицированных кормов и непосредственное вмешательство в генотип животных. Возможности генной инженерии все шире применяются и для борьбы с человеческими болезнями, для создания новых лекарств и даже для замены человеческих органов. В ходе экспериментов со стволовыми клетками человека американским ученым удалось получить овцу, печень которой на 80% состоит из клеток человека. Дальнейшее развитие этого направления поможет получить орган, практически идентичный человеческому, и использовать его или его клетки для пересадки больному человеку.
Возможности генной инженерии год от года стремительно возрастают. Вот еще более сногсшибательный проект в с/х: вставить в геном картофеля ген хитиназы — фермента, расщепляющего хитин, слагающий оболочки насекомых. И если раньше колорадский жук переваривал съеденный им картофель, то тогда картофель, съедаемый вредителем, будет переваривать его самого!
Перспективы генной инженерии :
Таким образом, генная инженерия в будущем, возможно, обеспечит создание организмов с новыми свойствами, например, бактерий, синтезирующих человеческие гормоны, микроорганизмов, обладающих повышенной продуктивностью для получения антибиотиков, а в гораздо более отдаленном будущем, может быть, поможет человечеству избавиться от наследственных болезней.
И создание новых методов лечения человека, и разработка новых культур растений, употребляемых в пищу, и выведение новых пород животных требует детального исследования свойств, приобретаемых модифицированным организмом. Необходимо выявить не только реальную опасность, возможно уже существующую, но и потенциальную, которая может проявиться лишь через некоторое время.
Поскольку эволюция всего живого на Земле представляет собой цепь мутаций генов в организмах, очень важно убедиться, что встроенный ген не будет мутировать в нежелательную для человека сторону, не даст развиться в организме таким свойствам, которые могут нанести вред нынешнему и последующим поколениям.
4. Свиной цепень. Систематическое положение, морфология, цикл развития, обоснование методов лабораторной диагностики, пути заражения, профилактика. Цистицеркоз, пути заражения.
Невооруженный (бычий) цепень (Taeniarhynchus saginatus)— возбудитель тениаринхоза
Финна типа цистицерк (cysticercus bovi), отличает- ся от финны свиного цепня меньшими размерами (7,5- 10 х 4-6 мм) и имеет вид просяного зерна
Жизненный цикл
Биогельминт.
Окончательный хозяин — человек.
Локализация в теле окончательного хозяина: тонкая
кишка.
Промежуточный хозяин — крупный рогатый скот. Во внешнюю среду членики выделяются с фекали-
ями больного или активно выползают через задний проход. Крупный рогатый скот заражается, поедая
загрязненную яйцами траву. В пищеварительном трак- те промежуточного хозяина онкосферы высвобождают- ся, проникают в кровеносные сосуды и с током крови попадают в межмышечную соединительную ткань ске- летных мышц, сердечную мышцу, язык. Через 7 меся- цев после заражения финны становятся инвазионными для человека и сохраняют инвазионность до 2 лет.
Человек заражается, съев плохо термически обра- ботанную финнозную говядину.
Инвазионная стадия — цистицерк.
Развитие финн (цистицеркоз) в организме человека невозможно.
Лабораторная: гельминтоскопия фекалий, вид па- разита определяют по числу ответвлений матки (от 17 до 35)
Профилактика
Личная: соблюдение правил личной гигиены, тща- тельная термическая обработка свинины.
Общественная: контроль свинины на рынках и бой- нях перед продажей, предупреждение фекального за- грязнения окружающей среды, санитарно-просвети- тельная
Экзаменационный билет №7
1. Классификация генов: гены структурные, регуляторы. Свойства генов – дискретность, стабильность, лабильность, полиаллелизм, специфичность, плейотропность. Структурными генами называются участки ДНК, кодирующие белковые цепи, т-РНК и р-РНК. точное определение дала молекулярная биология: ген – фрагмент генетического кода, который может синтезировать только один определённый полипептид или РНК Структурные гены — уникальные компоненты генома, представляющие единственную последовательность, управляющую синтезом специфических белков (гл. обр. ферментов)
Наряду со структурными генами ДНК содержит регуляторные последовательности. Они могут обозначать начало или конец структурного гена, запускают или прекращают транскрипцию.
дискретность действия — несмешиваемость генов; Ген дискретен в своем действии, т. е. обособлен в своей активности от других генов.
стабильность (постоянство)— способность сохранять структуру; при отсутствии мутаций он передается в ряду поколений в неизменном виде.
лабильность — способность многократно мутировать;
множественный аллелизм — это существование в популяции более двух аллелей данного гена. В популяции оказываются не два аллельных гена, а несколько. Возникают в результате разных мутаций одного локуса .т.е. К числу аллельных генов могут относиться не два, а большее число генов. Они возникают вследствие мутации (замены или утраты нуклеотида в молекуле ДНК). Примером множественных аллелей могут быть гены, отвечающие за группы крови у человека: IA, IB, I0. Гены IА и IB доминантны по отношению к гену I0. В генотипе всегда присутствуют только два гена из серии аллелей. Гены I0I0 определяют I группу крови, гены IАIА, IАI0 - II группу, IBIB, IBI0 - III группу, IAIB - IV группу.
специфичность — каждый ген кодирует свой признак; Ген специфичен в своем проявлении, т. е. отвечает за строго определенный признак или свойство организма
плейотропия — множественный эффект гена . Способность отдельных генов обеспечивать развитие одновременно нескольких признаков. Примером плейотропного эффекта гена у человека служит синдром Марфана . Хотя это наследственное заболевание зависит от присутствия в генотипе одного измененного гена, оно характеризуется в типичных случаях триадой признаков:
подвывихом хрусталика глаза,
аневризмой аорты,
изменениями опорно-двигательного аппарата в виде «паучьих пальцев»,
деформированной грудной клеткой,
высоким сводом стопы.
2. Цитоплазматическая наследственность. Насл е дственность цитоплазмат и ческая (внеядерная, нехромосомная, плазматическая), преемственность материальных структур и функциональных свойств организма, которые определяются и передаются факторами, расположенными в цитоплазме. Совокупность этих факторов — плазмагенов, или внеядерных генов, составляет плазмон (подобно тому, как совокупность хромосомных генов — геном). Плазмагены находятся в самовоспроизводящихся органеллах клетки — митохондриях и пластидах (в том числе хлоропластах и др.). Указанием на существование Н. ц. служат, прежде всего, наблюдаемые при скрещиваниях отклонения от расщеплений признаков, ожидаемых на основе Менделя законов. Цитоплазматические элементы, несущие плазмагены, расщепляются по дочерним клеткам беспорядочно, а не закономерно, как гены, локализованные в хромосомах. Плазмагены передаются главным образом через женскую половую клетку (яйцеклетку), так как мужская половая клетка (спермий) почти не содержит цитоплазмы (что, однако, не исключает передачи плазмагенов через мужские гаметы). Поэтому изучение Н. ц. ведётся с использованием специальных схем скрещивания, при которых данный организм (или группа) используется и как материнская, и как отцовская форма (реципрокное скрещивание). У растений и животных различия, обусловленные Н. ц., сводятся в основном к преобладанию материнских признаков и проявлению определённого фенотипа при одном направлении скрещивания и его утрате при другом. Цитоплазматическая мужская стерильность (ЦМС), передающаяся по женской линии, широко используется для получения гетерозисных гибридных форм, главным образом кукурузы, а также некоторых др. с.-х. растений Др. метод исследования Н. ц. — "пересадка" ядра из одной клетки в другую. От Н. ц. следует отличать так называемую инфекционную наследственность, т. е. передачу через цитоплазму симбиотических или слабо болезнетворных саморазмножающихся частиц (вирусов типа сигма, обнаруженных у дрозофилы или поражающих пластиды, риккетсиеподобных частиц типа каппа, найденных у парамеций, и др.), которые не являются нормальными компонентами клетки, необходимыми для её жизнедеятельности (см. Лизогения, Эписомы). Во всех изученных случаях плазмагены в химическом отношении представляют собой ДНК, обнаруженную во многих самовоспроизводящихся органоидах (количество её может достигать нескольких десятков процентов от всей клеточной ДНК). Определённая степень генетической автономии, свойственная носителям плазмагенов, сочетается с контролем над ними со стороны хромосомных генов. Установлено, что некоторые мутации пластид вызываются ядерными генами, контролирующими отчасти и функционирование пластид. Показано также, что количество ДНК в митохондриях недостаточно для того, чтобы нести всю информацию об их функциях и строении; т. о., и структура митохондрий, по крайней мере частично, определяется геномом. Ядерные и внеядерные гены могут взаимодействовать и при реализации фенотипа.
Дата: 2018-09-13, просмотров: 1993.