Элементы диаграммы, изображаемые сплошными линиями, делят поле диаграммы на области, в которых в равновесии находятся одна (расплав, твердый раствор) или две равновесные фазы. Правильное определения характера фазового равновесия в областях диаграммы существенно облегчает рассмотрение путей кристаллизации при охлаждении исходных расплавов системы. Следует напомнить читателю, что в этом пособии в дальнейшем будет рассматриваться охлаждение исходных составов и связанное с этим изменение фазового равновесия. При нагреве последовательность фазовых превращений будет обратной.
Рассмотрим подробней задачу определения областей фазовых равновесий. Для определения фаз, находящихся в равновесии, необходимо оценить, какие элементы диаграммы ограничивают рассматриваемую область слева и справа. Это могут быть:
· линия ликвации: одна из равновесных фаз – расплав;
· линии химических соединений – одна из равновесных фаз это данное химическое соединение;
· температурные вертикали – одна из равновесных фаз – один из компонентов диаграммы в кристаллическом состоянии;
· наклонные кривые солидуса – одна (или единственная) фаза – твердый раствор.
При этом анализе следует помнить о том, что кристаллические фазы могут находиться в равновесии в различных полиморфных модификациях.
Задача № 26. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил. 2, рис. П1).
Задача № 27. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил. 2, рис. П2).
Задача № 28. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил.2, рис. П3).
Задача № 29. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил. 2, рис. П4).
Задача № 30. Определить фазовое равновесие при температуре Т1 для исходного состава 1 (прил. 2, рис. П1, П2).
Задача № 31. Определить фазовое равновесие при температуре Т1 для исходного состава 1 (прил. 2, рис. П3, П4).
Силикаты щелочных металлов
3.3.1. Система Na2O – SiO2
Диаграмма Na2O – SiO2 (рис. 5) имеет в своем составе следующие химические соединения.
Ортосиликат натрия 2Na2O∙SiO2: Na2[SiO4]. Доля оксида натрия в составе соединения составляет 68,1 %.
Метасиликат натрия Na2O∙SiO2: Na2[SiO4]. Доля оксида натрия в составе соединения составляет 50,8 %.
Дисиликат натрия Na2O∙2SiO2. Доля оксида натрия в составе соединения составляет 34,0 %.
Эвтектика с минимальной температурой плавления 793 °С по мере увеличения доли кремнезема в исходном составе возрастает.
Составы, содержащие от 20 до 50 % оксида натрия, полностью переходят в расплав в интервале температур 790 – 1200 °С.
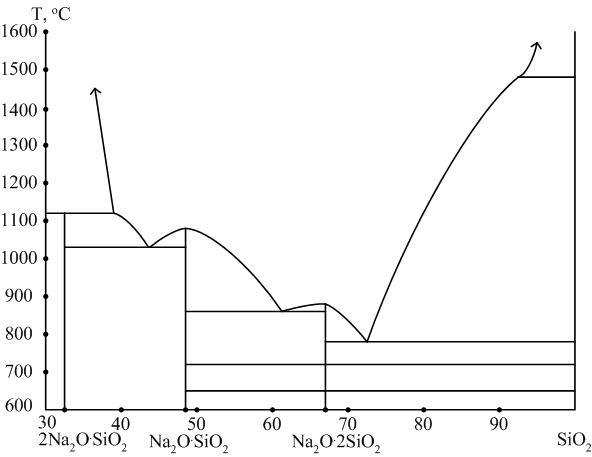
Рис. 5. Диаграмма Na2O – SiO2
Силикаты натрия растворимы в воде и используются для производства натриевого растворимого стекла состава Na2O∙nSiO2, где n – силикатный модуль стекла, изменяющийся от единицы до 4.
Растворимость силикатов натрия увеличивается со снижением силикатного модуля.
Жидкое стекло получают растворением силикат-глыбы, как правило, при избыточном давлении в автоклаве. Жидкое стекло обладает вяжущими свойствами и используется при изготовлении бумажных, деревянных и силикатных материалов, конструкций и изделий как вяжущее в кислотоупорных композициях, как средство для химического закрепления грунтов.
Задача № 32. Для системы Na2O – SiO2 определить максимальную температуру термообработки исходного сырья (сульфат натрия и кварцевый песок) для получения стекол с силикатным модулем 2,2.
Задача № 33. Для системы Na2O – SiO2 рассчитать состав шихты (исходное сырье карбонат натрия и кварцевый песок, содержащий 8 % органических примесей) для получения в системе при температуре 1000 °С расплава, содержащего 56 % SiO2.
Задача № 34. Известно, что в системе Na2O – SiO2 при температуре 1020 °С в равновесии с кристаллической фазой находится 40 % расплава. Определите все возможные для этих условий точки исходных составов и поясните, для какой из них растворимость силикат-глыбы будет выше.
Задача № 35. Рассматриваемый состав системы Na2O – SiO2, находящейся в равновесии, характеризуется следующими термодинамическими параметрами: температура 950 °С, количество расплава 30 %. Каким образом (не изменяя температуры) можно увеличить количество расплава до 50 %?
Задача № 36. Определить фазовый состав силиката (90 % SiO2 и 10 % Na2O) при температурах 1000 °С и 700 °С.
3.3.2. Система K2О – SiО2
В системе существует четыре химических соединения (рис. 6).
Ортосиликат калия 2K2О∙SiО2: K2[SiО4].
Доля оксида калия в составе силиката составляет 75,8 %. Соединение плавится конгруэнтно при температуре 513 °С, хорошо растворяется в воде. На диаграмме (рис. 6) соединение не показано.
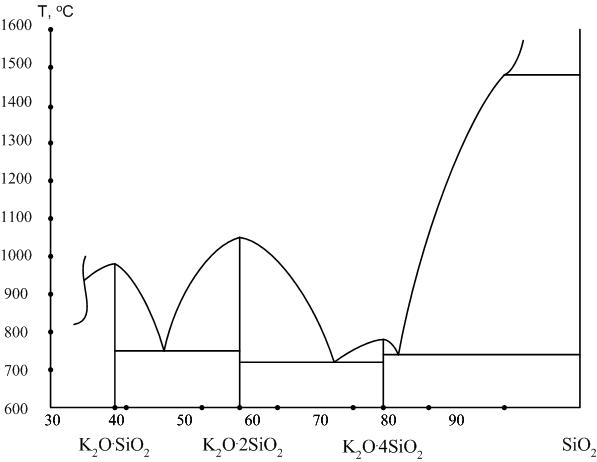
Рис. 6. Диаграмма K2О – SiО2
Метасиликат калия K2О∙SiО2: K2[SiО3].
Доля оксида калия в составе силиката составляет 61,0 %. Кристаллическая фаза гигроскопична, на воздухе кристаллы метасиликата легко растворяются парами воды.
Дисиликат натрия K2О∙2SiО2 и тетрасиликат калия K2О∙4SiО2, доля оксида калия в которых соответственно составляет 43,9 и 28,1 %.
Калиевые растворимые стекла по своим свойствам сходны с натриевыми, но в воде растворяются лучше последних.
Задача № 37. Определить, до каких температур следует нагреть исходные составы системы Na2O – SiO2 и K2О – SiО2 (доля SiO2 в составах 43 %), чтобы в равновесии с кристаллической фазой находилось 50 % расплава.
Задача № 38. Проведите анализ максимальной температуры обработки калиевых и натриевых силикатов одинакового состава с силикатным модулем 2 и 4 для получения в результате термообработки 80 % расплава. В каком случае энергозатраты будут выше?
Силикаты других металлов
3.4.1. Система MgO – SiO2
Интерес к изучению силикатов магния определяется их использованием в технологии производства магнезиальных огнеупоров и магнезиальных керамических материалов. Диаграмма системы MgO – SiO2 приведена на рис. 7.
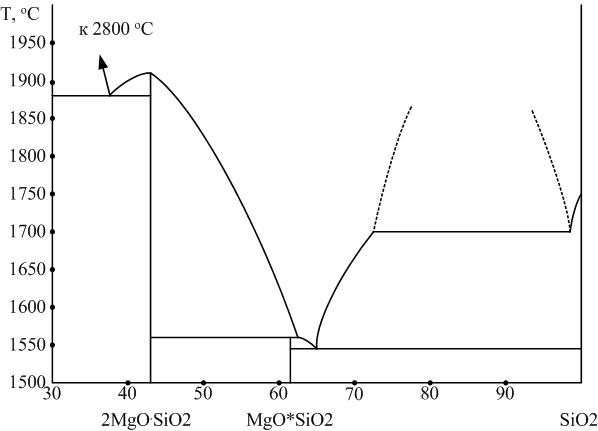
Рис. 7. Диаграмма двухкомпонентной системы MgO – SiО2
Ортосиликат магния 2MgO∙SiO2: Mg2[SiO4].
Природный аналог этого химического соединения носит название форстерит. Ортосиликат магния имеет высокую (1860...1890 °С) температуру плавления. В природе и в технических продуктах встречается главным образом в виде твердых растворов с фаялитом, называемых оливинами.
Метасиликат магния MgO∙SiO2: Mg[SiO3].
Плавится инконгруэнтно при температуре 1557 °С. Имеет несколько полиморфных модификаций, области фазовых равновесий которых и схемы полиморфных превращений которых на сегодня окончательно не установлены. Устойчивой при высоких температурах считается α-Mg[SiO3] – клиноэнстатит.
Диаграмма MgO – SiO2 интересна тем, что имеет высокую тугоплавкость бинарных составов. Даже эвтектические составы имеют температуру плавления не ниже 1543 °С.
Задача № 39. Для силиката магния, содержащего в своем составе 50 % SiO2, определить температуру, при которой степень спекания (массовая доля расплава в системе) достигает 30 %.
Задача № 40. Предложите параметры технологического процесса производства магнезиальных огнеупоров (исходные составы), для которых в процессе обжига при температуре 1860 оС образуется от 7 до 10 % расплава.
Задача № 41. Снизится ли огнеупорность силиката магния, нагретого до температуры 1700 °С, если в исходном составе доля кремнезема возрастет с 40 до 45 %?
Задача № 42. Можно ли магнезиальные огнеупоры использовать для футеровки стекловаренных печей (температура обработки не выше 1600 °С).
3.4.2. Система FeO – SiO2
Данная система играет важную роль в технологии силикатов.
Ортосиликат железа 2FeO∙SIO2: Fe2[SiO4].
Природный аналог этого химического соединения носит название фаялит. Ортосиликат железа плавится при температуре 1205 °С и при этом в расплаве образуется 2,25 % Fe2O3 и выделяется металлическое железо. Поэтому фаялит, несмотря на наличие максимума на кривой ликвидуса, относится к инконгруэнтно плавящимся соединениям. Фаялит образуется в богатых железом сварочных шлаках, в керамических изделиях в местах с повышенным содержанием в них железа.
В богатой кремнеземом части диаграммы наблюдается широкая область ликвации. При температуре 1698 °С одна жидкость содержит 97 %. другая – 60 % SiO2. Благодаря ликвации линия ликвидуса идет круто, а возникающее при введении добавки FeO к кремнезему количество жидкой фазы растет очень медленно с повышением температуры. Это позволяет применять в производстве динаса железистые минерализаторы и использовать такие огнеупоры в мартеновских печах без снижения их огневых свойств.
Задача № 43. Определить исходные составы в системе FeO – SiO2, для которых в продуктах кристаллизации находится 40 % фаялита. Для какого из этих составов кристаллизация начнется при более низкой температуре?
Задача № 44. Опишите процесс фазовых превращений в системе FeO – SiO2. (с изображением кривой охлаждения) исходного состава, для которого при некоторой температуре в равновесии в соотношении 3:2 находятся α-тридимит и расплав, содержащий 61 % SiO2.
Задача № 45. Определить объем, который при температуре 1730 °С будет занимать исходный состав системы массой 1 кг, содержащий 75 % SiO2, если плотности компонентов при этом будут составлять для SiO2 2,21 г/см3 и для FeO – 4,2 г/см3.
Задача № 46. Сравнить скорость нарастания количества жидкой фазы в системе FeO – SiO2 для исходных составов, содержащих 52 и 85 % SiO2 соответственно в температурном интервале от 1200 до 1350 °С.
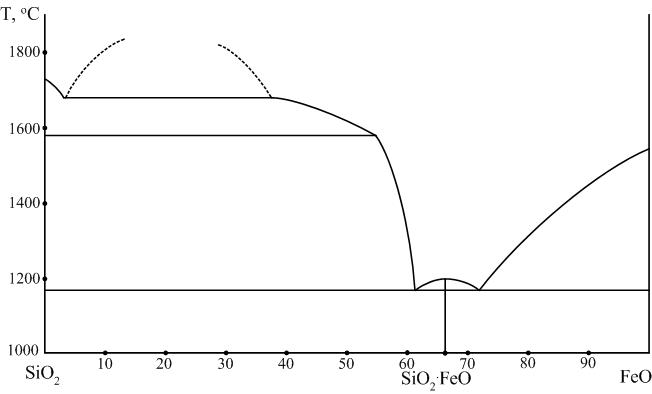
Рис. 8. Диаграмма двухкомпонентной системы FeO – SiO2
Задача № 47. Определить фазовый состав силиката (60 % SiO2, 40 % FeO) при температурах 1600 °С и 1300 °С.
3.4.3. Система PbO – SiO2
Диаграмма равновесия PbO – SiO2 представлена на рис. 9. Система является важной составной частью стекол и глазурей, содержащих свинец.
Тетрасиликат свинца 4PbO∙SiО2 среди других силикатов свинца обладает наибольшим светопреломлением (табл.2).
Таблица 2
Силикат свинца
Показатель светопреломления
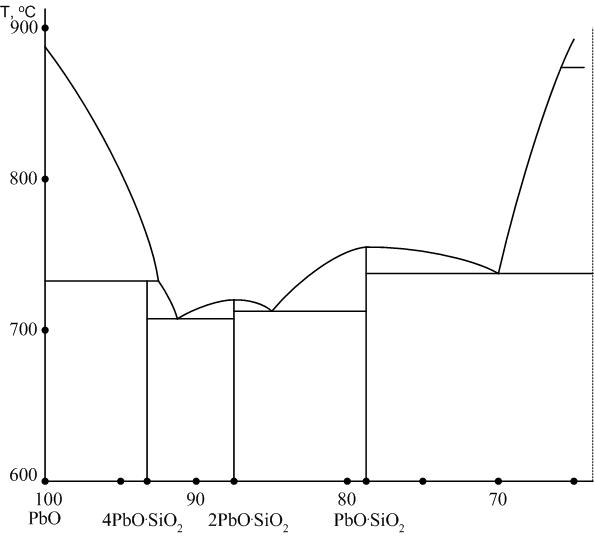
Рис. 9. Диаграмма двухкомпонентной системы PbO – SiO2
Именно по этой причине при производстве высококачественного хрусталя указывается молярный процент содержания оксида свинца в составе стекла (для хрусталя фирмы BOGEMIA молярная доля свинца достигает 32 %).
Задача № 48. Определить, какое количество тетрасиликата свинца получится в системе PbO – SiО2 при охлаждении исходного состава, содержащего 7 % по массе SiO2, до температуры 710 °С.
Ортосиликат свинца 2PbO∙SiО2 можно подучить кристаллизацией из расплава и при длительном отжиге свинцовых стекол.
Метасиликат свинца PbO∙SiО2 кристаллизуется из расплавов и при расстекловывании (кристаллизации) стекол.
Задача № 49. Определить исходный состав в системе PbO – SiО2, если известно, что в продуктах кристаллизации обнаружено 35 % кристаллов, имеющих показатель светопреломления 2,18.
Дата: 2018-11-18, просмотров: 869.