Некоторые ферменты, проферменты и их субстраты в норме постоянно циркулируют в крови человека и выполняют физиологические функции. Примерами функциональных ферментов плазмы являются липопротеинлипаза, псевдохолинэстераза, а также проферменты компонентов систем свертывания крови и растворения кровяного сгустка. Они синтезируются в печени, и их концентрация в крови либо такая же, как в тканях, либо более высокая.
Как следует из названия, нефункциональные ферменты плазмы не выполняют в крови никаких известных физиологических функций. Их субстраты в плазме обычно не обнаруживаются, и в норме их концентрация в крови человека почти в миллион раз ниже, чем в тканях. Появление этих белков в плазме в повышенных концентрациях указывает на повышенную скорость деструкции тканей. Таким образом, измерение в крови уровня нефункциональных ферментов плазмы дает врачу ценную диагностическую и прогностическую информацию.
Диагностическое и прогностическое значение специфических ферментов:
количественное определение некоторых нефункциональных ферментов плазмы (таблица) →
Для диагностики генетических заболеваний применяют эндонуклеазы рестрикции (пренатальный скрининг наследственных нарушений благодаря картированию ДНК зародышевых клеток, находящихся в амниотической жидкости).
Энзимотерапия
1. Заместительная терапия (прижелудочно-кишечные заболевания, связанные с недостаточностью секреции пищеварительных соков. Препараты – фестал, креон, мезим-форте и др.).
2. Элементы комплексной терапии – применение ферментов в сочетании с другой терапией. Так, протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран, для удаления сгустков крови и пр. Рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов. Ферментные препараты применяют при тромбозах и тромбоэмболиях (фибринолизин, стрептолиазы, стрептодеказы, урокиназы). Гиалуронидазу (лидаза) используют подкожно и внутримышечно для рассасывания контракткр рубцов после ожогов и операций. Ферментные препараты применяют при онкологических заболеваниях (аспарагиназа используется при лечении лейкозов).
Ингибиторы ферментов, как лекарственные препараты
Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Так, например, ингибиторы холинэстеразы (прозерин и др.) используют для лечения мышечных дистрофий.
В качестве ингибиторов ферментов, действующих по конкурентному механизму, в медицинской практике используют вещества, называемые антиметаболитами. С одной стороны, эти вещества, являясь структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, а с другой – могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью и в результате наблюдается снижение скорости определённых метаболических путей. Такими антиметаболитами являются: сульфаниламидные препараты (аналоги пара-аминобензойной кислоты), аналоги нуклеотидов и др.
Аспирин – пример лекарственного препарата, действующего по принципу необратимого ингибирования. Он необратимо ингибирует циклооксигеназу (фермент катализирует реакцию образования простагландинов из арахидоновой кислоты), в результате чего снижается образование простагландинов, которые являются, кроме всего прочего, медиаторами воспаления.
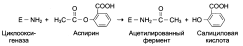
Наследственные энзимопатии
Энзимопатии – нарушения функционирования ферментов в клетке. Различают 2 вида энзимопатий: 1) первичные (наследственные – дефектные ферменты наследуются в основном по аутосомно-рецессивномутипу. Примеры – альбинизм, алкаптонурия, болезнь Гирке); 2) вторичные (приобретённые, по-видимому, наблюдаются при всех болезнях).
 Приведите примеры других наследственных энзимопатий и их клинические проявления.
Приведите примеры других наследственных энзимопатий и их клинические проявления.
Дата: 2018-11-18, просмотров: 974.