Клетки могут синтезировать специфические ферменты в ответ на присутствие специфических низкомолекулярных индукторов.
Ферменты, концентрация которых в клетке не зависит от добавления индукторов, называются конститутивными.
Обычно клетки содержат небольшое, но измеримое количество соответствующего фермента даже в отсутствие индуктора. Это – базовый уровень. Величина отклика данного организма на введение индуктора определяется генетически.
При индукции может наблюдаться повышение содержания фермента, варьирующее от двукратного до тысячекратного. Таким образом, содержащаяся
в клетке наследственная генетическая информация определяет и характер, и величину реакции на введение индуктора.
Примерами индуцируемых ферментов у млекопитающих являются триптофанпирролаза, треониндегидраза, тирозин-α-оксоглутарат-трансаминаза, инвертаза, ферменты цикла мочевины, HMG-СоА-редуктаза и цитохром Р-450.
| Некоторые ферменты, для действия которых необходимы в качестве кофакторов ионы и атомы металлов: | 
|
| Коферменты, выполняющие роль промежуточных переносчиков некоторых атомов или функциональных групп: | 
|
Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: фосфорилирование и дефосфорилирование, ограниченный протеолиз проферментов
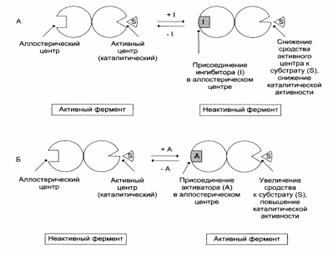 Принципы регуляции метаболических путей
Регуляция каталитической активности фермента – отрицательная обратная связь:
Принципы регуляции метаболических путей
Регуляция каталитической активности фермента – отрицательная обратная связь:
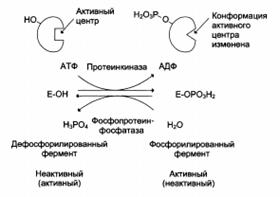
 Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования:
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования:
| Ковалентная модификация, регулирующая работу фермента и осуществляемая путем фосфорилирования/дефосфорилирования остатка серина | 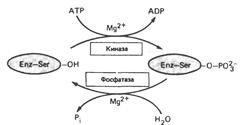
|
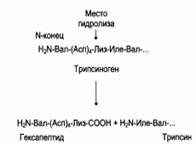
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом:
| Ингибирование по принципу обратной связи на различных участках разветвленного биосинтетического пути. | 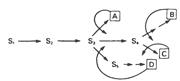
|
S1-S5 – промежуточные соединения, образующиеся в ходе биосинтеза конечных продуктов A-D. Прямые стрелки соответствуют ферментам, катализирующим указанные превращения. Кривыми стрелками указаны петли обратной связи и вероятные участки ингибирования по принципу обратной связи специфическими конечными продуктами.
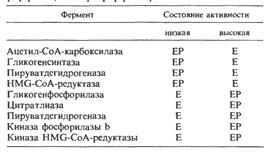
Некоторые ферменты млекопитающих, каталитическая активность которых в фосфорилированном и дефосфорилированном состояниях различна (Е – дефосфофермент, ЕР – фосфофермент):
Дата: 2018-11-18, просмотров: 965.