Количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции.
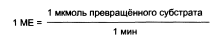
В 1973 г. была принята новая единица активности ферментов: 1 кат (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяю по формуле:

В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности – МЕ.
Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд.ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:

Специфичность ферментов: субстратная, каталитическая.
Субстратная специфичность
Субстрат ная специфичность – это способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Выделяют три вида субстратной специфичности: 1. Абсолютная. 2. Групповая. 3. Стереоспецифичность.
1. Абсолютная субстратная специфичность:
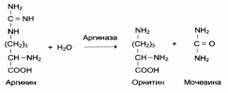
2. Групповая субстратная специфичность:
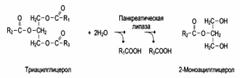
3. В организме человека наблюдается специфичность ферментов к следующим стереоизомерам: 1) к D-сахарам; 2) цис-транс-изомерам; 3) к L-аминокислотам; 4) к α- и β-гликозидным связям.
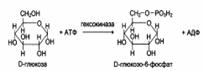
Стереоспецифичность к D-сахарам:
 Каталитическая специфичность
Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата:
| Относительные размеры молекулы фермента (мол. масса 100 000, диаметр 7 нм) и типичной молекулы субстрата (мол. масса 250, длина 0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды. | 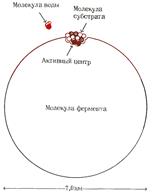
|
| Функциональная значимость отдельных участков активного центра фермента: | 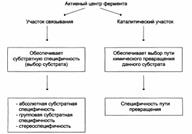
|
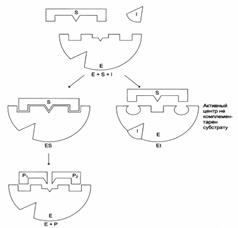
I – этап сближения и ориентации субстрата относительно активного центра фермента;
II – образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия;
III – деформация субстрата и образование нестабильного комплекса фермент0продукт (ЕР);
IV – распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
| Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами: | 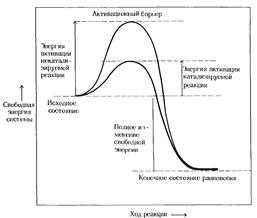
|
Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов
| Структура (А) и химическое строение (Б) коферментов FMN (ФМН) и FAD (ФАД): | 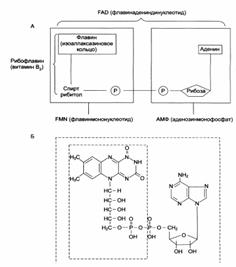
|
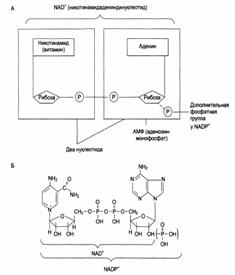
Структура (А) и химическое строение (Б) коферментов NAD + (НАД) и NADP + (НАДФ): →
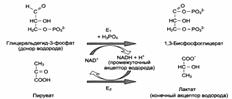
Роль коферментов:
| 
|
Ингибирование ферментативной активности:
1. Обратимое (конкурентное, неконкурентное, бесконкурентное).
Необратимое.
Схема конкурентного ингибирования активности фермента:
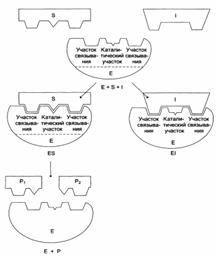
Схема неконкурентного ингибирования активности фермента:
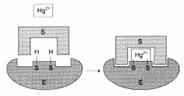
Необратимое ингибирование
Механизм действия ионов ртути как необратимого ингибитора:
Дата: 2018-11-18, просмотров: 985.