Тема 3. Ферменты
Лекция 5. Ферменты
Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов.
Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов.
Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
Классификация и номенклатура ферментов. Изоферменты. Органоспецифические ферменты. Энзимодиагностика и энзимотерапия. Ингибиторы ферментов как лекарственные препараты. Наследственные энзимопатии.
Практическое значение анализа изоферментных спектров в крови (ЛДГ, КК и др.). Применение ферментов как аналитических реагентов при лабораторной диагностике.
| Краткое содержание | Конспект |
Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов

| А – присоединение субстрата к ферменту в активном центре. Б – положение аминокислотных остатков, формирующих активный центр фермента в первичной структуре белка. В – активный центр фермента условно разделяется на участок связывания и каталитический участок. Участок связывания представлен радикалами аминокислот, функциональные группы которых обеспечивают связывание субстрата. Каталитический участок образован радикалами аминокислотных остатков, функциональные группы которых обеспечивают химические превращения субстрата. |
Этапы ферментативного катализа:

Энергия активации
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
Разницу энергий между исходным реагентом и конечными продуктами называют изменением свободной энергии реакции (ΔG).
| Зависимость скорости ферментативной реакции ( V ) от концентрации фермента: | 
|
| Зависимость скорости ферментативной реакции ( V ) от температуры: | 
|
| Зависимость скорости ферментативной реакции ( V ) от рН среды: | 
|
Субстратная специфичность
Субстрат ная специфичность – это способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Выделяют три вида субстратной специфичности: 1. Абсолютная. 2. Групповая. 3. Стереоспецифичность.
1. Абсолютная субстратная специфичность:
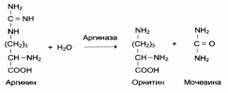
2. Групповая субстратная специфичность:
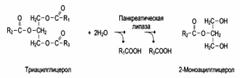
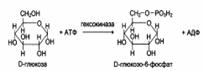
3. В организме человека наблюдается специфичность ферментов к следующим стереоизомерам: 1) к D-сахарам; 2) цис-транс-изомерам; 3) к L-аминокислотам; 4) к α- и β-гликозидным связям.
Стереоспецифичность к D-сахарам:
 Каталитическая специфичность
Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата:
| Относительные размеры молекулы фермента (мол. масса 100 000, диаметр 7 нм) и типичной молекулы субстрата (мол. масса 250, длина 0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды. | 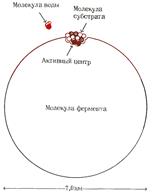
|
| Функциональная значимость отдельных участков активного центра фермента: | 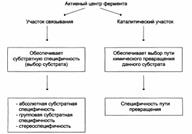
|
I – этап сближения и ориентации субстрата относительно активного центра фермента;
II – образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия;
III – деформация субстрата и образование нестабильного комплекса фермент0продукт (ЕР);
IV – распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
| Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами: | 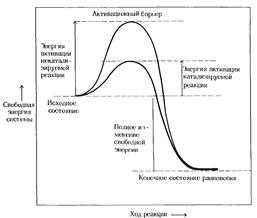
|
Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов
| Структура (А) и химическое строение (Б) коферментов FMN (ФМН) и FAD (ФАД): | 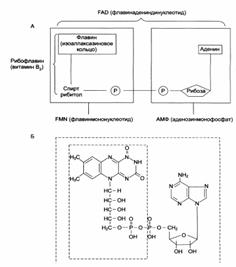
|
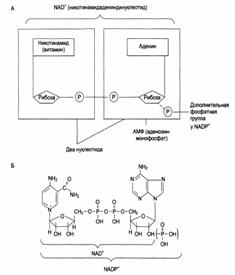
Структура (А) и химическое строение (Б) коферментов NAD + (НАД) и NADP + (НАДФ): →
Роль коферментов:
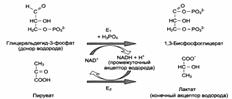
| 
|
Ингибирование ферментативной активности:
1. Обратимое (конкурентное, неконкурентное, бесконкурентное).
Необратимое.
Схема конкурентного ингибирования активности фермента:
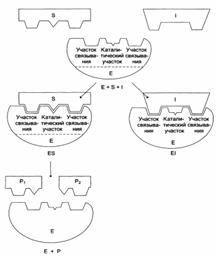
Схема неконкурентного ингибирования активности фермента:
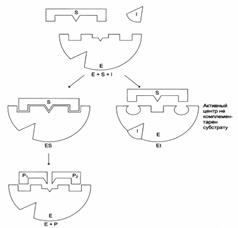
Необратимое ингибирование
Механизм действия ионов ртути как необратимого ингибитора:
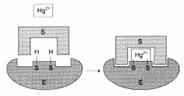
Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: фосфорилирование и дефосфорилирование, ограниченный протеолиз проферментов
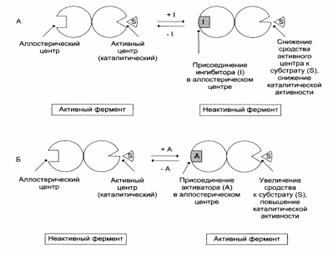 Принципы регуляции метаболических путей
Регуляция каталитической активности фермента – отрицательная обратная связь:
Принципы регуляции метаболических путей
Регуляция каталитической активности фермента – отрицательная обратная связь:
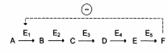 Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования:
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования:
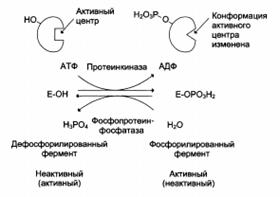
| Ковалентная модификация, регулирующая работу фермента и осуществляемая путем фосфорилирования/дефосфорилирования остатка серина | 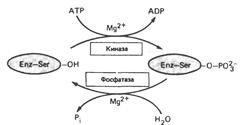
|
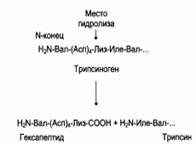
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом:
| Ингибирование по принципу обратной связи на различных участках разветвленного биосинтетического пути. | 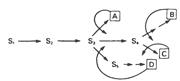
|
S1-S5 – промежуточные соединения, образующиеся в ходе биосинтеза конечных продуктов A-D. Прямые стрелки соответствуют ферментам, катализирующим указанные превращения. Кривыми стрелками указаны петли обратной связи и вероятные участки ингибирования по принципу обратной связи специфическими конечными продуктами.
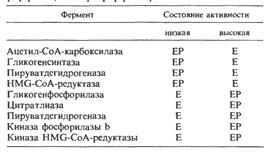
Некоторые ферменты млекопитающих, каталитическая активность которых в фосфорилированном и дефосфорилированном состояниях различна (Е – дефосфофермент, ЕР – фосфофермент):
Оксидоредуктазы
Дегидрогеназы

Трансферазы

Гидролазы

Лиазы

Изомеразы

Когда изомеризация состоит из внутримолекулярном переносе группы, фермент называют «мутазой»:

Лигазы (синтетазы)

В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами

Физически различимые формы ферментов, обладающие одним и тем же видом каталитической активности, могут присутствовать в разных тканях одного организма, в разных типах клеток одной ткани и даже в прокариотическом организме, например в Е. coli.
Термин «изофермент» («изозим») охватывает все вышеупомянутые физически различимые белки с данной каталитической активностью, однако на практике, и особенно в клинической медицине, его употребляют в более узком смысле, подразумевая физически различимые и поддающиеся разделению формы данного фермента, присутствующие в различных типах клеток данного эукариотического организма, например человека. Известны изоферментные формы дегидрогеназ, оксидаз, трансаминаз, фосфатаз, трансфосфорилаз и протеолитических ферментов. В различных тканях могут находиться разные изоферменты, и эти изоферменты могут иметь неодинаковое сродство к субстратам.
Органоспецифичность
В процессе дифференцировки клеток происходит изменение ферментного состава клеток. Так, фермент аргиназа (участвует в синтезе мочевины) находится только в клетках печени, кислая фосфатаза (участвует в гидролизе моноэфиров ортофосфорной кислоты) – в клетках простаты.
Энзимотерапия
1. Заместительная терапия (прижелудочно-кишечные заболевания, связанные с недостаточностью секреции пищеварительных соков. Препараты – фестал, креон, мезим-форте и др.).
2. Элементы комплексной терапии – применение ферментов в сочетании с другой терапией. Так, протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран, для удаления сгустков крови и пр. Рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов. Ферментные препараты применяют при тромбозах и тромбоэмболиях (фибринолизин, стрептолиазы, стрептодеказы, урокиназы). Гиалуронидазу (лидаза) используют подкожно и внутримышечно для рассасывания контракткр рубцов после ожогов и операций. Ферментные препараты применяют при онкологических заболеваниях (аспарагиназа используется при лечении лейкозов).
Наследственные энзимопатии
Энзимопатии – нарушения функционирования ферментов в клетке. Различают 2 вида энзимопатий: 1) первичные (наследственные – дефектные ферменты наследуются в основном по аутосомно-рецессивномутипу. Примеры – альбинизм, алкаптонурия, болезнь Гирке); 2) вторичные (приобретённые, по-видимому, наблюдаются при всех болезнях).
 Приведите примеры других наследственных энзимопатий и их клинические проявления.
Приведите примеры других наследственных энзимопатий и их клинические проявления.
Изоформы креатинкиназы
Креатинкиназа (КК) это димер, который катализирует реакцию образования креатинфосфата:
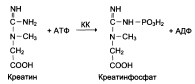
Существует 3 изофермента – ВВ, МВ, ММ (В – brain – мозг, М – musle – мышца). Изофермент ВВ преимущественно находится в мозге, ММ – в скелетных мышцах, МВ – в сердечной мышце. В норме активность КК не должны превышать 90 МЕ/л.
Энзимодиагностика
Энзимодиагностика – это постановка диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принцип энзимодиагностики основан на следующих позициях:
1) при повреждении клеток в крови (или другой биологической жидкости) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
2) количество высвобождённого фермента достаточно для его обнаружения;
3) активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
4) ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
5) существуют различия во внутриклеточной локализации ряда ферментов.
С помощью ферментов можно также определять содержание различных веществ в биологических жидкостях (глюкоза, холестерин и др.).
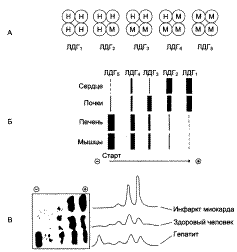 А – строение различных изоформ ЛДГ; Б – распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В – содержание изоформ ЛДГ в плазме крови в норме и при патологии.
А – строение различных изоформ ЛДГ; Б – распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В – содержание изоформ ЛДГ в плазме крови в норме и при патологии.
| Изменение активности ферментов в плазме крови при инфаркте миокарда. | 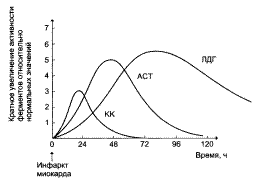
|
Тема 3. Ферменты
Лекция 5. Ферменты
Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов.
Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов.
Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
Классификация и номенклатура ферментов. Изоферменты. Органоспецифические ферменты. Энзимодиагностика и энзимотерапия. Ингибиторы ферментов как лекарственные препараты. Наследственные энзимопатии.
Дата: 2018-11-18, просмотров: 1338.