Работа проводится в следующей последовательности.
1. Приготовление 250 мл 0,1 нормального стандартного раствора щавелевой кислоты.
2. Приготовление 250 мл 0,1 нормального раствора щелочи из 4%-ного раствора.
3. Определение точной концентрации приготовленной щелочи.
4. Определение процентного содержания контрольного раствора кислоты.
Теоретический расчёт
1. Расчёт массы щавелевой кислоты для приготовления 250 мл 0,1 нормального раствора
М H2C2O4 2H2O = 126 г.
г-экв. H2C2O4 2H2O = 126:2 = 63 г.
Если: 1000мл — 1г-экв — 1 N
значит: 1000 мл — 63 г. — 1 N
1000 мл — 6,3 г. — 0,1N
250 мл — Х г. — 0,1 N
отсюда:
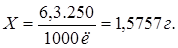
Значит, для приготовления 0,1 N раствора на аналитических весах отмеряем 1,5757 г щавелевой кислоты, переносим в колбу на 250 мл, растворяем в небольшой порции воды, приливаем до метки воду и тщательно перемешиваем.
2. Приготовление 250 мл 0,1 N раствора NaOH из 4% раствора.
М NaOH = 40 г. Г — экв NaOH = 40 г.
Если: 1000 мл — 40 г — 1 N
1000 мл — 4 г — 0,1N
250 мл — Х г — 0,1 N
отсюда: Х = (250 · 4): 1000 = 1 г
Значит для приготовления 250 мл 0,1N растворы NaOH необходимо взять 1г щелочи. Но NaOH сильно притягивает влагу и практически навеску его на аналитических весах отвесить невозможно. Поэтому раствор будем готовить из заранее приготовленного ~ 4%-ного раствора. Рассчитаем сколько мл 4%-ного NaOH необходимо взять, чтобы раствор содержал 1 г
Если 100 мл — 4 г — 4%
Х мл — 1 г
Х = (100 1): 4 = 25 мл
Значит, чтобы приготовить 250 мл 0,1 N раствора NaOH, отбираем мерным цилиндром 25 мл 4%го раствора NaOH, приливаем в колбу на 250 мл, приливаем до метки воду и тщательно перемешиваем.
3. Определение точной концентрации NaOH
В коническую колбу при помощи пипетки или бюретки приливаем 10 мл 0,1N щавелевой кислоты, добавляем 1-2 капли индикатора - фенолфталеина (ф-ф) и титруем, приливая по каплям из бюретки раствор NaOH до появления слаборозовой окраски.
H2C2O4 + 2NaOH — Na2C2O4 + 2H2O
Опыты повторяем 4 раза и результаты записываем в таблицу
| V H2C2O4, мл | 10 | 10 | 10 | 10 |
| V NaOH, мл |
Из трех близких значений вычисляем средний результат и по формуле рассчитываем нормальность NaOH:
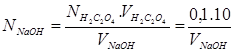
4. Определение % содержания кислоты.
В мерную колбу на 250 мл приливают 5-10 мл контрольной кислоты, разбавляют до метки водой и тщательно перемешивают. При помощи пипетки или бюретки отбирают 10 мл кислоты, приливают в коническую колбу, добавляют 1-2 капли фенолфталеина и титруют рабочим раствором NaOH до бледно-розовой окраски. Опыты повторяют 4 раза и результаты титрований записывают в таблицу.
Из трех близких результатов рассчитывают средний и по формуле определяют процентное содержание кислоты:
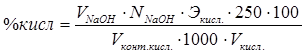
Лабораторная работа №11
МЕТОДЫ ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Перманганатометрия
Метод основан на высокой окислительной способности перманганат ионов в кислой среде, например ионов Fe2+ по реакции:
5Fe2+ + MnO4- + 8H+ — 5Fe3+ + Mn+2 + 4H2O
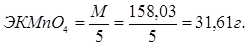
Порядок выполнения работы:
1. Приготовление 250 мл 0,05N раствора КМnO4 из ~ 3% раствора.
2. Определение точной концентрации KMnO4
3. Определение граммового содержания железа.
Теоретические расчеты
1. Рассчитаем сколько мл. 3% раствора KMnO4 необходимо для приготовления 250 мл 0,05 раствора
1000 мл — 1 г - экв — 1N
1000 мл — 31,61 г — 1N
1000 мл — 1,5805 г — 0,05N
250 мл — Х г — 0,05N
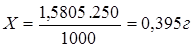
Наш исходный раствор 3% поэтому:
100 мл — 3 г — 3%
Х мл — 0,395 г — 3%
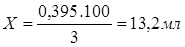
Значит, чтобы приготовить 250 мл. 0.05N раствор KMnO4 отбираем мерным цилиндром 13,2 мл 3% раствора KMnO4, приливаем в колбу на 250 мл, доливаем до метки воду и тщательно перемешиваем.
2. Определение точной концентрации KMnO4: при помощи пипетки или бюретки отбираем 5 мл 0,1N щавелевой кислоты, приливаем в коническую колбу, добавляем 10-15 мл 10% ной H2SO4 нагреваем до ~ 80оС и титруем в горячем виде раствором KMnO4 до слабо-розовой окраски. После добавления 1-2 капель KMnO4 смесь тщательно перемешиваем до обесцвечивания затем продолжаем титровать обычным способом.
5C2O42- + KMnO4- + 16 H+ — KMn2+ + 8H2O + 10СО2↑
Опыты повторяем 4 раза и из трёх близких результатов берем средний и по формуле рассчитываем нормальность KMnO4
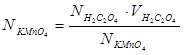
3. Определение граммового содержания Fe2+
К контрольному раствору железа в конической колбе приливаем 10-15 мл 10% раствора H2SO4 и титруем рабочим раствором KMnO4 до бледно-розовой окраски. После добавления 1-2 капель KMnO4 раствор тщательно перемешиваем до обесцвечивания и далее титруем обычным способом.
Граммовое содержание железа рассчитываем по формуле:

Лабораторная работа № 12
ЙОДОМЕТРИЯ
Определение граммового содержания меди ( Cu 2+ )
Метод основан на окислительно-восстановительных процессах, связанных с окислением ионов J- до J2
2J- - 2e → J2
Порядок выполнения работы.
1. Приготовление 250 мл 0,1N раствора K2Cr2O7
2. Определение концентрации рабочего раствора Na2S2O3
3. Определение граммового содержания меди.
Теоретические расчеты
1. Приготовление 250 мл 0,1N раствора K2Cr2O7.
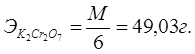
Значит 1000 мл — 49,03 г — 1N
1000 мл — 4,903 г — 0,1N
250 мл — Х г — 0,1N

Значит, чтобы приготовить 250 мл 0,1N раствора необходимо на аналитических весах взвесить 1,2257 г K2Cr2O7 перенести в медную колбу, растворить в небольшом количестве воды, долить до метки водой и тщательно перемешать.
2. Определение концентрации Na2S2O3:
В коническую колбу приливают мерным цилиндром 5-7 мл 20%-ного раствора KJ и 1—15 мл 10%-ного раствора H2SO4. При помощи пипетки или бюретки добавляют 1- мл 0,1N раствора K2Cr2O7, накрывают колбу часовым стеклом и оставляют в темноте 5 мин для завершения реакции:
Cr2O72- + 6J- + 14H+ — 3J2 + 2Cr3+ + 7H2O
Образовавшийся J2 раствор бурого цвета титруют тиосульфатом (Na2S2O3) до соломенно-жёлтого цвета. Затем приливают 5 мл раствора крахмала и образовавшийся раствор синего цвета оттитровывают тиосульфатом до бледно-зелёного цвета:
J2 + 2S2O32- — 2J - + S4O62-
Опыт повторяют 4 раза и из трех близких рассчитывают средний результат и нормальность тиосульфата вычисляют по формуле:
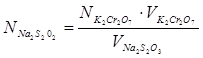
3. Определение граммового содержания Cu2+:
В коническую колбу с исследуемым раствором меди приливают из мерного цилиндра 15 мл 20%-ного раствора KJ и 2 мл 10% K2SO4 колбу накрывают часовым стеклом и оставляют в темноте на 5 минут для завершения реакции:
Cu2+ + 4J- — 2CuJ↓ + J2
Образовавшую бурую муть титруют тиосульфатом до бледно-жёлтого цвета, приливают 5 мл раствора крахмала и титруют до исчезновения синей окраски. Опыты повторяют 4 раза, из близких 3 значений вычисляют средний результат и рассчитывают граммовое содержание Cu2+по формуле:

г-экв Cu2+ = Г-атому = 63,54 г.
Лабораторная работа №13
Методы комплексообразования
На практике аналитической химии чаще используют комплексон-III. Это двунатриевая соль этилен диаминотетроуксусной кислоты, который образует со многими металлоионами внутрикомплексные соединения.
Регулируя pH среды и подбирая соответствующие индикаторы методом комплексонометрии можно определять очень многие металлы, общую жёсткость воды и т.д.
Индикаторы, применяемые в комплексонометрии называют металлохромными индикаторами. Они тоже образуют с ионами металлов комплексы, окрашенные в разные цвета.
Определение общей жёсткости воды.
Порядок выполнения работы.
1. Приготовление 250 мл ~ 0,1 N раствора комплексона - III
2. Определение точной концентрации комплексона - III
3. Определение общей жёсткости водопроводной воды.
1. Приготовление 250 мл 0,1N раствора комплексона-III теоретический расчет.
МК-III = 372 г.
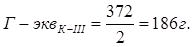
Значит: 1000 мл — 186 г. — 1N
1000 мл — 18,6 г. — 0,N
250 мл — Х2 — 0,1N
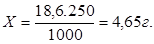
Значит, чтобы приготовить 250 мл 0,1N раствора на аналитических весах отбираем 4,65 г комплексона III, переносим в колбу на 250 мл, растворяем в небольшом объеме воды, приливаем затем до метки воду и тщательно перемешиваем.
2. Определение точной концентрации комплексона III
В коническую колбу при помощи пипетки или бюретки отбираем 10 мл 0,1N раствора нитрата или хлорида цинка, добавляем 10-15 мл аммонийной буферной смеси, на кончике штапеля индикатор хромоген чёрный и образовавшийся раствор красного цвета титруем комплексном-III до синей окраски. Из четырёх определений берем средний результат трёх близких результатов и рассчитываем нормальность комплексона III по формуле:

3. Определение общей жёсткости воды.
В коническую колбу приливаем отмеренный мерным цилиндром 100 мл водопроводной воды, добавляем 10-15 мл аммонийной буферной смеси, на кончике штапеля индикатор хромоген чёрный и титруем красноватый раствор комплексоном III до синего цвета.
Определение повторяем четыре раза и результаты записываем в таблицу. Из трех близких результатов рассчитываем средний и рассчитываем общую жёсткость воды по формуле:
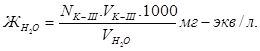
ЛИТЕРАТУРА
1. Миркамилова М.С. «Аналитик кимё», Тошкент, 2003 й.
2. Миркомилова М.С. «Аналитик кимё», Тошкент, 2000 й.
3. Васильев В.П. «Аналитическая химия» 1-2 том. М., Химия, 1089 г.
4. Алексеев В.Н. Курс качественного химического полмикроанализа. М., Химия, 1972 г.
5. Алексеев В.Н. «Количественный анализ». М., Химия, 1972 г.
6. Крешков А.Н. «Основы аналитической химии» 1-2 том. М., Химия, 1965 г.
Дата: 2019-12-10, просмотров: 341.