Качественный анализ
Лабораторная работа №1
Общая характеристика катионов I группы
В I группу входят катионы NН4+, К+, Na+, Mg2+ и др.
Многие их соли хорошо растворимы в воде, особенно их сульфаты, хлориды, карбонаты, что немаловажно маловажно для анализа. В отличие от других групп катионы I группы не имеют группового реагента.
Цель работы : Изучении характерных качественных реакций I- группы катионов.
Реакции катионов NH4+
1. Открытие реактивом Несслера – K2[Hg J4] · 4 KOH.
Для выполнения реакции отбираем в пробирку 1-2 капли раствора соли аммония, приливаем 2-4 капли реактива Несслера. Красно-бурый осадок говорит о присутствии катиона NH4+.

 Нg
Нg

 NH4Cl+2K2 [Hg J4] 4KОН→[O NH2] J↓+7KJ+KCl+2H2O
NH4Cl+2K2 [Hg J4] 4KОН→[O NH2] J↓+7KJ+KCl+2H2O
Na
2.  Реакции со щелочами:
Реакции со щелочами:

 NH4Cl+NaOH → NH4OH+NaCl
NH4Cl+NaOH → NH4OH+NaCl
NH3↑ H2O
К 2-3 каплям раствора соли аммония приливаем 3-4 капли щелочи и нагреваем в водяной бане. По запаху аммиака или по посинению лакмусовой бумажке, смоченной водой и приложенной к горлышке пробирки определяем наличие катионов аммония.
Реакции катионов К+
1. Открытие действием кобальтинитритом натрия
2KCl+Na3[СО(NO2) 6]→K2Na[СО(NO2) 6] ↓+2NaCl
В этой реакции в пробирку приливаем 1-2 капли раствора соли калия и добавляем 3-4 капли Na3[СО(NO2) 6]. Образование жёлтого осадка говорит о присутствии катионов K+.
2. Действие винной кислотой или кислым виннокислым натрием.
Н2C4Н4O6+CН3CОONa→NaHС4H4O4+ CH3СООН
KCl+NaHС4H4O6→KHC4H4O6↓+NaCl
В пробирку приливаем 2-3 капли раствора соли калия, добавляем 3-4 капли винной кислоты и 3-4 капли CH3СООNa. Пробирку со смесью охлаждаем под струёй водопроводной воды и потираем стенки пробирки с раствором стеклянной палочкой. Образуется белый кристаллический осадок. Осадок сразу не выпадает потому что образуются пересыщенные растворы и частицы стекла, образованные потиранием стеклянной палочкой, являются центром кристаллизации и способствуют выпадению осадка.
Реакции катионов Mg 2+
1. Открытие гидрофосфатом натрия.
NH4Cl
 MgCl2+Na2HPO4+NH4OH MgNH4PO4↓ +2NaCl+H2O
MgCl2+Na2HPO4+NH4OH MgNH4PO4↓ +2NaCl+H2O
рН=9.2
В этой реакции в пробирку проливаем 2-3 капли раствора соли магния, добавляем 1-2 капли аммонийной буферной смеси и 3-4 капли Na2HPO4. Образуется белый кристаллический осадок.
2. Действие щелочей.
MgCl2+2NaOH→Mg(OH)2+2NaCl
MgCl2+2KOH→Mg(OH)2+2KCl
В пробирку приливаем 2-3 капли раствора соли магния, 2-3 капли воды и 3-4 капли щёлочи. Образуется белый аморфный осадок.
Лабораторная работа №2
Лабораторная работа №3
Лабораторная работа № 4
Лабораторная работа №5
Лабораторная работа №6
Лабораторная работа №7
Лабораторная работа №8
Анализ сухой соли
I . Растворение сухой соли.
Часть сухой соли переносят в пробирку, приливают четверть пробирки воды и тщательно встряхивают. Если соль не растворяется, то вначале его растворяют в уксусной, далее в азотной кислоте.
II . Анализ катионов.
1. Если соль состоит из катионов III группы, образование осадка с сульфидом аммония, то определение проводят согласно анализу смеси III группы катионов.
2. Если не образуется осадок с (NH4)2S, то катион или I или II группы. В этом случае проверяют наличие II группы действием карбоната аммония. При образовании белого осадка проводят реакции открытия бария и кальция.
2. Если при действии карбоната аммония не образуется белый осадок, значит присутствуют катионы только I группы и проводят открытие катионов аммония, магния и калия.
III . Открытие анионов.
Это определение проводят по методу анализа смеси анионов трех групп, что указано было выше.
Лабораторная работа №9
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Метод нейтрализации
В титриметрическом (объемном) анализе раствор с точно известной концентрацией (титрованный или стандартный раствор) помещают в бюретку и по каплям приливают к исследуемому раствору с известным объемом, помещённый в коническую колбу и постоянно перемешивают. По изменению окраски индикатора или другим признакам определяют эквивалентный объем, затраченный на реакцию и подставляя его значение (V) в расчетные формулы определяют количество исследуемого вещества.
Метод нейтрализации или кислотно-основного титрования основан на реакции:
H+ + OH- = H2O
и позволяет определять концентрации кислот, щелочей, гидролизирующихся солей и т.д.
Лабораторная работа №10
Лабораторная работа №11
Перманганатометрия
Метод основан на высокой окислительной способности перманганат ионов в кислой среде, например ионов Fe2+ по реакции:
5Fe2+ + MnO4- + 8H+ — 5Fe3+ + Mn+2 + 4H2O
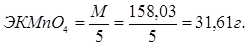
Порядок выполнения работы:
1. Приготовление 250 мл 0,05N раствора КМnO4 из ~ 3% раствора.
2. Определение точной концентрации KMnO4
3. Определение граммового содержания железа.
Теоретические расчеты
1. Рассчитаем сколько мл. 3% раствора KMnO4 необходимо для приготовления 250 мл 0,05 раствора
1000 мл — 1 г - экв — 1N
1000 мл — 31,61 г — 1N
1000 мл — 1,5805 г — 0,05N
250 мл — Х г — 0,05N
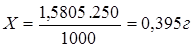
Наш исходный раствор 3% поэтому:
100 мл — 3 г — 3%
Х мл — 0,395 г — 3%
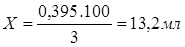
Значит, чтобы приготовить 250 мл. 0.05N раствор KMnO4 отбираем мерным цилиндром 13,2 мл 3% раствора KMnO4, приливаем в колбу на 250 мл, доливаем до метки воду и тщательно перемешиваем.
2. Определение точной концентрации KMnO4: при помощи пипетки или бюретки отбираем 5 мл 0,1N щавелевой кислоты, приливаем в коническую колбу, добавляем 10-15 мл 10% ной H2SO4 нагреваем до ~ 80оС и титруем в горячем виде раствором KMnO4 до слабо-розовой окраски. После добавления 1-2 капель KMnO4 смесь тщательно перемешиваем до обесцвечивания затем продолжаем титровать обычным способом.
5C2O42- + KMnO4- + 16 H+ — KMn2+ + 8H2O + 10СО2↑
Опыты повторяем 4 раза и из трёх близких результатов берем средний и по формуле рассчитываем нормальность KMnO4
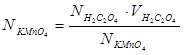
3. Определение граммового содержания Fe2+
К контрольному раствору железа в конической колбе приливаем 10-15 мл 10% раствора H2SO4 и титруем рабочим раствором KMnO4 до бледно-розовой окраски. После добавления 1-2 капель KMnO4 раствор тщательно перемешиваем до обесцвечивания и далее титруем обычным способом.
Граммовое содержание железа рассчитываем по формуле:

Лабораторная работа № 12
ЙОДОМЕТРИЯ
Определение граммового содержания меди ( Cu 2+ )
Метод основан на окислительно-восстановительных процессах, связанных с окислением ионов J- до J2
2J- - 2e → J2
Порядок выполнения работы.
1. Приготовление 250 мл 0,1N раствора K2Cr2O7
2. Определение концентрации рабочего раствора Na2S2O3
3. Определение граммового содержания меди.
Теоретические расчеты
1. Приготовление 250 мл 0,1N раствора K2Cr2O7.
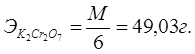
Значит 1000 мл — 49,03 г — 1N
1000 мл — 4,903 г — 0,1N
250 мл — Х г — 0,1N

Значит, чтобы приготовить 250 мл 0,1N раствора необходимо на аналитических весах взвесить 1,2257 г K2Cr2O7 перенести в медную колбу, растворить в небольшом количестве воды, долить до метки водой и тщательно перемешать.
2. Определение концентрации Na2S2O3:
В коническую колбу приливают мерным цилиндром 5-7 мл 20%-ного раствора KJ и 1—15 мл 10%-ного раствора H2SO4. При помощи пипетки или бюретки добавляют 1- мл 0,1N раствора K2Cr2O7, накрывают колбу часовым стеклом и оставляют в темноте 5 мин для завершения реакции:
Cr2O72- + 6J- + 14H+ — 3J2 + 2Cr3+ + 7H2O
Образовавшийся J2 раствор бурого цвета титруют тиосульфатом (Na2S2O3) до соломенно-жёлтого цвета. Затем приливают 5 мл раствора крахмала и образовавшийся раствор синего цвета оттитровывают тиосульфатом до бледно-зелёного цвета:
J2 + 2S2O32- — 2J - + S4O62-
Опыт повторяют 4 раза и из трех близких рассчитывают средний результат и нормальность тиосульфата вычисляют по формуле:
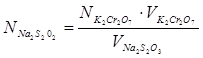
3. Определение граммового содержания Cu2+:
В коническую колбу с исследуемым раствором меди приливают из мерного цилиндра 15 мл 20%-ного раствора KJ и 2 мл 10% K2SO4 колбу накрывают часовым стеклом и оставляют в темноте на 5 минут для завершения реакции:
Cu2+ + 4J- — 2CuJ↓ + J2
Образовавшую бурую муть титруют тиосульфатом до бледно-жёлтого цвета, приливают 5 мл раствора крахмала и титруют до исчезновения синей окраски. Опыты повторяют 4 раза, из близких 3 значений вычисляют средний результат и рассчитывают граммовое содержание Cu2+по формуле:

г-экв Cu2+ = Г-атому = 63,54 г.
Лабораторная работа №13
Методы комплексообразования
На практике аналитической химии чаще используют комплексон-III. Это двунатриевая соль этилен диаминотетроуксусной кислоты, который образует со многими металлоионами внутрикомплексные соединения.
Регулируя pH среды и подбирая соответствующие индикаторы методом комплексонометрии можно определять очень многие металлы, общую жёсткость воды и т.д.
Индикаторы, применяемые в комплексонометрии называют металлохромными индикаторами. Они тоже образуют с ионами металлов комплексы, окрашенные в разные цвета.
Определение общей жёсткости воды.
Порядок выполнения работы.
1. Приготовление 250 мл ~ 0,1 N раствора комплексона - III
2. Определение точной концентрации комплексона - III
3. Определение общей жёсткости водопроводной воды.
1. Приготовление 250 мл 0,1N раствора комплексона-III теоретический расчет.
МК-III = 372 г.
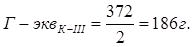
Значит: 1000 мл — 186 г. — 1N
1000 мл — 18,6 г. — 0,N
250 мл — Х2 — 0,1N
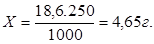
Значит, чтобы приготовить 250 мл 0,1N раствора на аналитических весах отбираем 4,65 г комплексона III, переносим в колбу на 250 мл, растворяем в небольшом объеме воды, приливаем затем до метки воду и тщательно перемешиваем.
2. Определение точной концентрации комплексона III
В коническую колбу при помощи пипетки или бюретки отбираем 10 мл 0,1N раствора нитрата или хлорида цинка, добавляем 10-15 мл аммонийной буферной смеси, на кончике штапеля индикатор хромоген чёрный и образовавшийся раствор красного цвета титруем комплексном-III до синей окраски. Из четырёх определений берем средний результат трёх близких результатов и рассчитываем нормальность комплексона III по формуле:

3. Определение общей жёсткости воды.
В коническую колбу приливаем отмеренный мерным цилиндром 100 мл водопроводной воды, добавляем 10-15 мл аммонийной буферной смеси, на кончике штапеля индикатор хромоген чёрный и титруем красноватый раствор комплексоном III до синего цвета.
Определение повторяем четыре раза и результаты записываем в таблицу. Из трех близких результатов рассчитываем средний и рассчитываем общую жёсткость воды по формуле:
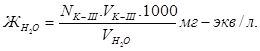
ЛИТЕРАТУРА
1. Миркамилова М.С. «Аналитик кимё», Тошкент, 2003 й.
2. Миркомилова М.С. «Аналитик кимё», Тошкент, 2000 й.
3. Васильев В.П. «Аналитическая химия» 1-2 том. М., Химия, 1089 г.
4. Алексеев В.Н. Курс качественного химического полмикроанализа. М., Химия, 1972 г.
5. Алексеев В.Н. «Количественный анализ». М., Химия, 1972 г.
6. Крешков А.Н. «Основы аналитической химии» 1-2 том. М., Химия, 1965 г.
Качественный анализ
Лабораторная работа №1
Общая характеристика катионов I группы
В I группу входят катионы NН4+, К+, Na+, Mg2+ и др.
Многие их соли хорошо растворимы в воде, особенно их сульфаты, хлориды, карбонаты, что немаловажно маловажно для анализа. В отличие от других групп катионы I группы не имеют группового реагента.
Цель работы : Изучении характерных качественных реакций I- группы катионов.
Реакции катионов NH4+
1. Открытие реактивом Несслера – K2[Hg J4] · 4 KOH.
Для выполнения реакции отбираем в пробирку 1-2 капли раствора соли аммония, приливаем 2-4 капли реактива Несслера. Красно-бурый осадок говорит о присутствии катиона NH4+.

 Нg
Нg

 NH4Cl+2K2 [Hg J4] 4KОН→[O NH2] J↓+7KJ+KCl+2H2O
NH4Cl+2K2 [Hg J4] 4KОН→[O NH2] J↓+7KJ+KCl+2H2O
Na
2.  Реакции со щелочами:
Реакции со щелочами:

 NH4Cl+NaOH → NH4OH+NaCl
NH4Cl+NaOH → NH4OH+NaCl
NH3↑ H2O
К 2-3 каплям раствора соли аммония приливаем 3-4 капли щелочи и нагреваем в водяной бане. По запаху аммиака или по посинению лакмусовой бумажке, смоченной водой и приложенной к горлышке пробирки определяем наличие катионов аммония.
Реакции катионов К+
1. Открытие действием кобальтинитритом натрия
2KCl+Na3[СО(NO2) 6]→K2Na[СО(NO2) 6] ↓+2NaCl
В этой реакции в пробирку приливаем 1-2 капли раствора соли калия и добавляем 3-4 капли Na3[СО(NO2) 6]. Образование жёлтого осадка говорит о присутствии катионов K+.
2. Действие винной кислотой или кислым виннокислым натрием.
Н2C4Н4O6+CН3CОONa→NaHС4H4O4+ CH3СООН
KCl+NaHС4H4O6→KHC4H4O6↓+NaCl
В пробирку приливаем 2-3 капли раствора соли калия, добавляем 3-4 капли винной кислоты и 3-4 капли CH3СООNa. Пробирку со смесью охлаждаем под струёй водопроводной воды и потираем стенки пробирки с раствором стеклянной палочкой. Образуется белый кристаллический осадок. Осадок сразу не выпадает потому что образуются пересыщенные растворы и частицы стекла, образованные потиранием стеклянной палочкой, являются центром кристаллизации и способствуют выпадению осадка.
Реакции катионов Mg 2+
1. Открытие гидрофосфатом натрия.
NH4Cl
 MgCl2+Na2HPO4+NH4OH MgNH4PO4↓ +2NaCl+H2O
MgCl2+Na2HPO4+NH4OH MgNH4PO4↓ +2NaCl+H2O
рН=9.2
В этой реакции в пробирку проливаем 2-3 капли раствора соли магния, добавляем 1-2 капли аммонийной буферной смеси и 3-4 капли Na2HPO4. Образуется белый кристаллический осадок.
2. Действие щелочей.
MgCl2+2NaOH→Mg(OH)2+2NaCl
MgCl2+2KOH→Mg(OH)2+2KCl
В пробирку приливаем 2-3 капли раствора соли магния, 2-3 капли воды и 3-4 капли щёлочи. Образуется белый аморфный осадок.
Лабораторная работа №2
Дата: 2019-12-10, просмотров: 320.