Линейчатый спектр излучения – узкие цветные полоски. Для получения такого спектра необходимо нагреть вещество до высокой температуры, достаточной для перевода его в газообразное состояние и возбуждения атомов. И посмотреть на свет, испускаемый данным веществом. Температуру обычно получают при помощи дугового или искрового разряда. Этот спектр у каждого элемента свой, не совпадающий со спектром ни одного другого химического элемента.
Линейчатый спектр поглощения – узкие темные полоски. Если пучок белого света проходит через вещество в газообразном состоянии, то при разложении пучка света в спектр на сплошном спектре можно увидеть темные линии поглощения, они расположены в тех местах, в которых находятся линии спектра излучения данного химического элемента.
Сплошной спектр – присутствуют все цвета.
Изучение спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр атома водорода.
Швейцарский ученый Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
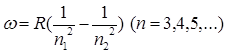
R – Постоянная Ридберга, R = 3/29 · 1015 с-1.
Спектральные линии отличались различными значениями n, образуют группу или серию линий (серия Бальмера).
С увеличением n линии серии сближаются; значение n=∞ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр
В спектре атома водорода было обнаружено еще несколько серий.
В ультрафиолетовой области спектра находится серия Лаймана:
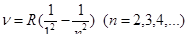
В инфракрасной области серия Пашена
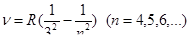
Серия Брэкета
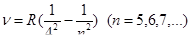
Пфунда
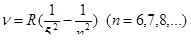
Хэмфри
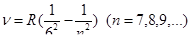
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой формулой Бальмера:
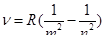
Где m имеет в каждой данной серии постоянное значение, m =1, 2, 3, 4, 5, 6 (определяет серию), n принимает целочисленные значения, начиная с m +1 (определяет отдельные линии этой серии). Спектр атома водорода правильно описывается на основе постулатов Бора.
Первый постулат Бора: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, в действительности осуществляются лишь некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из таких орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн.
Второй постулат Бора: излучение испускается или поглощается в виде светового кванта hω. При переходе электрона с одной дискретной орбиты на другую (из одного стационарного состояния в другое) величина кванта равна разности энрергий тех стационарных состояний, между которыми осуществляется квантовый скачок электрона:
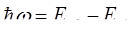
Набор возможных дискретных частот, квантовых переходов и определяет линейчатый спектр водорода.
Спектральный анализ
Исследование линейчатого спектра вещества позволяет определить, из каких веществ он состоит и в каком количестве содержится каждый элемент. Количественное содержание элемента в исследуемом образце определяется путем сравнения интенсивности отдельных линий спектра этого элемента с интенсивностью линий другого химического элемента, количественное содержание которого известно. Спектральный анализ широко применяется при поисках полезных ископаемых для определения химического состава образцов руды. В промышленности спектральный анализ позволяет контролировать состав сплавов и примесей, вводимых в металл.
Достоинства: высокая чувствительность и быстрота получения результатов. Спектральный анализ позволяет определить химический состав небесных тел, удаленных от Земли на расстоянии в миллиарды световых лет, для этого используют спектры поглощения (по этим спектрам определяют температуру звезд, состав, и по смещению – скорость движения).
25. Опыты Резерфорда, планетарная модель строения атома Резерфорда – Бора. Составные элементы атомного ядра. Ядерные силы
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871 — 1937) по рассеянию альфа-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки альфа-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну ж ту же скорость (порядка 107 м/с)).
Резерфорд, исследуя прохождение альфа-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые альфа-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как альфа-частицы, то Резерфордом был сделан вывод, что значительное отклонение альфа-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие альфа-частипы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточив в объеме, очень малом по сравнению с объемом атома.
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Zе ( Z— порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10-15 — 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
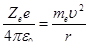 (1)
(1)
где m и υ — масса и скорость электрона на орбите радиуса r, ε0 — электрическая постоянная.
Уравнение (1) содержит два неизвестных: r и υ. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины г, υ (следовательно, и Е) могут меняться непрерывно, т. е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр. Из выражения (1) следует, что при r≈10-10 м скорость движения электронов υ≈106 м/с, а ускорение υ22/r = 1022 м1001ммм/с2. Согласно электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным.
Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.
Дата: 2019-12-22, просмотров: 335.