Вопросы для тестового контроля
1. Что такое нуклеотид?
2. Что такое нуклеозид?
3. Что такое нуклеиновая кислота?
4. Какие существуют виды нуклеиновых кислот?
5. Какие азотистые основания присутствуют в ДНК?
6. Какие азотистые основания присутствуют в РНК?
7. Какой связью соединяются нуклеотиды в нуклеиновой кислоте?
8. Сколько водородных связей возникает между комплементарными парами?
9. Какие существуют отличия ДНК от РНК?
10. Какие существуют виды РНК?
11. Какова функция тРНК?
12. Какие азотистые основания присутствуют в тРНК?
13. Какой конечный продукт образуется при распаде пуриновых азотистых оснований?
14. Какие образуются конечные продукты при распаде пиримидиновых оснований?
15. Назовите вещества, участвующие в синтезе пуринов.
16. Какой образуется общий промежуточный метаболит для АМФ и ГМФ?
17. Какие вещества участвуют в синтезе пиримидинов?
18. Назовите общий промежуточный метаболит в синтезе всех пиримидиновых нуклеотидов.
19. Назовите виды матричного синтеза.
20. Что такое репликация?
21. Назовите виды репликации.
22. Что такое транскрипция?
23. Что такое процессинг пре-мРНК?
24. Назовите свойства генетического кода.
25. Что такое триплет или кодон?
26. Что такое трансляция?
27. Назовите фазы трансляции.
28. Какой кодон является инициирующим?
29. Назовите терминирующие кодоны.
30. Какие формируются центры в рибосоме после присоединения большой и малой субчастицы?
31. Назовите белковые факторы, участвующие в синтезе белка.
32. Назовите основные стадии в трансляции.
33. Назовите основные фазы в элонгации.
34. Каким посттрансляционным изменениям подвергается синтезированный полипептид?
35. Что такое обратная транскрипция?
36. Что такое репарация?
37. Какие гормоны усиливают протеолиз?
38. Какие гормоны оказывают анаболическое действие?
5. ВОДНО-МИНЕРАЛЬНЫЙ ОБМЕН
РАБОТА 16. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ КАЛЬЦИЯ
В СЫВОРОТКЕ КРОВИ ПО МЕТОДУ ВААРДА
Цель работы: ознакомиться с титриметрическим методом определения кальция в сыворотке крови.
Задачи:
· определить содержание кальция в сыворотке крови;
· проанализировать полученные результаты и сделать выводы.
Изменение содержания кальция в сыворотке крови служит диагностическим тестом при эндокринных и неврологических заболеваниях и болезнях, вызванных недостатком некоторых витаминов (например, витамина D). В норме содержание кальция в сыворотке крови человека составляет 9-11 мг%.
Принцип метода. Кальций, находящийся в сыворотке в виде водорастворимых солей, переводится в осадок в результате реакции:
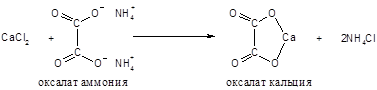
Осадок растворяется в серной кислоте:
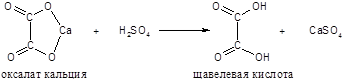
Освободившуюся щавелевую кислоту титруют раствором марганцевокислого калия:
5H2C2O4 + 2 KMnO4 + 3H2SO4 ® 2MnSO4 + K2SO4 + 8H2O + 10CO2.
Из приведенных уравнений следует, что по количеству марганцевокислого калия, пошедшего на окисление щавелевой кислоты, можно рассчитать исходное количество кальция.
Ход работы. В одну центрифужную пробирку вносят 1 мл сыворотки крови (опытная проба), а в другую – 1 мл дистиллированной воды (контрольная проба). В обе пробирки добавляют по 1 мл 4%-го раствора щавелевокислого аммония, пробы перемешивают, оставляют на 30 минут при комнатной температуре и центрифугируют со скоростью 3000 об./мин в течение 10 минут. Надосадочную жидкость сливают, в пробирки добавляют по 4 мл 2%-го раствора NH4OH и содержимое перемешивают стеклянной палочкой. Пробы центрифугируют в течение 10 минут. Надосадочную жидкость сливают, в пробирки добавляют по 2 мл 1 н раствора H2SO4 и содержимое перемешивают стеклянной палочкой. Не вынимая палочки, пробирки погружают в кипящую водяную баню до растворения осадка. Раствор титруют горячим, помешивая палочкой, 0,01 н раствором KMnO4 до появления бледно-розового окрашивания, не исчезающего в течение 1 минуты.
Содержимое кальция в сыворотке крови рассчитывают по уравнению:
Х = 0,2 . (а - б) . 100,
где Х – содержимое кальция в сыворотке крови в мг%;
а – количество 0,01 н раствора KMnO4, пошедшее на титрование опытной пробы;
б – количество 0,01 н раствора KMnO4, пошедшее на титрование контрольной пробы;
0,2 – количество кальция (в мг), эквивалентное 1 мл 0,01 н раствора KMnO4, согласно уравнениям реакций.
Общие выводы по работе:
РАБОТА 17. ОПРЕДЕЛЕНИЕ НЕОРГАНИЧЕСКОГО ФОСФОРА
В КРОВИ
Цель работы: ознакомиться с колориметрическим методом определения неорганического фосфора в крови.
Задачи:
· построить калибровочную кривую по стандартным растворам фосфора;
· определить содержание фосфора в крови;
· проанализировать полученные результаты и сделать вывод.
Неорганический фосфор биологических жидкостей входит в состав солей фосфорной кислоты. Основное назначение солей фосфорной кислоты в биологических жидкостях и в первую очередь в крови – создание в них буферной системы. Довольно часто в диагностических целях в клинических лабораториях в крови пациентов определяют содержание неорганического фосфора. В норме в крови содержание неорганического фосфора составляет 2,5-5 мг%.
Принцип метода. Неорганический фосфат взаимодействует с молибдатом аммония в присутствии восстановителей (например, гидрохинона и сернистокислого натрия) с образованием окрашенного комплексного соединения (молибденовой сини). Интенсивность окраски раствора пропорциональна концентрации неорганического фосфата.
Ход работы
1. Построение калибровочной кривой
а) В пять пробирок вносят по 1 мл стандартного раствора фосфора, содержащего соответственно 5, 10, 15, 20 и 25 мкг/мл. В контрольную пробирку вносят по 1 мл дистиллированной воды.
б) Во все пробы добавляют по 4 мл дистиллированной воды, 0,5 мл 20%-го раствора трихлоруксусной кислоты, 0,5 мл молибденового реактива и 0,5 мл 1%-го раствора гидрохинона. Содержимое пробирок тщательно перемешивают и оставляют на 5 минут, после чего во все пробы добавляют по 2 мл карбонатсульфитного раствора и по 1,5 мл дистиллированной воды; перемешивают и оставляют при комнатной температуре на 10 минут. Пробы колориметрируют с зеленым светофильтром в кюветах с толщиной слоя 10 мм против контрольной пробы.
Внимание! Колориметрированию могут помешать образующиеся в процессе реакции пузырьки углекислого газа, поэтому перед измерением их необходимо осторожно снять со стенок кювет с помощью пастеровской пипетки и быстро измерить оптическую плотность растворов.
2. Определение фосфора в крови
В центрифужную пробирку вносят 3 мл дистиллированной воды, 1 мл крови и 1 мл 20%-го раствора трихлоруксусной кислоты, смесь перемешивают и оставляют на 10 минут (для осаждения белков). Затем пробы центрифугируют 5 минут при 1500 об./мин и 1 мл надосадочной жидкости отбирают в другую пробирку. Для приготовления контрольной пробы в другую пробирку вносят 1 мл дистиллированной воды. Далее в обе пробирки приливают реактивы в той же последовательности, как описано в пункте б) при построении калибровочной кривой.
Расчет: концентрацию фосфора в пробе определяют по калибровочной кривой и рассчитывают его содержание в крови в мг% по формуле:
Х = (А ´ 5 ´100) / 1000 = А / 2 (мг%),
где А – количество фосфора в пробе, определенное по калибровочной кривой;
А ´5 – количество фосфора в 1 мл крови;
100 – для пересчета количества фосфора в 100 мл крови;
1000 – для перевода мкг в мг.
Результаты:
| № | Содержание | Е | ||||
| проб | фосфора, мкг/мл | Е1 | Е2 | Е3 | Есред. | |
| 1 | 5 |
| ||||
| 2 | 10 |
| ||||
| 3 | 15 |
| ||||
| 4 | 20 |
| ||||
| 5 | 25 |
| ||||
Калибровочная кривая
Расчет по формуле:
Общие выводы по работе:
РАЗДЕЛ 6. ГОРМОНЫ
РАБОТА 18. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ГОРМОНЫ
Цель работы: ознакомиться с некоторыми химическими свойствами готовых препаратов гормонов.
Задачи:
· проделать перечисленные ниже химические реакции;
· проанализировать полученные результаты и сделать вывод.
1. Качественные реакции на инсулин
а) Реакция Геллера. К 10 каплям концентрированной азотной кислоты осторожно по стенке пробирки приливают равный объем (10 капель) раствора инсулина. Пробирку наклоняют под углом 45о так, чтобы жидкости не смешивались. На границе двух жидкостей образуется белый аморфный осадок в виде небольшого кольца.
б) Биуретовая реакция. К 10 каплям инсулина добавляют 5 капель 10%-го раствора едкого натра и 1 каплю 1%-го раствора сернокислой меди. Жидкость окрашивается в фиолетовый цвет.
в) Реакция Фоля. К 5 каплям раствора инсулина приливают 5 капель реактива Фоля и кипятят. Через 1-2 минуты появляется бурый или черный осадок сульфида свинца.
2. Качественные реакции на адреналин
По химической природе адреналин является производным пирокатехина. Он легко окисляется, превращаясь в неактивный хинон – адренохром (красного цвета):

Адренохром далее полимеризуется с образованием высокомоле-кулярного коричневого пигмента.
а) Реакция с хлорным железом. При взаимодействии адреналина с хлорным железом образуется зеленое комплексное соединение типа фенолята.
В пробирку вносят три капли раствора адреналина (1:1000) и 1 каплю 1%-го раствора хлорного железа. Жидкость приобретает зеленое окрашивание. При добавлении 1 капли концентрированного аммиака окраска переходит в красную вследствие образования адренохрома, а затем в коричневую
б) Диазореакция. В результате взаимодействия адреналина с диазосоединениями образуются азокрасители.
В пробирку вносят по 3 капли 1%-го раствора сульфаниловой кислоты, 5%-го раствора азотистокислого натрия, 5 капель раствора адреналина (1:1000) и 3 капли 10%-го раствора углекислого натрия. Жидкость окрашивается в красный цвет.
3. Реакция на фолликулин
Фолликулин (эстрон), половой гормон стероидной структуры, является производным углеводорода эстрана:
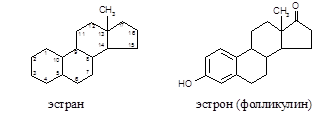
а) Реакция с концентрированной серной кислотой. При взаимодей-ствии фолликулина с концентрированной серной кислотой образуется эфирное соединение соломенно-желтого цвета (фолликулинсульфат):
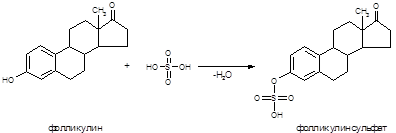
В пробирку вносят 3-5 капель масляного раствора фолликулина и 2 капли концентрированной серной кислоты. Жидкость окрашивается в соломенно-желтый цвет.
4. Определение 17-кетостероидов в моче
17-кетостероиды являются конечным продуктом обмена гормонов коры надпочечников половых гормонов (тестостерона и эстрадиола). При 17-м углеродном атоме циклопентанпергидрофенантренового ядра они имеют кетогруппу.
Принцип метода. Нормальное содержание 17-кетостероидов в суточной моче составляет 10-16 мг у мужчин и 6-13 мг у женщин. Качественная реакция на 17-кетостероиды проводится с м-динитро-бензолом, при этом образуется продукт конденсации вишнево-красного цвета.
Ход работы. В пробирку вносят 5 капель мочи, 5 капель 30%-го раствора едкого натра, 5 капель 2%-го раствора м-динитробензола в этиловом спирте и перемешивают. Через 2-3 мин появляется вишнево-красное окрашивание, характерное для 17-кетостероидов.
5. Реакция на тироксин
При щелочном гидролизе тироксина с KOH образуется иодистый калий. Его можно окислить в молекулярный иод иодатом калия в кислой среде. Иод дает синее окрашивание с крахмалом:
5KI + KIO3 + 6HCl ¾® 3I2 + 6KCl + 3H2O,
I2 + крахмал ¾® синее окрашивание.
Ход работы. Таблетированный тиреоидин (5 таблеток) растирают в ступке. Порошок переносят в колбу, добавляют 5 мл 10%-го раствора KHCO3 и 5 мл дистиллированной воды. Смесь кипятят в течение 10-15 минут.
24 капли охлажденного гидролизата переносят в пробирку и добавляют по каплям 10%-й раствор серной кислоты до кислой реакции (на лакмус). После подкисления добавляют 3 капли 1%-го раствора крахмала и 5-10 капель 2%-го раствора иодата калия (не следует добавлять избыток). Выделившийся иод дает синее окрашивание с крахмалом.
Общие выводы по работе:
ПЕРЕЧЕНЬ НАЗВАНИЙ РЕФЕРАТОВ ПО ТЕМЕ «ГОРМОНЫ»
1. Химическая природа и классификация гормонов.
2. Механизм действия гормонов.
3. Биотехнология получения гормонов. Применение генной инженерии в производстве гормонов.
4. Гормоны гипофиза и их влияние на обмен веществ.
5. Гормоны поджелудочной железы, структура и биологическая роль.
6. Гормоны щитовидной железы, их биологическая роль.
7. Инсулин, его влияние на обмен веществ.
8. Гормоны мозгового слоя надпочечников, структура, роль в обмене веществ.
9. Адреналин, структура и биологическая роль. Механизм действия адреналина.
10. Метаболизм адреналина.
11. Химическая природа и механизм действия гормонов, регулирующих минеральный обмен.
12. Гормоны паращитовидной железы, их роль в обмене веществ.
13. Биологическая роль и структура гормонов коркового слоя надпочечников.
14. Половые гормоны: структура и биологическая роль.
15. Простагландины и их применение в сельском хозяйстве.
16. Стресс, влияние на организм.
17. Промышленные стрессы и их влияние на продуктивность сельскохозяйственных животных.
18. Применение гормонов в сельском хозяйстве.
19. Роль нейропептидов.
20. Роль гипоталамуса в регуляции обменных процессов в организме.
21. Гормоноиды (гормоны местного действия), структура, свойства и биологическая роль.
22. Наследственные аномалии обмена гормонов.
23. Гормоны беспозвоночных.
24. Развитие эндокринной системы в филогенезе.
25. Развитие эндокринной системы в онтогенезе.
РАЗДЕЛ 7. БИОХИМИЯ МОЛОКА
РАБОТА 19. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА НЕКОТОРЫЕ СОСТАВНЫЕ ЧАСТИ МОЛОКА
Цель работы: изучение физико-химического состава молока.
Задачи:
· с помощью качественных реакций доказать, что в состав молока входят белки (казеин, альбумин и глобулин), углеводы (лактоза) и другие компоненты;
· определить, какие соединения появляются в кислом молоке;
· проанализировать полученные результаты и сделать выводы.
Молоко представляет собой секрет молочных желез. В его состав входит около 200 различных веществ, которые можно разделить на пять основных групп – вода, белки, липиды, углеводы и минеральные соли. Химический состав молока зависит от вида животного, породы, возраста самки, периода лактации, условий кормления и других факторов.
Вода. На долю воды может приходиться от 67,7% (олень) до 90,3% (лошадь). В коровьем молоке в среднем содержится около 88,0% воды. Она может находиться в свободном и связанном состояниях. Свободная вода легко удаляется при сгущении, высушивании и других обработках, связанная – входит в состав сольватных оболочек коллоидов.
Белки. Содержание белков в молоке различных животных варьирует от 0,9% (олень) до 5,1% (овца), в коровьем молоке оно составляет 2,9-4,0%. В обезжиренном молоке 45-55% белков составляет a-казеин. Его молекулярная масса 19-100 тыс. В молоке он образует казеинат-кальций-фосфатный комплекс, участвующий в формировании оболочки жировых шариков.
a-Лактальбумин имеет молекулярную массу 14437, устойчив к нагреванию, участвует в биосинтезе лактозы из галактозы и глюкозы. b-Лактоальбумин имеет молекулярную массу 36 тыс., денатурирует при рН=7 и нагревании до 70 оС; его кристаллы не растворяются в воде и растворяются в разбавленных растворах солей.
Глобулины молока имеют высокую молекулярную массу (от 150 тыс. до 1 млн.), обладают свойствами липооксидаз, их молекула содержит углеводный компонент.
Протеозо-пептонную фракцию представляют простые белки, связанные с углеводными компонентами: гексозами, сиаловыми кислотами и гексозаминами. Фракция содержится в сыворотке молока (образуется после осаждения казеина) и мицеллах.
Кроме этого, в молоке имеются и другие белки – ферменты всех шести классов, красный протеин, лактолин и др.
Небелковые азотистые вещества. Их содержание достигает 0,021-0,036%, состоят из мочевины (более половины), аминокислот, пуриновых оснований, креатина и других веществ.
Углеводы. На долю углеводов у разных животных приходится от 2,8 (олень) до 6,5% (лошадь), в коровьем молоке они составляют около 4,9%. Углеводы находятся в свободном состоянии и связанных с белками формах. Свободные углеводы представлены лактозой (в среднем 4,7%), галактозой, глюкозой, фосфорными эфирами моноз, аминосахарами. Связанные углеводы составляют 0,3% молока. Это моносахариды, гексозамины, сиаловые кислоты, лактоза. Больше всего лактозы содержится в молоке носорога (до 36% от общей массы).
Липиды. В молоке они представляют собой смесь нейтрального жира, стероидов, фосфатидов, гликолипидов и их производных. Содержание их в молоке животных различных видов неодинаково – наибольшее количество (17,1%) отмечено у оленя, минимальное – у лошади (всего 1,0%), в коровьем молоке – в среднем 4,9%.
Основу липидов молока составляют триглицериды (98-99% от общей массы), в составе которых чаще всего обнаруживаются остатки пальмитиновой, олеиновой, стеариновой и миристиновой кислот (всего 60-64 жирные кислоты с углеродной цепью от С4 до С26). Общее содержание ненасыщенных жирных кислот в липидной фракции молока достигает летом 34,45-42% и зимой – 25,40-33,78%. Холестерина в молоке содержится 0,012-0,013%. Стероиды концентрируются в оболочках жировых шариков.
Витамины. Коровье молоко содержит витамины: В1 – 0,04, В2 – 0,15, РР – 0,1, С – 1,5, А – 0,25, D – 0,05. 10-3, Е – 0,09 мг/100 г. Для обогащения молока животным дают корма, богатые витаминами, вводят концентраты витаминов А и D или же Е. Молоко может быть обогащено витаминами также биологическим путем – при введении микробов, синтезирующих определенные витамины. Так, внесение в молоко штаммов молочнокислых бактерий дает возможность повысить в простокваше и кефире содержание витамина C в 2-4, РР – в 5-10, В12 – в 20-50, В2 – в 1,5-2 раза.
Пигменты. Молоко содержит каротины, лактофлавин, небольшое количество хлорофиллов. От них зависит окраска молока.
Минеральные вещества. Их содержание в молоке составляет 0,7-1%, они находятся в свободном и связанном состояниях. Молоко коровы содержит хлориды, фосфаты, цитраты, гидрокарбонат натрия, сульфат натрия. Молоко богато кальцием (11,2-12,8 мг), 78% которого находится в фосфатах и цитратах, 22% – связано с казеином. Кроме этого, молоко содержит многие микроэлементы (Fe, Cu, Zn, Mn). Минеральные вещества находятся в виде солей, кислот, ионов, биокомплексов, входят в состав металлоэнзимов и др.
1. Определение удельного веса молока
Удельный вес молока колеблется от 1,028 до 1,034 (при 15 оС). Снятое молоко имеет более высокий удельный вес.
Ход работы.
Молоко хорошо перемешивают, наливают в сухой цилиндр (на 100 мл) и осторожно опускают в него ареометр. Легким толчком по верхушке ареометра заставляют его совершить несколько небольших движений вниз и вверх (движение поплавка). Когда он остановится (необходимо следить, чтобы ареометр не касался стенок цилиндра), записывают результат. Одновременно определяют температуру молока, так как от этого показателя зависит удельный вес молока.
2. Определение рН молока
Реакция среды кислая или близка к нейтральной: рН= 6,5-7,0
Ход работы.
Самый простой способ определения – с помощью индикаторной бумажки. На индикаторную (лучше универсальную) бумажку наносят несколько капель молока и определяют рН.
3. Определение белков молока
Осаждение казеина
Молоко разбавляют в 5 раз (в стакан или колбочку на 100 мл приливают 10 мл молока и 40 мл дистиллированной воды), после чего прибавляют по каплям (постоянно помешивая палочкой) 0,1%-й раствор уксусной кислоты до прекращения образования хлопьевидного осадка казеина, осаждающего и жир.
Примечание. Прибавлять кислоту следует осторожно, так как при ее избытке казеин растворяется.
Осадок отфильтровывают. Полученный при этом фильтрат (№ 1) используют для определения в нем всех остальных белков, содержащихся в молоке, а осадок промывают несколько раз дистиллированной водой и с помощью биуретовой реакции доказывают наличие белка казеина в нем.
Выделение альбумина
К 25 мл фильтрата № 1 прибавляют 2 мл 10%-го раствора аммиака, насыщают порошком сернокислого магния, помутнение раствора при этом указывает на присутствие глобулина. Образовавшийся осадок отфильтровывают, полученный фильтрат № 2 используют для выделения альбумина, а осадок промывают дистиллированной водой и с помощью цветных реакций доказывают присутствие в нем белка глобулина.
Выделение глобулинов
Фильтрат № 2 слегка подкисляют 10%-м раствором уксусной кислоты и нагревают до кипения. Выпавший осадок лактоальбумина отфильтровывают; полученный при этом фильтрат № 3 используют для определения лактозы, а осадок, оставшийся на фильтре, промывают дистиллированной водой и с помощью цветных реакций доказывают присутствие белка лактоальбумина в нем.
4. Определение лактозы в молоке (реакция Фелинга)
К 2-3 мл фильтрата № 3 прибавляют 1-2 мл 10%-го раствора едкого натра, 0,5-1 мл 5%-го раствора сернокислой меди и доводят до кипения. Изменение цвета раствора и выпадение осадка красного цвета свидетельствуют о присутствии лактозы в растворе, которая обладает восстанавливающими свойствами и способна восстановить окись меди до закиси.
5. Определение кальция и фосфора в молоке
а) В пробирку приливают 2-3 мл фильтрата № 3, добавляют немного раствора молибденовокислого аммония и нагревают. Помутнение раствора свидетельствует о выпадении фосфорно-молибденово-кислого аммония. При охлаждении выпадает желтый кристаллический осадок (NH4)3PO4.12MoO3.
б) В пробирку вносят 2-3 мл фильтрата № 3, добавляют раствор щавелевокислого аммония – выпадает осадок щавелевокислого кальция.
6. Специфические реакции на кислое молоко
а) Реакция Уфельмана (на молочную кислоту)
Фильтрат кислого молока смешивают с реактивом Уфельмана (к 2-3 мл 2%-го раствора фенола прибавляют 4-5 капель раствора FeCl3), появляющееся желтое с зеленоватым оттенком окрашивание свидетельствует о наличии молочнокислого железа.
б) Алкогольная проба
В пробирку наливают 3-5 мл молока и такое же количество 68-70%-го спирта. Наклонив пробирку, наблюдают за происходящими изменениями. Свежее молоко слегка разжижается, так как в слабокислом молоке (около 22о Тернера) появляются отдельные зернышки а в сильнокислом (более 27о Тернера) – образуется много хлопьев.
Примечание. Градусом Тернера называют количество миллилитров 0,1 н раствора щелочи, необходимое для нейтрализации 100 мл молока.
в) Проба с кипячением
В пробирку наливают 3 мл молока и кипятят. Кислое молоко сворачивается. В качестве контроля проделывают такую же реакцию со свежим молоком и сравнивают результаты.
Общие выводы по работе:
ПРИЛОЖЕНИЯ
Сроки и условия хранения исследуемой пробы при определении некоторых показателей крови
При исследовании крови следует знать и учитывать целый ряд факторов, в противном случае возможна необъективная интерпретация полученных результатов.
Прежде всего, надо иметь в виду, что при наличии гемолиза некоторые биохимические показатели остаются без изменений, в то же время другие могут значительно отличаться от тех же показателей в негемолизированной сыворотке. В частности, гемолиз мешает определению концентрации общего белка, билирубина, холестерина, железа, мочевины, меди, неорганического фосфора, однако не оказывает существенного влияния на такие показатели, как активность холинэстеразы, концентрация глюкозы.
На некоторые показатели оказывает влияние присутствие антикоагулянтов. Так, стабилизация крови гепарином, цитратом или оксалатом мешает определению меди. В то же время присутствие антикоагулянтов не влияет на определение неорганического фосфора.
Наиболее важное значение имеют продолжительность хранения исследуемой пробы (с момента взятия крови и начала анализа) и условия, при которых она хранится. Концентрация неорганического фосфора остается стабильной в течение 7 суток при хранении при +4 оС и 2 суток – при комнатной температуре. С увеличением продолжительности срока хранения сыворотки содержание неорганического фосфора возрастает за счет распада органических веществ, содержащих фосфор (АТФ, глюкозо-6-фосфат и др.). Определение билирубина должно проводиться по возможности быстро, сыворотку нужно хранить в темном месте. Концентрация кальция в сыворотке крови не меняется в течение 10 дней как при +4 оС, так и при 20-25 оС. Концентрация холестерина достаточно стабильна в течение 6 суток при любых условиях хранения сыворотки крови. За такой же период (6 суток) не происходит серьезных изменений в содержании общего белка, однако в этом случае сыворотку необходимо хранить при температуре +4 оС. Концентрация меди и магния остается без изменений на протяжении 14 и 7 суток (соответственно). Концентрация железа в сыворотке крови не меняется в течение 7 суток, если ее хранить при +4 оС, и 4 суток – при хранении в условиях комнатной температуры. Активность холинэстеразы устойчива в сыворотке крови на протяжении 7 суток.
Определение концентрации глюкозы должно проводиться в течение 4 часов с момента взятия крови, так как при более длительном хранении содержание сахара снижается. При удалении белка концентрация глюкозы в надосадочной жидкости достаточно стабильна в течение 2-3 суток. Очень лабильна концентрация промежуточного метаболита глюкозы – пирувата. Для определения этого показателя кровь необходимо брать в охлажденные пробирки, не следует использовать жгут, а анализ проводят сразу же после взятия пробы.
Таблица перевода основных биохимических
показателей в систему СИ
| Показатели | Единицы СИ | Коэффициент перевода в систему СИ |
| Глюкоза Общий белок Билирубин Холестерин Кальций Фосфор Железо Медь Магний Каротин Витамин А Кетоновые тела ПВК | ммоль/л г/л мкмоль/л ммоль/л ммоль/л ммоль/л мкмоль/л мкмоль/л ммоль/л мкмоль/л мкмоль/л г/л мкмоль/л | мг% ´ 0,0555 г% ´ 10 мг% ´ 17,104 мг% ´ 0,0259 мг% ´ 0,2495 мг% ´ 0,3229 мкг% ´ 0,1791 мкг% ´ 0,1574 мг% ´ 0,4113 мкг% ´ 0,0186 мкг% ´ 0,0349 мг% ´ 0,01 мг% ´ 113,6 |
Вопросы к экзаменационным билетам
по биологической химии
1. Роль биохимии в развитии науки, промышленности и сельском хозяйстве.
БЕЛКИ. АМИНОКИСЛОТЫ
2. Классификация аминокислот.
3. Заменимые и незаменимые аминокислоты.
4. Моноаминодикарбоновые кислоты. Роль глютаминовой кислоты в обмене веществ.
5. Гетероциклические аминокислоты. Структура и биологическая роль гистидина.
6. Серосодержащие аминокислоты. Роль метионина и цистеина в обмене веществ.
7. Роль белков в организме животных.
8. Классификация белков.
9. Первичная структура белковой молекулы.
10. Вторичная структура молекулы белка.
11. Коллаген. Особенности его структуры, роль в организме.
12. Третичная структура белка.
13. Четвертичная структура белка. Примеры строения и функционирования олигомерных белков.
ФЕРМЕНТЫ
14. Химическая природа ферментов, их структура. Понятие об изоферментах и мультиэнзимных комплексах. Активный центр ферментов. Общее представление о механизме действия ферментов.
15. Активный центр ферментов.
16. Общие свойства ферментов.
17. Действие ингибиторов на активность ферментов. Типы ингибирования.
18. Специфичность действия ферментов.
19. Классификация и номенклатура ферментов.
20. Применение ферментов в научных исследованиях, в медицинской, ветеринарной и с/х практике.
НУКЛЕИНОВЫЕ КИСЛОТЫ
21. Структура и биологическая роль мононуклеотидов.
22. Структура, биологическая роль и пути биосинтеза АТФ в клетке.
23. Первичная структура нуклеиновых кислот.
24. Структура, свойства и функции основных классов РНК.
25. Особенности структуры и роль тРНК.
26. Структура и биологическая роль мРНК.
27. Рибосомы, их строение и роль в биосинтезе белка.
28. Структура и биологическая роль ДНК. Укладка ДНК в хроматине и в хромосомах.
29. Принцип комплементарности азотистых оснований в нуклеиновых кислотах, его роль.
30. Генетический код, его свойства.
ВИТАМИНЫ
31. Классификация витаминов.
32. Коферментная функция витаминов.
33. Витамин группы А.
34. Витамин группы Д.
35. Витамин Е.
36. Витамин К.
37. Витамин F.
38. Витамин В1. Методы доклинического выявления недостаточности тиамина.
39. Витамин В2.
40. Витамин В3.
41. Витамин M (фолиевая кислота).
42. Витамин РР.
43. Витамин В6.
44. Витамин Н.
45. Витамин С.
46. Антианемические витамины.
47. Причины возникновения гипо- и авитаминозов.
48. Общая характеристика метаболизма витаминов.
биологическое окисление
49. Биологическое окисление. Последовательность расположения переносчиков в дыхательной цепи.
50. Пиридинзависимые дегидрогеназы.
51. Флавинзависимые дегидрогеназы.
52. Ферменты цитохромной системы.
53. Компоненты дыхательной цепи неферментной природы.
54. Окислительное фосфорилирование. Пути биосинтеза АТФ.
ОБМЕН УГЛЕВОДОВ
55. Переваривание и всасывание углеводов. Особенности
переваривания углеводов у жвачных.
56. Понятие о балластных веществах, их биологическая роль.
57. Биосинтез и распад гликогена в печени.
58. Гликолиз.
59. Гликогенолиз.
60. Аэробное окисление глюкозы.
61. Цикл трикарбоновых кислот.
62. Баланс энергии распада глюкозы.
63. Пентозный цикл.
64. Пути биосинтеза глюкозы в организме.
65. Особенности спиртового и молочно-кислого брожения.
66. Глюконеогенез, его значение.
ОБМЕН ЛИПИДОВ
67. Классификация липидов.
68. Переваривание и всасывание липидов. Особенности переваривания у жвачных.
69. Структура и биологическая роль желчных кислот в переваривании и всасывании липидов.
70. b-окисление жирных кислот.
71. Баланс энергии распада жирных кислот (на примере пальмитиновой кислоты).
72. Биосинтез жирных кислот.
73. Синтез фосфатидной кислоты и ее роль в обмене липидов.
74. Биосинтез сфингозинсодержащих липидов.
75. Метаболизм и биологическая роль холестерина.
76. Метаболизм кетоновых тел.
77. Нарушение обмена липидов.
78. Кетозы у крупного рогатого скота.
ОБМЕН БЕЛКОВ
79. Роль белков в питании. Азотистый баланс. Белковый минимум.
80. Переваривание и всасывание белков. Особенности переваривания у жвачных.
81. Трансаминирование.
82. Дезаминирование аминокислот.
83. Декарбоксилирование аминокислот. Роль и распад биогенных аминов.
84. Пути обезвреживания аммиака в организме.
85. Биосинтез мочевины.
86. Общие пути биосинтеза аминокислот.
87. Роль аминотрансфераз в обмене белков. Применение их в медицинской, ветеринарной и с/х практике.
88. Незаменимые пищевые факторы.
89. Взаимосвязь обмена белков, углеводов и липидов.
90. Роль микрофлоры желудочно-кишечного тракта в переваривании веществ у жвачных.
ГОРМОНЫ
91. Гормоны щитовидной железы.
92. Гормоны мозгового слоя надпочечников.
93. Гормоны коры надпочечников.
94. Гормоны поджелудочной железы.
95. Гормоны гипофиза.
96. Половые гормоны.
97. Женские половые гормоны.
Дата: 2019-12-10, просмотров: 416.