БИОЛОГИЧЕСКАЯ, ФИЗИЧЕСКАЯ
И КОЛЛОИДНАЯ ХИМИЯ
Методические указания
к лабораторным работам и контрольные вопросы и задачи для студентов II курса агротехнического факультета специальности «Зоотехния»
Петрозаводск
Издательство ПетрГУ
2007
Рассмотрены и утверждены к печати на заседании редакционной комиссии по отрасли науки и техники «биология» 11 сентября 2007 г.
Печатаются по решению редакционно-издательского совета
Петрозаводского государственного университета
Составители
В. В. Осташкова, канд. биол. наук;
В. П. Андреев, доктор хим. наук;
Я. П. Нижник, канд. хим. наук
ПРЕДИСЛОВИЕ
Настоящие методические указания содержат лабораторные работы по биологической, физической и коллоидной химии, выполняемые студентами II курса агротехнического факультета специальности «Зоотехния» в процессе изучения предмета. На лабораторных занятиях студенты овладевают методами экспериментальных исследований, закрепляют теоретические знания, анализируют полученные на практических занятиях результаты. В каждой лабораторной работе излагаются цель и задачи, поставленные перед студентом, принцип используемого метода, ход работы, предлагается проанализировать результаты проведенных исследований и сделать выводы. Представленные в конце каждого раздела вопросы и задачи способствуют лучшему усвоению теоретического материала при самоподготовке.
БИОЛОГИЧЕСКАЯ ХИМИЯ
Радиальная (круговая) хроматография
Для разделения смеси аминокислот используется растворитель, состоящий из смеси н-бутанола, ледяной уксусной кислоты и воды в соотношении 4:1:5. Приготовленная смесь встряхивается в делительной воронке в течение 5 минут, а затем отстаивается 7-10 часов, после чего нижний слой используется для насыщения хроматографической камеры парами, а верхний – для разделения аминокислот. Хроматографической камерой служит эксикатор.
Ход работы
Хроматографическую бумагу вырезают в форме диска, диаметр которого соответствует внутренним размерам диаметра эксикатора. В центр диска (на точку старта) наносят микропипеткой в несколько приемов 0,005-0,01 мл исследуемой смеси аминокислот. Нанесение смеси следует проводить очень аккуратно, слегка касаясь микропипеткой стартовой точки, чтобы диаметр мокрого пятна был не более 5 мм. После каждого нанесения пятно подсушивают над электроплиткой или в термостате.
В центре хроматограмм делают иглой отверстие, в которое пропускают фитилек из сложенной вчетверо нити. Хроматограмму помещают в эксикатор, на дно которого предварительно наливают верхний слой растворителя. Проверяют положение фитилька и хроматограммы: конец фитилька должен быть погружен в растворитель, а края хроматограммы должны находиться на выступах эксикатора. Закрывают эксикатор крышкой.
Растворитель поднимается вверх по фитильку, а затем радиально распространяется по бумаге от центра. Когда растворитель достигнет края бумаги, ее вынимают из эксикатора, высушивают под тягой, обрабатывают 0,5%-м раствором нингидрина (готовится на ацетоне или спирте) и помещают в сушильный шкаф при 60-70 оС на 10-15 минут. На хроматограмме появляются сине-фиолетовые пятна, каждое из которых соответствует отдельной аминокислоте.
Нисходящая хроматография
В качестве хроматографической камеры используют высокие стеклянные банки с выступом в верхней части. На выступ в строго горизонтальном положении ставят лодочку – специальный стеклянный сосуд для растворителя.
Ход работы
Из хроматографической бумаги вырезают полоску шириной 5 см и длиной, примерно соответствующей высоте камеры. На расстоянии 10 см от конца полоски проводят простым карандашом стартовую линию, в середине которой отмечают точку старта. На стартовую точку микропипеткой наносят 0,005-0,01 мл смеси аминокислот (в несколько приемов, диаметр мокрого пятна не более 5 мм), периодически просушивая бумагу над электрической плиткой (или над настольной лампой).
На дно хроматографической камеры наливают небольшое количество нижнего слоя растворителя, а в установленную лодочку – верхний слой растворителя. Хроматограмму с нанесенной смесью аминокислот помещают в камеру так, чтобы ближний к старту конец был опущен в лодочку и зафиксирован в ней предметным стеклом, а другой висел вертикально, не касаясь стенок камеры. Камеру закрывают крышкой и оставляют при комнатной температуре на 18-20 часов.
Растворитель продвигается по хроматограмме сверху вниз, и когда фронт его приблизится к нижнему краю бумаги, хроматограмму вынимают из камеры и высушивают под тягой. Затем ее обрабатывают 0,5%-м раствором нингидрина и помещают в сушильный шкаф при 60-70 оС на 10-15 минут для развития окраски, после чего на ней появляются пятна сине-фиолетового или лилового цвета, соответствующие аминокислотам.
Результаты:
Выводы:
Четвертый этап. Определение составных компонентов сложных белков. Качественные реакции на продукты гидролиза нуклеопротеидов дрожжей
Нуклеопротеиды – сложные белки, простетической группой которых являются нуклеиновые кислоты. Для качественного анализа химического состава нуклеопротеидов могут быть использованы дрожжи, богатые этими сложными белками. Продукты кислотного гидролиза нуклеопротеидов дрожжей обнаруживают c помощью специфических качественных реакций.
Ход работы
1. Взвешивают 2,5 г пекарских дрожжей. Навеску помещают в колбочку и добавляют 20 мл 10%-го раствора серной кислоты. Колбочку закрывают пробкой, в которую вставлен обратный холодильник, и ставят на песочную баню. Через 1 час после начала кипения жидкости гидролиз прекращают. После охлаждения гидролизат фильтруют через бумажный фильтр.
2. С фильтратом проделывают качественные реакции на составные части нуклеопротеидов:
а) Биуретовая реакция на полипептиды
К 5 каплям гидролизата добавляют 10 капель 10%-го раствора гидроксида натрия и 1 каплю 1%-го раствора сульфата меди. Жидкость окрашивается в розово-фиолетовый цвет.
б) Серебряная проба на пуриновые основания
К 10 каплям гидролизата добавляют по каплям концентрированный раствор аммиака до щелочной реакции (проверить по индикаторной бумажке, опущенной в пробирку), затем 10 капель 2%-го аммиачного раствора нитрата серебра. При стоянии через 3-5 минут выпадает осадок серебряных соединений пуриновых оснований (аденина и гуанина), окрашенный в светло-коричневый (бурый) цвет.
в) Проба Молиша на пентозу
К 10 каплям гидролизата добавляют 3 капли 1%-го спиртового раствора тимола, перемешивают и по стенке пробирки осторожно приливают 20-30 капель концентрированной серной кислоты. После перемешивания развивается красное окрашивание, обусловленное продуктом конденсации тимола с фурфуролом, образовавшимся из пентозы.
г) Проба Троммера на рибозу и дезоксирибозу
К 5 каплям гидролизата добавляют 10 капель 30%-го раствора гидроксида натрия и 1-3 капли 7%-го раствора сульфата меди до появления неисчезающей мути гидроксида меди (II); перемешивают. При нагревании до кипения выпадает желтый осадок гидроксида меди (I) или красный осадок оксида меди (I).
д) Качественная реакция на рибозу и дезоксирибозу с дифениламином
Дифениламин дает синее окрашивание с дезоксирибозой и зеленое – с рибозой. К 5 каплям гидролизата добавляют 20 капель 1%-го раствора дифениламина и пробирку ставят в кипящую водяную баню на 15 минут. Развивается сине-зеленое окрашивание.
е) Качественная реакция на углеводы с a-нафтолом
К 5 каплям гидролизата добавляют 3 капли 0,2%-го спиртового раствора a-нафтола и 20 капель концентрированной серной кислоты. Появляется розово-фиолетовое окрашивание.
ж) Молибденовая проба на фосфорную кислоту
К 10 каплям гидролизата приливают 20 капель молибденового реактива и кипятят. При этом жидкость окрашивается в лимонно-желтый цвет. Пробирку сразу охлаждают в струе холодной воды. На дне пробирки появляется кристаллический лимонно-желтый осадок фосфорно-молибденовокислого аммония.
Общие выводы по работе:
РАБОТА 4. РАСТВОРИМОСТЬ И РЕАКЦИИ ОСАЖДЕНИЯ БЕЛКОВ
Цель работы: изучение важных свойств белков – способности к растворению и реакциям осаждения.
Задачи:
· выделить две основные фракции из яичного белка и доказать, что альбумин, входящий в его состав, хорошо растворяется в дистиллированной воде, а глобулин – в растворе солей;
· провести реакции необратимого осаждения белков;
· с помощью реакций высаливания разделить белки плазмы крови на основные фракции (фибриноген, альбумины и глобулины);
· доказать, что высаливание – обратимый процесс, при котором сохраняются свойства нативного белка, а денатурация – необратимый;
· проанализировать полученные результаты и сделать выводы.
1. Растворимость белков
Многие белки растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, для которых характерны кислотные свойства, а в щелочной – белки, обладающие основными свойствами. Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов. Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.).
Ход работы
1. К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
2. К 2 каплям яичного белка прибавляют 1 мл 5%-го раствора хлорида калия. В слабом солевом растворе растворяются как альбумины, так и глобулины.
3. Проверяют растворимость в воде и 5%-м растворе хлористого калия белка кератина, содержащегося в шерсти и волосах.
2. Реакции осаждения белков
Реакции осаждения белков могут быть необратимыми и обратимыми.
Необратимое осаждение белков (денатурация)
Принцип метода. Необратимые реакции осаждения приводят к денатурации белков, при этом разрушается пространственная структура молекулы и белки утрачивают свои естественные биологические и физико-химические свойства. Денатурацию белков можно вызвать физическими воздействиями (кипячение, замораживание, высокое давление, вибрация, радиоактивное излучение и др.) и химическими осадителями.
Осаждение белков неорганическими осадителями
РАЗДЕЛ 3. ФЕРМЕНТЫ
РАБОТА 5. ОЗНАКОМЛЕНИЕ С ДЕЙСТВИЕМ НЕКОТОРЫХ ФЕРМЕНТОВ
Цель работы: ознакомиться с каталитическим действием некоторых ферментов пищеварительного тракта (амилазы слюны, пепсина и липазы) и каталазы крови.
Задание:
· проделать предложенные реакции;
· написать уравнения реакций, катализируемых исследуемыми ферментами;
· проанализировать полученные результаты и сделать выводы.
1. Амилаза слюны
Амилаза слюны осуществляет гидролиз крахмала или гликогена.
Ход работы. В две пробирки вносят по 5 мл 0,2 %-го раствора крахмала, в одну из них добавляют 0,5 мл слюны. Содержимое перемешивают и пробы помещают в водяную баню (37 оС) на 15 минут.
В обе пробирки добавляют по 5 капель раствора Люголя (йода). В пробирке со слюной (амилазой) раствор не дает реакции на полисахарид, а в пробирке без слюны образуется сине-фиолетовое окрашивание.
2. Липаза поджелудочной железы
Липаза гидролизует жиры на глицерин и жирные кислоты, количество которых можно определить титрованием щелочью.
Ход работы. В две пробирки вносят по 1 мл растительного масла, 4 мл дистиллированной Н2О, 5 мл 1%-го раствора NaHCO3. Содержимое энергично встряхивают до образования эмульсии. Затем в обе пробирки добавляют по 5 капель спиртового раствора фенолфталеина, в одну из пробирок (опыт) – 1 мл липазы, а в другую (контроль) – 1 мл Н2О. Содержимое тщательно перемешивают и ставят в термостат (37 оС) на 15-20 минут. Вследствие образования жирных кислот в ходе реакции и нейтрализации ими щелочной среды раствор в пробе с липазой становится менее окрашенным или обесцвечивается, а в пробе без липазы не изменяется.
3. Пепсин
Пепсин, фермент желудочного сока, гидролизует белки до пептидов и аминокислот.
Ход работы. В две пробирки вносят несколько миллилитров раствора белка (альбумина) и легким подогревом на спиртовке или электроплитке денатурируют его. Пробы охлаждают до комнатной температуры и в одну из них добавляют раствор пепсина, а в другую – 1 мл Н2О. Обе пробы помещают в термостат (37 оС) на 20 минут, после чего сравнивают результаты.
4. Каталаза
Каталаза инактивирует перекись водорода, разлагая ее на воду и молекулярный кислород:
2Н2О2 ® 2Н2О + О2
Этот фермент содержится в эритроцитах, в клетках печени и других тканей.
Ход работы. В две пробирки вносят по 2 мл свежеприготовленного 5%-го раствора перекиси водорода, в одну из проб добавляют 1 каплю крови и перемешивают. В пробе с кровью (каталазой) вследствие выделения кислорода наблюдается интенсивное образование пузырьков.
Общие выводы по работе:
РАБОТА 6. ЗАВИСИМОСТЬ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ ОТ ТЕМПЕРАТУРЫ И рН СРЕДЫ
Цель работы: на примере амилазы слюны ознакомиться
с некоторыми специфическими свойствами ферментов.
Задание:
· проделать необходимые реакции;
· проанализировать полученные результаты и сформулировать выводы;
· написать уравнения реакций каталитического расщепления крахмала амилазой слюны.
Каждый фермент имеет свой оптимум рН, температуры и наибольшее сродство к какому-то субстрату. В этих условиях активность фермента максимальна.
1. Влияние температуры на активность амилазы
Ход работы. В три пробирки вносят по 1 мл слюны, одну из них помещают в лед, другую – в термостат с температурой 37 оС, содержимое третьей кипятят 5 минут, охлаждают струей воды и тоже помещают в термостат. Через 5 минут после этого во все пробы добавляют 5 мл 0,2%-го раствора крахмала, перемешивают и помещают в прежние условия. Через 20 минут во все пробы добавляют по 5 капель раствора Люголя.
Сравните окраску раствора всех проб и объясните различия.
2. Специфичность действия амилазы
Ход работы. В две пробирки вносят по 1 мл слюны. В одну из них добавляют 5 мл 0,2%-го раствора крахмала, в другую – 5 мл 0,5%-го раствора сахарозы. Пробы помещают на 20 минут в термостат (37 оС), после чего добавляют в них по 1 мл 10%-го раствора NaOH и по 0,5 мл 5%-го раствора сернокислой меди и содержимое доводят до кипения. В пробирке с крахмалом под влиянием амилазы образуется мальтоза, способная восстановить окись меди до закиси (красного цвета), – положительная проба Троммера. На сахарозу амилаза не действует, и в этой пробе окись меди не восстанавливается.
3. Определение оптимума рН активности амилазы
Ход работы. Перед началом работы готовят раствор амилазы. Для этого смешивают 1 мл 1%-го раствора крахмала и 0,5 мл слюны, разбавленной в 10 раз. Через каждые 2 минуты отбирают на предметное стекло по 1 капле этой смеси и добавляют к ней 1 каплю раствора Люголя. Крахмал должен полностью расщепиться за 10 минут (желтая окраска пробы с йодом). Если расщепление крахмала происходит быстрее, слюну надо развести еще в 2-4 раза; если медленнее – уменьшить начальное разведение.
В восемь пронумерованных пробирок наливают по 2 мл фосфатного буфера соответственно с рН: 5,4; 5,8; 6,2; 6,6; 6,8; 7,0; 7,4; 8,0. Во все пробирки добавляют по 5 мл 0,2%-го раствора крахмала (приготовленного на 0,1%-м растворе NаС1) и по 1 мл разбавленной слюны. Содержимое каждой пробирки тщательно перемешивают стеклянной палочкой, после чего пробирки помещают в термостат при 37 оС. Через каждые 3 минуты 1 каплю жидкости, взятой из пятой пробирки, смешивают на предметном стекле с 1 каплей раствора Люголя. Вначале при смешивании образуется синее окрашивание, затем фиолетовое, фиолетово-красное. Как только проба из пятой пробирки даст с йодом на предметном стекле красно-бурое окрашивание, все пробирки извлекают из термостата, охлаждают под струей холодной воды и добавляют по 2 капли раствора Люголя. Содержимое пробирок хорошо перемешивают и сравнивают окрашивание.
Общие выводы по работе:
РАБОТА 7. ОПРЕДЕЛЕНИЕ АКТИВНОСТИ АМИНОТРАНСФЕРАЗ
В СЫВОРОТКЕ КРОВИ ПО МЕТОДУ КИНГА
Цель работы: ознакомиться с одним из методов определения активности аминотрансфераз, широко используемых в медицинской и сельскохозяйственной практике для выявления заболеваний и прогнозирования хозяйственно полезных признаков у животных.
Задание:
· ознакомиться с предложенным методом определения активности аминотрансфераз в сыворотке крови;
· провести анализ и сделать выводы.
Определение активности аминотрансфераз (трансаминаз) крови имеет большое диагностическое значение. Например, при инфаркте миокарда в крови увеличена активность аспартатаминотрансферазы, при инфекционном гепатите возрастает активность аланинамино-трансферазы.
Принцип метода. Метод Кинга основан на способности аланин- и аспартаттрансаминаз конденсировать 2,4-динитрофенилгидразин и продукты дезаминирования аминокислот – пировиноградную и щавелевоуксусную кислоты:
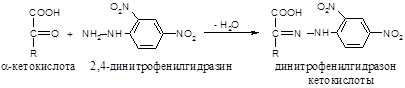
Ход работы. В одну пробирку вносят 0,2 мл сыворотки крови (опытная проба), в другую – 0,2 мл дистиллированной воды (контрольная проба); в обе пробирки добавляют по 0,5 мл 2%-го раствора аспарагиновой кислоты и по 0,5 мл 0,6%-го раствора a-кетоглутаровой кислоты. Пробы перемешивают и помещают на 60 минут в термостат (37 оС), после чего каталитическое действие фермента останавливают добавлением в обе пробы по 1 мл 0,1%-го раствора 2,4-динитрофенилгидразина и вновь помещают в термостат на 15 минут. Затем добавляют по 10 мл 0,4 н раствора NaOH и оставляют на 1-2 минуты до появления окраски. Пробы колориметрируют на ФЭКе с зеленым светофильтром в кюветах с толщиной слоя 10 мм.
Активность аминотрансфераз выражают в условных единицах, умножая оптическую плотность на 100.
У здоровых людей активность аминотрансфераз в сыворотке крови составляет 10-35 единиц.
Результаты:
Общие выводы по работе:
Вопросы для тестового контроля
1. Что такое ферменты?
2. Какова природа ферментов?
3. Что такое константа Михаэлиса (КМ)? В каких единицах она определяется?
4. Какие факторы влияют на ферментативную активность?
5. Что такое специфичность фермента? Назовите виды специфичности.
6. Что такое активный центр фермента?
7. Какую модель взаимодействия фермента и субстрата предложил Фишер?
8. Что такое модель индуцированного соответствия?
9. В чем различие между простетической группой и коферментом?
10. Что понимают под активностью фермента?
11. Что такое ингибиторы?
12. Назовите типы ингибирования.
13. Каков механизм специфического необратимого ингибирования? Приведите примеры.
14. Каков механизм неспецифического необратимого ингибирования? Приведите примеры.
15. Что такое конкурентное ингибирование? Приведите примеры.
16. Каков механизм аллостерического ингибирования? Какова его роль? Приведите примеры.
17. Что такое активаторы? Как ионы металлов активируют фермент?
18. Какова роль ионов металлов в катализе?
19. Какими способами регулируется активность ферментов?
20. Что такое конститутивные и индуцируемые ферменты?
21. Что такое компартментализация ферментов?
22. Что такое изоферменты? Приведите примеры.
23. На чем основана классификация ферментов?
24. Как используются ферменты в медицине, сельском хозяйстве и научных исследованиях? Приведите примеры.
РАЗДЕЛ 4. ВИТАМИНЫ
РАБОТА 8. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА НЕКОТОРЫЕ ВИТАМИНЫ
Цель работы: ознакомиться со свойствами и особенностями структуры некоторых витаминов.
Задачи:
· проделать предложенные химические реакции;
· проанализировать полученные результаты и сделать вывод.
1. Диазореакция на тиамин (В1)
Принцип метода. Раствор тиамина при добавлении к нему диазобензолсульфокислоты и щелочи окрашивается в оранжевый или красный цвет, вследствие образования соединения тиамина с диазобензолсульфокислотой.
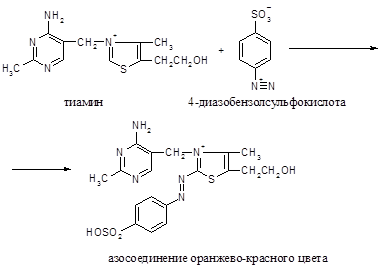
Ход работы. К 5 каплям 1%-го раствора сульфаниловой кислоты прибавляют 5 капель 5%-го раствора азотистокислого натрия, образуется диазобензолсульфокислота. К диазобензолсульфокислоте прибавляют немного порошка тиамина (или раствора), 5-7 капель 10%-го раствора карбоната натрия (соды). Жидкость окрашивается в оранжевый или красный цвет. Если раствор соды осторожно приливать по стенке наклоненной пробирки, то на границе двух жидкостей образуется красное кольцо.
2. Реакция окисления тиамина в тиохром
Принцип метода. При действии железосинеродистого калия тиамин окисляется с образованием желтого пигмента тиохрома.
Ход работы. К 1 капле раствора тиамина прибавляют 5-10 капель 10%-го раствора едкого натра и 1-2 капли 5%-го раствора железосинеродистого калия и перемешивают. При нагревании жидкость окрашивается в желтый цвет в результате превращения тиамина в тиохром.
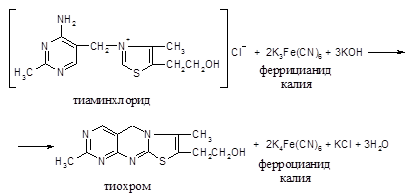
3. Реакция восстановления рибофлавина (В2)
Ход работы. В пробирку наливают 10 капель взвеси рибофлавина в воде, добавляют 5 капель концентрированной соляной кислоты и опускают кусочек металлического цинка. Начинается бурное выделение пузырьков водорода и жидкость постепенно окрашивается в розовый или красный цвет, затем окраска жидкости начинает бледнеть и обесцвечиваться.
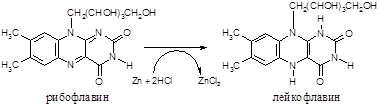
4. Проба на никотиновую кислоту (РР или В5)
Принцип метода. При нагревании никотиновой кислоты с уксуснокислой медью образуется осадок медной соли никотиновой кислоты.
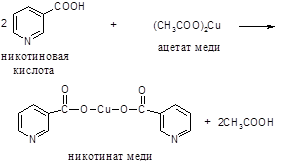
Ход работы. 5-10 мг никотиновой кислоты растворяют при нагревании в 10-20 каплях 10%-го раствора уксусной кислоты. К нагретому до кипения раствору добавляют равный объем 5%-го раствора уксуснокислой меди. Жидкость становится мутной, окрашивается в голубой цвет, а при стоянии выпадает осадок синего цвета.
5. Реакция на аскорбиновую кислоту
а) Восстановление феррицианида калия витамином С
Ход работы. В двух пробирках смешивают 1 каплю 5%-го раствора К3Fe(CN)6 c 1 каплей 1%-го раствора FeCl3. В одну из пробирок к зеленовато-бурой жидкости прибавляют 5-10 капель 1%-го раствора аскорбиновой кислоты, а в другую – столько же дистиллированной воды. Жидкость в первой пробирке приобретает зеленовато-синюю окраску, выпадает синий осадок берлинской лазури; во второй пробирке (контроль) зеленовато-бурая окраска жидкости остается без изменения.
1. аскорбиновая + 2К3Fе(СN)6 + 2КОН ® дегидро- + 2К4Fе(СN)6 + 2Н2О кислота феррицианид аскорбиновая ферроцианид
калия кислота калия
2. 3К4Fе(СN)6 + 4FеС13 ® Fе4[Fе(СN)6]3 + 12КСl
ферроцианид берлинская
калия лазурь
б) Реакция с 2,6-дихлорфенолиндофенолом (краской Тильманса)
Ход работы. В пробирку с 2,6-дихлорфенолиндофенолом вносят 0,5 мл 0,1%-го раствора HСl и по каплям 0,1%-го раствора аскорбиновой кислоты. Наблюдается обесцвечивание 2,6-дихлорфенолиндофенола.
6. Реакция на витамин А с концентрированной
серной кислотой
Принцип метода. При добавлении концентрированной серной кислоты к хлороформенной эмульсии рыбьего жира образуется красное окрашивание, переходящее в красно-бурое.
Ход определения. В сухую пробирку вносят 1 каплю рыбьего жира и 5 капель хлороформа, перемешивают и добавляют 1 каплю концентрированной серной кислоты.
7. Реакция на витамин D (анилиновая проба)
Принцип метода. При нагревании рыбьего жира, содержащего витамин D со смесью анилина и концентрированной HCl, раствор приобретает красную окраску.
Ход работы. В сухую пробирку вносят 1 каплю рыбьего жира, 5 капель хлороформа, встряхивают и добавляют 1 каплю анилинового реактива, при нагревании желтая эмульсия принимает красную окраску.
Общие выводы по работе:
РАБОТА 9. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АСКОРБИНОВОЙ КИСЛОТЫ В ПИЩЕВЫХ ПРОДУКТАХ И МОЧЕ
Цель работы: ознакомиться с одним из методов количественного определения витамина в пищевых продуктах и биологических жидкостях.
Задачи:
· определить содержание витамина С в пищевых продуктах и моче;
· сравнить полученные результаты и сделать выводы.
Принцип метода. Метод основан на способности витамина С восстанавливать 2,6-дихлорфенолиндофенол:
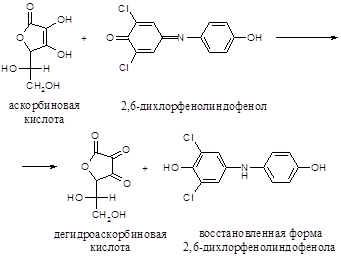
2,6-дихлорфенолиндофенол в щелочной среде имеет синюю окраску, в кислой среде – красную, в восстановленном состоянии – бесцветную:
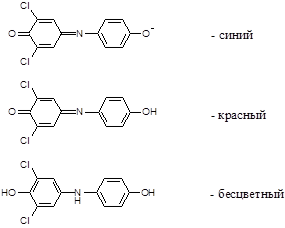
1. Определение содержания витамина C
в плодах шиповника
Ход работы
а) Гомогенизация биоматериала и экстракция витамина С
1 г сухих плодов измельчают в фарфоровой ступке с 2 мл дистиллированной воды, смесь количественно переносят в мерную колбу на 25 мл и доводят объем водой до метки. Через 10 минут смесь фильтруют через бумажный фильтр в мерную пробирку.
б) Количественное определение витамина C в экстракте
К 2 мл полученного фильтрата добавляют 2-3 капли 10%-го раствора соляной кислоты и 2 мл дистиллированной воды. Содержимое переливают
в колбочку на 50 мл и титруют 0,001 н раствором 2,6-дихлорфенол-
индофенола до появления розовой окраски, не исчезающей в течение 30 секунд.
Расчет. Содержание витамина C рассчитывают по формуле:
Х = (0,088. А. 25 . 100) / Б. В = (мг%),
где Х – содержание аскорбиновой кислоты в мг%;
А – количество раствора 2,6-дихлорфенолиндофенола (в мл), пошедшее на титрование;
В – количество сухого вещества в г, взятое для анализа;
Б – количество вытяжки в мл, взятое для титрования;
25 – общее количество вытяжки в мл;
0,088 – количество аскорбиновой кислоты в мг, эквивалентное
1 мл 0,001 н раствора 2,6-дихлорфенолиндофенола.
2. Определение содержания витамина С в хвое, картофеле
и других пищевых продуктах
а) Гомогенизация биоматериала и экстракция витамина С
Этот этап работы выполняют так же, как в предыдущем случае (при определении содержания аскорбиновой кислоты в шиповнике).
б) Количественное определение витамина C в экстракте
10 мл фильтрата* приливают в колбочку на 50 мл, подкисляют 2-3 каплями 10%-го раствора соляной кислоты и титруют так же, как в предыдущем случае.
*Примечание: если исходный цвет фильтрата сильно окрашен (например, у моркови или петрушки), берут 2 мл фильтрата и 8 мл дистиллированной воды, но это учитывают при расчетах.
Расчет делают по той же формуле, что и при определении витамина C в шиповнике, только количество вытяжки (Б), взятое для титрования, будет равно 10 мл.
3. Определение содержания витамина С в моче
Ход работы. В коническую колбу вносят 10 мл мочи и 10 мл дистиллированной воды. Добавляют 1 мл концентрированной уксусной кислоты и титруют 0,001 н раствором 2,6-дихлорфенолиндо-фенола до появления розовой окраски, не исчезающей в течение 30 секунд.
Расчет:
Х = (0,088 . А . 100) / 10 = (мг%),
где А – количество 0,001 н раствора 2,6-дихлорфенолиндофенола в мл, пошедшее на титрование;
10 – количество мочи в мл, взятое на титрование;
100 – коэффициент для выражения результата в мг%;
0,088 – эквивалент аскорбиновой кислоты.
Общие выводы по работе:
Вопросы для тестового контроля
1. Что такое витамины?
2. На чем основана классификация витаминов? Приведите примеры.
3. Какие витамины относятся к жирорастворимым?
4. Какие Вы знаете водорастворимые витамины?
5. Что такое провитамины, антивитамины?
6. Что такое гипо-, гипер- и авитаминоз?
7. Избыток каких витаминов может вызвать гипервитаминоз? Почему?
8. Перечислите основные различия в метаболизме водо- и жирорастворимых витаминов.
9. Какие соединения относят к витамину A? Какова его биологическая роль? Назовите основные симптомы гиповитаминоза A, источники поступления этого витамина в организм.
10. Назовите основных представителей витаминов группы D. Какие соединения являются активной формой витамина D? Какие органы принимают участие в образовании активной формы витамина D?
11. Какова биологическая роль витамина D?
12. Какие изменения появляются при гипо- и гипервитаминозе D?
13. Какие соединения относятся к витаминам группы K?
14. В каких биологических реакциях участвует витамин K? Какие симптомы характерны для гипо- и гипервитаминоза К?
15. Какие соединения относят к витамину Е?
16. Какие симптомы характерны для гипо- и гипервитаминоза Е? Какова биологическая роль этого витамина?
17. Какие соединения относятся к витамину F? Каковы его биологическая роль и клинические признаки гиповитаминоза F?
18. Структура и биологическая роль витамина В1, клиническое проявление гиповитаминоза B1.
19. Структура и биологическая роль витамина В2, клиническое проявление гиповитаминоза B2.
20. Структура и биологическая роль витамина В3, клиническое проявление гиповитаминоза B3.
21. Структура и биологическая роль витамина В5, клиническое проявление гиповитаминоза B5.
22. Структура и биологическая роль витамина В6, клиническое проявление гиповитаминоза B6.
23. Структура и биологическая роль фолиевой кислоты
(витамина Вс), клиническое проявление гиповитаминоза этого витамина.
24. Структура и биологическая роль витамина В12, клиническое проявление гиповитаминоза B12.
25. Структура и биологическая роль витамина C, клиническое проявление гиповитаминоза C.
26. Структура и биологическая роль витамина H, клиническое проявление гиповитаминоза H.
27. Структура и биологическая роль витамина P, клиническое проявление гиповитаминоза P.
РАЗДЕЛ 5. ОБМЕН ВЕЩЕСТВ
ХИМИЯ И ОБМЕН УГЛЕВОДОВ
РАБОТА 10. ОРТОТОЛУИДИНОВЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ В КРОВИ
Цель работы: ознакомиться с одним из распространенных методов количественного определения в крови основного показателя углеводного обмена - глюкозы.
Задачи:
· определить содержание глюкозы в крови;
· проанализировать полученные результаты и сделать выводы.
Принцип метода. Глюкоза при нагревании с ортотолуидином в растворе уксусной кислоты дает сине-зеленое окрашивание, интенсивность которого прямо пропорциональна концентрации глюкозы и определяется на фотоэлектроколориметре:
С ортотолуидиновым реактивом реагируют все альдогексозы, но их содержание в крови невелико, поэтому метод позволяет определить практически одну глюкозу.
Ход работы
а) Осаждение белков крови. В две центрифужные пробирки наливают по 0,9 мл 3%-го раствора трихлоруксусной кислоты, затем в одну из них вносят 0,1 мл крови (или сыворотки крови), а в другую – 0,1 мл стандартного раствора глюкозы (концентрация глюкозы в стандартном растворе составляет 100 мг%). Содержимое пробирок перемешивают и центрифугируют при 3000 об/мин в течение 10 мин.
б) Цветная реакция с ортотолуидиновым реактивом. В обычные сухие пробирки вносят по 0,5 мл надосадочной жидкости из каждой центрифужной пробирки, добавляют по 4,5 мл ортотолуидинового реактива и помещают в кипящую водяную баню (100 оС) на 8 минут. (Время инкубации проб и температурный режим необходимо соблюдать точно, кроме того, обязательным условием для нормального протекания данной реакции является непрерывное кипение воды в бане!). По истечении времени пробирки вынимают и охлаждают в водопроводной воде до комнатной температуры.
в) Измерение оптической плотности растворов. Оптическую плотность проб измеряют на фотоэлектроколориметре в кюветах на 10 мм против воды с красным светофильтром (620 нм)
Расчет. Содержание глюкозы в опытной пробе рассчитывают по стандартному раствору глюкозы по формуле:
С оп = (С ст. р-ра глюкозы ´ Е оп) / Е ст. р-ра глюкозы ,
где Cоп – концентрация глюкозы в крови в пробе, ммоль/л,
C ст. р-ра глюкозы. – концентрация глюкозы в стандартной пробе, 100 мг%,
Е оп. – оптическая плотность исследуемой пробы,
Е ст. р-ра глюкозы – оптическая плотность стандартного раствора глюкозы.
Примечание. Для перевода показателя в единицы СИ (ммоль/л) полученный результат при расчете необходимо умножить на 0,0555.
Нормальное содержание глюкозы в сыворотке крови человека, определенное этим методом, колеблется в пределах 3,33-5,55 ммоль/л (или 60-90 мг%).
Общие выводы по работе:
Работа 11. Глюкозооксидазный метод определения глюкозы в биологических жидкостях
Цель работы: ознакомиться с современным энзиматическим методом количественного определения глюкозы в биологических жидкостях, который широко применяется в клинической практике
Задачи:
· определить содержание глюкозы в предлагаемых образцах;
· проанализировать полученные результаты и сделать вывод.
Принцип метода. Глюкозооксидаза катализирует окисление глюкозы кислородом воздуха с образованием эквимолярного количества пероксида водорода. Под действием пероксидазы перекись водорода окисляет фенол, который превращается в бензохинон, окрашенный в розовый цвет. Интенсивность окраски пропорциональна концентрации глюкозы в пробе.
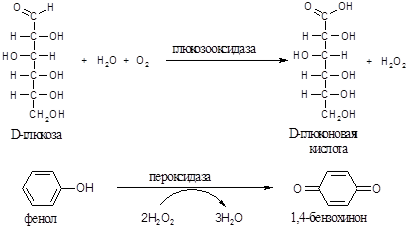
Из набора реагентов OLVEX DIAGNOSTICUM готовят перед анализом:
Состав набора
1. Стандартный раствор глюкозы – 10 ммоль/л
2. Рабочий реагент содержащий:
а) фосфат-фенольный буфер (рН 7,5),
б) глюкозооксидазу (25 000 U/л),
в) пероксидазу (1500 U/л).
Ход работы
В три обычные химические пробирки наливают:
1) в опытную – 0,01 мл сыворотки крови или свежей мочи,
2) в стандартную – 0,01 мл стандартного раствора глюкозы,
3) в контрольную – 0,01 мл дист. Н2О.
Затем во все пробирки добавляют по 2 мл рабочего реагента, смесь тщательно перемешивают и пробы помещают в термостат на 10 минут при 37 оС. После окончания инкубации измеряют оптическую плотность опытной и стандартной пробы против контроля в кюветах на 5 мм (или 3 мм) при длине волны 490-510 нм.
Окраска стабильна в течение часа после окончания инкубации при условии отсутствия воздействия прямых солнечных лучей.
Примечание
Количество глюкозы в моче определяют только при положительной качественной реакции на глюкозу. Реакция считается положительной, если смесь из 0,01 мл исследуемой мочи и 0,5 мл рабочего реагента через 15 минут приобретает розовую окраску.
Расчет
Расчет концентрации глюкозы проводят по формуле:
С = Е0/ Ест. ´10,
где Е0 – оптическая плотность опыта,
Ест. – оптическая плотностьстандарта,
10 – концентрация стандартного раствора глюкозы в моль/л.
Нормальное содержание глюкозы, определенное этим методом
в сыворотке или плазме крови здорового человека составляет 4,2-6,1 ммоль/л, в моче – < 0,8 ммоль/л.
Результаты:
Общие выводы по работе:
Вопросы для тестового контроля
1. Что такое углеводы?
2. Что такое моносахариды? Приведите примеры.
3. Что такое дисахариды? Приведите примеры.
4. Что такое полисахариды? Приведите примеры.
5. Назовите компоненты мальтозы. Напишите структурную формулу мальтозы. В чем ее отличие от изомальтозы?
6. Назовите компоненты лактозы. Напишите ее структурную формулу.
7. Структура и биологическая роль крахмала.
8. В чем различие между крахмалом и целлюлозой?
9. Какова суточная потребность в углеводах у человека?
10. Как происходит переваривание крахмала в организмах человека и моногастричных животных?
11. Какова роль балластных веществ? Происходит ли гидролиз целлюлозы в желудочно-кишечном тракте моногастричных животных?
12. В чем отличие переваривания углеводов у жвачных животных?
13. Какие существуют пути утилизации глюкозы в клетке?
14. Что такое гликолиз?
15. Какие ферменты в гликолизе являются ключевыми?
16. Какое значение имеет гликолиз?
17. В чем сходство и различие между гликолизом, гликогенолизом, спиртовым брожением и молочно-кислым брожением?
18. В чем различие между аэробным и анаэробным распадом глюкозы в клетке?
19. Что такое окислительное декарбоксилирование ПВК? Назовите основные компоненты мультиэнзимного комплекса, катализирующего этот процесс, и напишите общее уравнение этих реакций.
20. Какова роль ЦТК?
21. Назовите два основных пути синтеза глюкозы в организме.
22. Каково биологическое значение пентозофосфатного пути?
23. Какие 2 фазы выделяют в пентозофосфатном пути?
24. В чем сходство и различие между гликолизом и глюконеогенезом?
25. Почему глюконеогенез особенно важен для животных с четырехкамерным желудком?
26. Какие факторы способствуют усилению и ослаблению глюконеогенеза?
27. Какие ферменты участвуют в синтезе гликогена?
28. Какие ферменты участвуют в распаде гликогена в клетке?
29. Какой гликоген является источником глюкозы в крови?
30. Что такое цикл Кори? Каково его значение?
31. Какова концентрация глюкозы в крови человека? Причины гипо- и гипергликемии?
32. Почему не эффективен прием инсулина через рот?
33. Что такое почечная гликозурия? Когда она возникает?
34. Какая существует разница состава мочи у голодающих и
больных сахарным диабетом?
Задачи
1. Какой общий метаболит образуется из аминокислот, глюкозы и жирных кислот?
2. Какой из перечисленных ферментов катализирует реакцию биосинтеза гликогена:
а) a-1,6-глюкозидаза, б) гликогенфосфорилаза,
в) гликоген-синтетаза, г) фосфоглюкомутаза?
3. Сколько молекул восстановительных эквивалентов образуется в ЦТК?
Какие превращения в ЦТК связаны с гидратацией субстрата:
а) цитрата в цис-аконитат; б) сукцинил-КоА в сукцинат; в) фумарата в малат; г) оксалоацетата в сукцинат; д) цис-аконитата в изоцитрат?
5. На каких этапах превращения цикла Кребса происходят реакции дегидрирования:
а) цитрата в цис-аконитат; б) цитрата в изоцитрат; в) окислительное декарбоксилирование a-кетоглутарата; г) малата в оксалоацетат; д) сукцината в фумарат; е) фумарата в малат; ж) изоцитрата в a-кетоглутарат?
6. Напишите уравнения реакций пентозофосфатного цикла, связанные с образованием НАДФН+Н+. Какие ферменты катализируют эти реакции?
7. Почему гиповитаминоз В1 приводит к накоплению концентрации пирувата в крови и органах?
8. Какие изменения в обмене углеводов возникают в результате полного голодания: а) в течение 1-2 суток; б) при более длительном периоде (до 7 суток).
9. Почему при анемии организм хуже переносит физические нагрузки?
10. Почему при гипоксии повышено содержание пирувата в крови?
11. Почему при недостаточной обеспеченности организма витаминами В1, В2 и В5 повышено содержание лактата и пирувата в крови и органах?
12. Почему для повышения качества мяса перед транспортировкой животных к месту забоя рекомендуют применять транквилизаторы (мебикар и др.)?
13. Укажите, какие изменения в метаболизме углеводов возникают при приеме алкоголя натощак:
а) уменьшается отношение НАД+/НАДH+Н+?
б) увеличивается концентрация лактата и уменьшается
концентрация пирувата в печени и крови?
в) уменьшается скорость глюконеогенеза в печени?
г) ускоряется синтез гликогена в печени?
14. Почему во время обильной лактации у коров часто выявляют гипогликемию?
15. Почему при некоторых онкологических заболеваниях в крови повышено содержание лактата?
16. Почему при одновременном употреблении легко усваиваемых углеводов организм человека испытывает чувство голода?
17. Почему при недостаточном поступлении в организм тиамина (витамин В1) снижается эффективность кормового рациона и повышаются затраты кормов на единицу прироста?
18. Почему во время лактации потребности коров в углеводах возрастают?
19. Около 80% всей глюкозы, синтезируемой в организме овцы, используется в вымени. Расходуется глюкоза для образования молока, главным образом на синтез лактозы, триглицеридов молока. Зимой при низком качестве корма развивается кетоз. Обычно в таких случаях дают большие дозы пропионата. Почему?
20. Метаболизм этанола, поступающего в организм человека, происходит в печени. В результате двух реакций дегидрирования из 1 молекулы этанола образуются уксусная кислота и 2 молекулы НАДН+Н+. Уксусная кислота превращается в ацетил-КоА и включается в цикл Кребса. Накопление НАД-восстановленного в печеночных клетках приводит к изменению реакций, зависимых от этих эквивалентов. Особенно это выражено у хронических алкого-ликов, при приеме алкоголя натощак или при значительной физической нагрузке. Какие изменения углеводного обмена происходят при этом? Как это отражается на биохимических показателях крови?
21. Сладкий вкус зерен кукурузы в свежесобранных початках обусловлен высоким содержанием в них сахара. Через несколько дней (без специальной обработки) сахаристость кукурузы снижается, так как 50% свободного сахара в зернах превращается в крахмал в течение одного дня хранения. Чтобы сохранить сладкий вкус свежесобранной кукурузы, очищенные початки помещают на несколько минут в кипящую воду, затем охлаждают и замораживают. В чем биологическая основа этой обработки?
ХИМИЯ И ОБМЕН ЛИПИДОВ
РАБОТА 12. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ХОЛЕСТЕРИНА В СЫВОРОТКЕ КРОВИ МЕТОДОМ ИЛЬКА
Цель работы: ознакомиться с одним из распространенных методов количественного определения холестерина в сыворотке крови.
Задачи:
· построить калибровочную кривую по стандартным растворам холестерина;
· определить уровень холестерина в сыворотке крови;
· проанализировать полученные результаты и сделать выводы.
В норме количество холестерина в сыворотке крови составляет в среднем 165 мг%.
Обмен холестерина нарушается при ряде заболеваний, особенно при атеросклерозе. Содержание его в крови увеличивается при гипертонии, сахарном диабете, заболевании почек (липоидном нефрите).
Принцип метода. Метод основан на реакции Либермана - Бурхада. При действии концентрированной серной кислоты происходит дегидратация холестерина, конденсация образовавшихся продуктов в виде непредельных углеводородов, соединяющихся с серной кислотой с образованием окрашенных продуктов.
Ход работы
1. Построение калибровочной кривой
В 5 пробирок вносят реактивы в количестве, указанном в таблице:
| № п / п | Количество стандартного раствора холестерина, мл | Количество реактива Илька, мл | Количество холестерина, мг% | Е |
| 1 | 0,05 | 2,05 | 50 | |
| 2 | 0,10 | 2,00 | 100 | |
| 3 | 0,15 | 1,95 | 150 | |
| 4 | 0,20 | 1,90 | 200 | |
| 5 | 0,25 | 1,85 | 250 |
Содержимое пробирок осторожно перемешивают, закрывают пробками и оставляют в темноте на 20 минут. Затем растворы колориметрируют на ФЭКе против реактива Илька в кюветах на 5 мм с красным светофильтром. Полученные значения экстинкции (Е) используют для построения калибровочной кривой, откладывая по оси абсцисс количество холестерина в мг%, по оси ординат – оптическую плотность раствора.
Внимание! При выполнении методики необходимо быть особенно внимательными и осторожными, так как стандартный раствор холестерина приготовлен на концентрированной уксусной кислоте, а в состав реактива Илька входят концентрированная уксусная, концентрированная серная кислоты и уксусный ангидрид (в соотношении 1:1:5). Реактивы набирать только пипеткой с резиновой трубкой и стеклянным наконечником или автоматической пипеткой, не разливать, избегать попадания их на кожу, слизистые и одежду. Во время выполнения анализа пробирки обязательно закрывать пробками, а кюветы – крышками.
Калибровочная кривая
2. Определение содержания холестерина в сыворотке крови
В пробирку вносят 2 мл реактива Илька и 0,1 мл сыворотки крови. Содержимое перемешивают, закрывают пробкой и ставят в темное место на 20 минут, после чего колориметрируют, как при построении калибровочной кривой. Определяют концентрацию холестерина в сыворотке крови по полученной калибровочной кривой.
Результаты:
Общие выводы по работе:
работа 13. определение концентрации общего холестерина в сыворотке и плазме крови энзиматическим методом
Цель работы: ознакомиться с одним из самых распространенных в клинической биохимии методов определения холестерина.
Задачи:
· определить содержание общего (свободного и этерифицированного) холестерина в предложенной сыворотке крови;
· проанализировать полученные результаты и сделать вывод.
Принцип метода. При гидролизе эфиров холестеридов холестерин-эстеразой образуется холестерин. Общий холестерин (свободный и этерифицированный) окисляется кислородом воздуха под действием холестериноксидазы с образованием эквимолярного количества пероксида водорода:
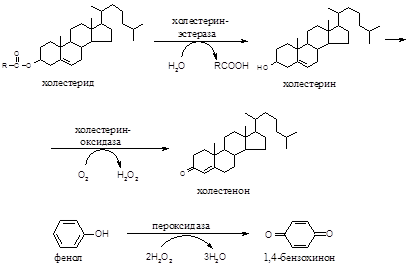
В присутствии пероксидазы перекись водорода окисляет фенол, который превращается в бензохинон, имеющий розовый цвет. Интенсивность окраски пропорциональна концентрации холестерина.
Реактивы
Из набора реагентов серии Olvex Diagnosticum готовят перед анализом:
1. Стандартный раствор холестерина – 5,17 ммоль/л (200 мг/дл),
2. Рабочий реагент, содержащий:
а) фосфатный буфер (100 ммоль/л),
б) фенол (20 ммоль/л),
в) холестеринэстеразу (400 U/л),
г) холестериноксидазу (250 U/л),
д) пероксидазу (500 U/л)
Ход работы
В три обычные химические пробирки наливают:
1) в опытную – 0,02 мл сыворотки (или плазмы) крови,
2) в стандартную – 0,02 мл стандартного раствора холестерина,
Во все пробирки добавляют по 2 мл рабочего реагента, реакционную смесь тщательно перемешивают и пробы помещают в термостат на 5 минут при 37 оС. Затем измеряют оптическую плотность опытной и стандартной проб против контроля в кюветах с рабочей длиной 5 мм (или 3 мм) при длине волны 490-500 нм.
Окраска проб стабильна в течение 2 часов при условии отсутствия воздействия прямых солнечных лучей.
Расчет
Расчет количества общего холестерина проводят по формуле:
С = Ео/Ест. ´ 5,17 [ммоль/л] или С = Ео/Ест. ´ 200 [мг/100мл],
где Ео – экстинция опытной пробы,
Ест – экстинция стандарта.
Содержание холестерина в сыворотке крови здоровых людей разного возраста колеблется в пределах:
20-29 лет – 3,72- 7,11 ммоль/л (144-175 мг/дл),
30-39 лет – 4,27-7,63 ммоль/л (165-295 мг/дл),
40-49 лет – 4,40- 8,15 ммоль/л (170-315 мг/дл),
старше 50 лет – 4,58-8,79 ммоль/л (177-340 мг/дл).
Результаты:
Общие выводы по работе:
РАБОТА 14. ЭКСПРЕСС-МЕТОД ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ КЕТОНОВЫХ ТЕЛ В КРОВИ, МОЧЕ И МОЛОКЕ
Цель работы: ознакомиться с некоторыми реакциями выявления кетоновых тел в биологических жидкостях.
Задачи:
· определить количество кетоновых тел в сыворотке крови, молоке и моче;
· проанализировать полученные результаты и сделать выводы.
Принцип метода. Ацетон и ацетоуксусная кислота образуют с нитропруссидом натрия в щелочной среде комплексное соединение розово-фиолетовой окраски. Интенсивность окраски зависит от количества кетоновых тел в реакции.
1. Качественная реакция выявления кетоновых тел
Ход работы. На кафель или стекло наносят 0,1-0,2 г порошка нитропруссида натрия, прибавляют 2-3 капли сыворотки крови и выдерживают 5 минут. Появление розово-фиолетовой окраски указывает на положительный результат. Минимальный уровень кетоновых тел в крови, дающий положительную реакцию, равен 10 мг/100 мл (10 мг%). Скорость развития окраски и ее интенсивность пропорциональны концентрации кетоновых тел в исследуемой пробе: если фиолетовое окрашивание возникает немедленно – содержание 50-80 мг% и более; если оно появляется через 1 минуту – в пробе содержится 30-50 мг%; развитие слабой окраски через 3 минуты свидетельствует о присутствии 10-30 мг% кетоновых тел.
2. Полуколичественный метод определения кетоновых тел
в сыворотке крови
Ход работы. После качественной реакции сыворотку крови разводят дистиллированной Н2О: при содержании 30-50 мг% делают разведения 1:3, 1:4, 1:5 и 1:6. Для этого берут 4 пробирки, в которые приливают по 0,1 мл сыворотки крови, в первую пробирку прибавляют 0,3, во вторую – 0,4, в третью – 0,5 и четвертую – 0,6 мл дистиллированной Н2О. Затем проводят качественную реакцию выявления кетоновых тел с нитропруссидом натрия на кафеле или предметном стекле так же, как в пункте 1, только прибавляют не цельную, а разведенную сыворотку крови. В пробе с наибольшим разведением, дающим положительную реакцию, содержится 10 мг% кетоновых тел. Умножая результат на степень разведения, получают содержание кетоновых тел в неразведенной пробе.
Кетоновые тела в свежеполученном молоке и моче определяют так же, как и в сыворотке крови (пункт 1). Следует помнить, что тест более чем в 3 раза чувствительнее при определении ацетоуксусной кислоты, чем ацетона. Из всех кетоновых тел в сыворотке крови человека ацетоуксусная кислота является преобладающей, однако в крови здоровых коров 70-90% кетоновых тел составляет b-оксимасляная кислота, в молоке на ее долю приходится 87-92%.
Результаты:
Общие выводы по работе:
Вопросы для тестового контроля
1. Что такое липиды?
2. Приведите классификацию липидов.
3. В чем заключается роль липидов?
4. Какова суточная потребность в липидах у человека?
5. Как построены триацилглицерины (ТАГ)?
6. Что такое эссенциальные жирные кислоты? Приведите примеры.
7. Из чего состоит фосфатидилхолин? Какова его роль? Приведите другие примеры глицерофосфолипидов.
8. Назовите основные компоненты в сфингомиелине.
9. Какие составные компоненты определяются в цереброзидах?
10. В чем сходство и различие между цереброзидами, ганглиозидами и сульфатидами?
11. Что такое стероиды?
12. Изобразите структуру холестерина.
13. Какими реакциями определяется холестерин?
14. Назовите ферменты, участвующие в гидролизе липидов в кишечнике.
15. Назовите желчные кислоты. Из какого вещества они образуются?
16. Что такое парные желчные кислоты? Напишите структурную формулу наиболее распространенных из них.
17. Какое соединение является предшественником для желчных кислот? Из чего они синтезируются?
18. Какова роль желчных кислот?
19. Назовите основные особенности переваривания липидов у жвачных животных.
20. Какие транспортные частицы липидов присутствуют в крови? Какие из них образуются в слизистой кишечника?
21. Какие липопротеины плазмы крови содержат наибольшее количество эндогенных ТАГ?
22. Какие липопротеины плазмы крови содержат наибольшее количество холестерина?
23. Какие ферменты участвуют во внутриклеточном липолизе?
24. Какая внутриклеточная липаза является гормон-зависимой?
25. Что такое b-окисление жирных кислот? Где оно протекает?
26. Как происходит активация жирных кислот? Какое соединение участвует в переносе жирной кислоты из цитоплазмы в матрикс митохондрий?
27. Какой метаболит образуется при b-окислении жирных кислот?
28. Какие существуют пути утилизации активной уксусной кислоты (ацетил-КоА)?
29. Какой метаболит еще, кроме ацетил-КоА, образуется при окислении жирных кислот с нечетным числом углеродных атомов?
30. Какова особенность b-окисления ненасыщенных жирных кислот?
31. Какая жирная кислота преимущественно синтезируется в организме человека?
32. Какие вещества необходимы для синтеза пальмитиновой кислоты?
33. В чем заключается ключевая роль ацилпереносящего белка (АПБ-SH)?
34. Назовите источники НАДФН+Н+, необходимые для синтеза жирных кислот.
35. Из какого метаболита синтезируется холестерин?
36. Назовите функции холестерина.
37. Патогенез каких заболеваний связан с гиперхолестеринемией?
38. Как рассчитывается холестериновый индекс атерогенности?
39. Какие метаболиты относятся к кетоновым телам?
40. Из чего они образуются?
41. Где синтезируются кетоновые тела?
42. Какова роль кетоновых тел?
43. В каких тканях утилизируются кетоновые тела?
44. Что такое кетоз?
45. При каких состояниях развивается кетоз?
46. Каковы основные причины возникновения кетозов у крупного рогатого скота?
47. Классификация кетозов.
48. Что такое жировая инфильтрация печени?
49. Назовите липотропные факторы.
50. Какие гормоны усиливают липолиз (мобилизацию жира из жировых депо)?
51. Какие гормоны усиливают липогенез?
Калибровочная кривая
Расчет по формуле:
Общие выводы по работе:
РАЗДЕЛ 6. ГОРМОНЫ
РАБОТА 18. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ГОРМОНЫ
Цель работы: ознакомиться с некоторыми химическими свойствами готовых препаратов гормонов.
Задачи:
· проделать перечисленные ниже химические реакции;
· проанализировать полученные результаты и сделать вывод.
1. Качественные реакции на инсулин
а) Реакция Геллера. К 10 каплям концентрированной азотной кислоты осторожно по стенке пробирки приливают равный объем (10 капель) раствора инсулина. Пробирку наклоняют под углом 45о так, чтобы жидкости не смешивались. На границе двух жидкостей образуется белый аморфный осадок в виде небольшого кольца.
б) Биуретовая реакция. К 10 каплям инсулина добавляют 5 капель 10%-го раствора едкого натра и 1 каплю 1%-го раствора сернокислой меди. Жидкость окрашивается в фиолетовый цвет.
в) Реакция Фоля. К 5 каплям раствора инсулина приливают 5 капель реактива Фоля и кипятят. Через 1-2 минуты появляется бурый или черный осадок сульфида свинца.
2. Качественные реакции на адреналин
По химической природе адреналин является производным пирокатехина. Он легко окисляется, превращаясь в неактивный хинон – адренохром (красного цвета):

Адренохром далее полимеризуется с образованием высокомоле-кулярного коричневого пигмента.
а) Реакция с хлорным железом. При взаимодействии адреналина с хлорным железом образуется зеленое комплексное соединение типа фенолята.
В пробирку вносят три капли раствора адреналина (1:1000) и 1 каплю 1%-го раствора хлорного железа. Жидкость приобретает зеленое окрашивание. При добавлении 1 капли концентрированного аммиака окраска переходит в красную вследствие образования адренохрома, а затем в коричневую
б) Диазореакция. В результате взаимодействия адреналина с диазосоединениями образуются азокрасители.
В пробирку вносят по 3 капли 1%-го раствора сульфаниловой кислоты, 5%-го раствора азотистокислого натрия, 5 капель раствора адреналина (1:1000) и 3 капли 10%-го раствора углекислого натрия. Жидкость окрашивается в красный цвет.
3. Реакция на фолликулин
Фолликулин (эстрон), половой гормон стероидной структуры, является производным углеводорода эстрана:
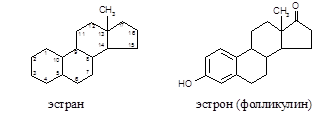
а) Реакция с концентрированной серной кислотой. При взаимодей-ствии фолликулина с концентрированной серной кислотой образуется эфирное соединение соломенно-желтого цвета (фолликулинсульфат):
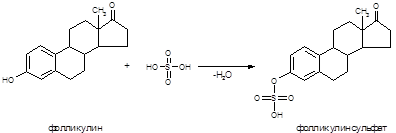
В пробирку вносят 3-5 капель масляного раствора фолликулина и 2 капли концентрированной серной кислоты. Жидкость окрашивается в соломенно-желтый цвет.
4. Определение 17-кетостероидов в моче
17-кетостероиды являются конечным продуктом обмена гормонов коры надпочечников половых гормонов (тестостерона и эстрадиола). При 17-м углеродном атоме циклопентанпергидрофенантренового ядра они имеют кетогруппу.
Принцип метода. Нормальное содержание 17-кетостероидов в суточной моче составляет 10-16 мг у мужчин и 6-13 мг у женщин. Качественная реакция на 17-кетостероиды проводится с м-динитро-бензолом, при этом образуется продукт конденсации вишнево-красного цвета.
Ход работы. В пробирку вносят 5 капель мочи, 5 капель 30%-го раствора едкого натра, 5 капель 2%-го раствора м-динитробензола в этиловом спирте и перемешивают. Через 2-3 мин появляется вишнево-красное окрашивание, характерное для 17-кетостероидов.
5. Реакция на тироксин
При щелочном гидролизе тироксина с KOH образуется иодистый калий. Его можно окислить в молекулярный иод иодатом калия в кислой среде. Иод дает синее окрашивание с крахмалом:
5KI + KIO3 + 6HCl ¾® 3I2 + 6KCl + 3H2O,
I2 + крахмал ¾® синее окрашивание.
Ход работы. Таблетированный тиреоидин (5 таблеток) растирают в ступке. Порошок переносят в колбу, добавляют 5 мл 10%-го раствора KHCO3 и 5 мл дистиллированной воды. Смесь кипятят в течение 10-15 минут.
24 капли охлажденного гидролизата переносят в пробирку и добавляют по каплям 10%-й раствор серной кислоты до кислой реакции (на лакмус). После подкисления добавляют 3 капли 1%-го раствора крахмала и 5-10 капель 2%-го раствора иодата калия (не следует добавлять избыток). Выделившийся иод дает синее окрашивание с крахмалом.
Общие выводы по работе:
ПЕРЕЧЕНЬ НАЗВАНИЙ РЕФЕРАТОВ ПО ТЕМЕ «ГОРМОНЫ»
1. Химическая природа и классификация гормонов.
2. Механизм действия гормонов.
3. Биотехнология получения гормонов. Применение генной инженерии в производстве гормонов.
4. Гормоны гипофиза и их влияние на обмен веществ.
5. Гормоны поджелудочной железы, структура и биологическая роль.
6. Гормоны щитовидной железы, их биологическая роль.
7. Инсулин, его влияние на обмен веществ.
8. Гормоны мозгового слоя надпочечников, структура, роль в обмене веществ.
9. Адреналин, структура и биологическая роль. Механизм действия адреналина.
10. Метаболизм адреналина.
11. Химическая природа и механизм действия гормонов, регулирующих минеральный обмен.
12. Гормоны паращитовидной железы, их роль в обмене веществ.
13. Биологическая роль и структура гормонов коркового слоя надпочечников.
14. Половые гормоны: структура и биологическая роль.
15. Простагландины и их применение в сельском хозяйстве.
16. Стресс, влияние на организм.
17. Промышленные стрессы и их влияние на продуктивность сельскохозяйственных животных.
18. Применение гормонов в сельском хозяйстве.
19. Роль нейропептидов.
20. Роль гипоталамуса в регуляции обменных процессов в организме.
21. Гормоноиды (гормоны местного действия), структура, свойства и биологическая роль.
22. Наследственные аномалии обмена гормонов.
23. Гормоны беспозвоночных.
24. Развитие эндокринной системы в филогенезе.
25. Развитие эндокринной системы в онтогенезе.
РАЗДЕЛ 7. БИОХИМИЯ МОЛОКА
РАБОТА 19. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА НЕКОТОРЫЕ СОСТАВНЫЕ ЧАСТИ МОЛОКА
Цель работы: изучение физико-химического состава молока.
Задачи:
· с помощью качественных реакций доказать, что в состав молока входят белки (казеин, альбумин и глобулин), углеводы (лактоза) и другие компоненты;
· определить, какие соединения появляются в кислом молоке;
· проанализировать полученные результаты и сделать выводы.
Молоко представляет собой секрет молочных желез. В его состав входит около 200 различных веществ, которые можно разделить на пять основных групп – вода, белки, липиды, углеводы и минеральные соли. Химический состав молока зависит от вида животного, породы, возраста самки, периода лактации, условий кормления и других факторов.
Вода. На долю воды может приходиться от 67,7% (олень) до 90,3% (лошадь). В коровьем молоке в среднем содержится около 88,0% воды. Она может находиться в свободном и связанном состояниях. Свободная вода легко удаляется при сгущении, высушивании и других обработках, связанная – входит в состав сольватных оболочек коллоидов.
Белки. Содержание белков в молоке различных животных варьирует от 0,9% (олень) до 5,1% (овца), в коровьем молоке оно составляет 2,9-4,0%. В обезжиренном молоке 45-55% белков составляет a-казеин. Его молекулярная масса 19-100 тыс. В молоке он образует казеинат-кальций-фосфатный комплекс, участвующий в формировании оболочки жировых шариков.
a-Лактальбумин имеет молекулярную массу 14437, устойчив к нагреванию, участвует в биосинтезе лактозы из галактозы и глюкозы. b-Лактоальбумин имеет молекулярную массу 36 тыс., денатурирует при рН=7 и нагревании до 70 оС; его кристаллы не растворяются в воде и растворяются в разбавленных растворах солей.
Глобулины молока имеют высокую молекулярную массу (от 150 тыс. до 1 млн.), обладают свойствами липооксидаз, их молекула содержит углеводный компонент.
Протеозо-пептонную фракцию представляют простые белки, связанные с углеводными компонентами: гексозами, сиаловыми кислотами и гексозаминами. Фракция содержится в сыворотке молока (образуется после осаждения казеина) и мицеллах.
Кроме этого, в молоке имеются и другие белки – ферменты всех шести классов, красный протеин, лактолин и др.
Небелковые азотистые вещества. Их содержание достигает 0,021-0,036%, состоят из мочевины (более половины), аминокислот, пуриновых оснований, креатина и других веществ.
Углеводы. На долю углеводов у разных животных приходится от 2,8 (олень) до 6,5% (лошадь), в коровьем молоке они составляют около 4,9%. Углеводы находятся в свободном состоянии и связанных с белками формах. Свободные углеводы представлены лактозой (в среднем 4,7%), галактозой, глюкозой, фосфорными эфирами моноз, аминосахарами. Связанные углеводы составляют 0,3% молока. Это моносахариды, гексозамины, сиаловые кислоты, лактоза. Больше всего лактозы содержится в молоке носорога (до 36% от общей массы).
Липиды. В молоке они представляют собой смесь нейтрального жира, стероидов, фосфатидов, гликолипидов и их производных. Содержание их в молоке животных различных видов неодинаково – наибольшее количество (17,1%) отмечено у оленя, минимальное – у лошади (всего 1,0%), в коровьем молоке – в среднем 4,9%.
Основу липидов молока составляют триглицериды (98-99% от общей массы), в составе которых чаще всего обнаруживаются остатки пальмитиновой, олеиновой, стеариновой и миристиновой кислот (всего 60-64 жирные кислоты с углеродной цепью от С4 до С26). Общее содержание ненасыщенных жирных кислот в липидной фракции молока достигает летом 34,45-42% и зимой – 25,40-33,78%. Холестерина в молоке содержится 0,012-0,013%. Стероиды концентрируются в оболочках жировых шариков.
Витамины. Коровье молоко содержит витамины: В1 – 0,04, В2 – 0,15, РР – 0,1, С – 1,5, А – 0,25, D – 0,05. 10-3, Е – 0,09 мг/100 г. Для обогащения молока животным дают корма, богатые витаминами, вводят концентраты витаминов А и D или же Е. Молоко может быть обогащено витаминами также биологическим путем – при введении микробов, синтезирующих определенные витамины. Так, внесение в молоко штаммов молочнокислых бактерий дает возможность повысить в простокваше и кефире содержание витамина C в 2-4, РР – в 5-10, В12 – в 20-50, В2 – в 1,5-2 раза.
Пигменты. Молоко содержит каротины, лактофлавин, небольшое количество хлорофиллов. От них зависит окраска молока.
Минеральные вещества. Их содержание в молоке составляет 0,7-1%, они находятся в свободном и связанном состояниях. Молоко коровы содержит хлориды, фосфаты, цитраты, гидрокарбонат натрия, сульфат натрия. Молоко богато кальцием (11,2-12,8 мг), 78% которого находится в фосфатах и цитратах, 22% – связано с казеином. Кроме этого, молоко содержит многие микроэлементы (Fe, Cu, Zn, Mn). Минеральные вещества находятся в виде солей, кислот, ионов, биокомплексов, входят в состав металлоэнзимов и др.
1. Определение удельного веса молока
Удельный вес молока колеблется от 1,028 до 1,034 (при 15 оС). Снятое молоко имеет более высокий удельный вес.
Ход работы.
Молоко хорошо перемешивают, наливают в сухой цилиндр (на 100 мл) и осторожно опускают в него ареометр. Легким толчком по верхушке ареометра заставляют его совершить несколько небольших движений вниз и вверх (движение поплавка). Когда он остановится (необходимо следить, чтобы ареометр не касался стенок цилиндра), записывают результат. Одновременно определяют температуру молока, так как от этого показателя зависит удельный вес молока.
2. Определение рН молока
Реакция среды кислая или близка к нейтральной: рН= 6,5-7,0
Ход работы.
Самый простой способ определения – с помощью индикаторной бумажки. На индикаторную (лучше универсальную) бумажку наносят несколько капель молока и определяют рН.
3. Определение белков молока
Осаждение казеина
Молоко разбавляют в 5 раз (в стакан или колбочку на 100 мл приливают 10 мл молока и 40 мл дистиллированной воды), после чего прибавляют по каплям (постоянно помешивая палочкой) 0,1%-й раствор уксусной кислоты до прекращения образования хлопьевидного осадка казеина, осаждающего и жир.
Примечание. Прибавлять кислоту следует осторожно, так как при ее избытке казеин растворяется.
Осадок отфильтровывают. Полученный при этом фильтрат (№ 1) используют для определения в нем всех остальных белков, содержащихся в молоке, а осадок промывают несколько раз дистиллированной водой и с помощью биуретовой реакции доказывают наличие белка казеина в нем.
Выделение альбумина
К 25 мл фильтрата № 1 прибавляют 2 мл 10%-го раствора аммиака, насыщают порошком сернокислого магния, помутнение раствора при этом указывает на присутствие глобулина. Образовавшийся осадок отфильтровывают, полученный фильтрат № 2 используют для выделения альбумина, а осадок промывают дистиллированной водой и с помощью цветных реакций доказывают присутствие в нем белка глобулина.
Выделение глобулинов
Фильтрат № 2 слегка подкисляют 10%-м раствором уксусной кислоты и нагревают до кипения. Выпавший осадок лактоальбумина отфильтровывают; полученный при этом фильтрат № 3 используют для определения лактозы, а осадок, оставшийся на фильтре, промывают дистиллированной водой и с помощью цветных реакций доказывают присутствие белка лактоальбумина в нем.
4. Определение лактозы в молоке (реакция Фелинга)
К 2-3 мл фильтрата № 3 прибавляют 1-2 мл 10%-го раствора едкого натра, 0,5-1 мл 5%-го раствора сернокислой меди и доводят до кипения. Изменение цвета раствора и выпадение осадка красного цвета свидетельствуют о присутствии лактозы в растворе, которая обладает восстанавливающими свойствами и способна восстановить окись меди до закиси.
5. Определение кальция и фосфора в молоке
а) В пробирку приливают 2-3 мл фильтрата № 3, добавляют немного раствора молибденовокислого аммония и нагревают. Помутнение раствора свидетельствует о выпадении фосфорно-молибденово-кислого аммония. При охлаждении выпадает желтый кристаллический осадок (NH4)3PO4.12MoO3.
б) В пробирку вносят 2-3 мл фильтрата № 3, добавляют раствор щавелевокислого аммония – выпадает осадок щавелевокислого кальция.
6. Специфические реакции на кислое молоко
а) Реакция Уфельмана (на молочную кислоту)
Фильтрат кислого молока смешивают с реактивом Уфельмана (к 2-3 мл 2%-го раствора фенола прибавляют 4-5 капель раствора FeCl3), появляющееся желтое с зеленоватым оттенком окрашивание свидетельствует о наличии молочнокислого железа.
б) Алкогольная проба
В пробирку наливают 3-5 мл молока и такое же количество 68-70%-го спирта. Наклонив пробирку, наблюдают за происходящими изменениями. Свежее молоко слегка разжижается, так как в слабокислом молоке (около 22о Тернера) появляются отдельные зернышки а в сильнокислом (более 27о Тернера) – образуется много хлопьев.
Примечание. Градусом Тернера называют количество миллилитров 0,1 н раствора щелочи, необходимое для нейтрализации 100 мл молока.
в) Проба с кипячением
В пробирку наливают 3 мл молока и кипятят. Кислое молоко сворачивается. В качестве контроля проделывают такую же реакцию со свежим молоком и сравнивают результаты.
Общие выводы по работе:
ПРИЛОЖЕНИЯ
Сроки и условия хранения исследуемой пробы при определении некоторых показателей крови
При исследовании крови следует знать и учитывать целый ряд факторов, в противном случае возможна необъективная интерпретация полученных результатов.
Прежде всего, надо иметь в виду, что при наличии гемолиза некоторые биохимические показатели остаются без изменений, в то же время другие могут значительно отличаться от тех же показателей в негемолизированной сыворотке. В частности, гемолиз мешает определению концентрации общего белка, билирубина, холестерина, железа, мочевины, меди, неорганического фосфора, однако не оказывает существенного влияния на такие показатели, как активность холинэстеразы, концентрация глюкозы.
На некоторые показатели оказывает влияние присутствие антикоагулянтов. Так, стабилизация крови гепарином, цитратом или оксалатом мешает определению меди. В то же время присутствие антикоагулянтов не влияет на определение неорганического фосфора.
Наиболее важное значение имеют продолжительность хранения исследуемой пробы (с момента взятия крови и начала анализа) и условия, при которых она хранится. Концентрация неорганического фосфора остается стабильной в течение 7 суток при хранении при +4 оС и 2 суток – при комнатной температуре. С увеличением продолжительности срока хранения сыворотки содержание неорганического фосфора возрастает за счет распада органических веществ, содержащих фосфор (АТФ, глюкозо-6-фосфат и др.). Определение билирубина должно проводиться по возможности быстро, сыворотку нужно хранить в темном месте. Концентрация кальция в сыворотке крови не меняется в течение 10 дней как при +4 оС, так и при 20-25 оС. Концентрация холестерина достаточно стабильна в течение 6 суток при любых условиях хранения сыворотки крови. За такой же период (6 суток) не происходит серьезных изменений в содержании общего белка, однако в этом случае сыворотку необходимо хранить при температуре +4 оС. Концентрация меди и магния остается без изменений на протяжении 14 и 7 суток (соответственно). Концентрация железа в сыворотке крови не меняется в течение 7 суток, если ее хранить при +4 оС, и 4 суток – при хранении в условиях комнатной температуры. Активность холинэстеразы устойчива в сыворотке крови на протяжении 7 суток.
Определение концентрации глюкозы должно проводиться в течение 4 часов с момента взятия крови, так как при более длительном хранении содержание сахара снижается. При удалении белка концентрация глюкозы в надосадочной жидкости достаточно стабильна в течение 2-3 суток. Очень лабильна концентрация промежуточного метаболита глюкозы – пирувата. Для определения этого показателя кровь необходимо брать в охлажденные пробирки, не следует использовать жгут, а анализ проводят сразу же после взятия пробы.
Таблица перевода основных биохимических
показателей в систему СИ
| Показатели | Единицы СИ | Коэффициент перевода в систему СИ |
| Глюкоза Общий белок Билирубин Холестерин Кальций Фосфор Железо Медь Магний Каротин Витамин А Кетоновые тела ПВК | ммоль/л г/л мкмоль/л ммоль/л ммоль/л ммоль/л мкмоль/л мкмоль/л ммоль/л мкмоль/л мкмоль/л г/л мкмоль/л | мг% ´ 0,0555 г% ´ 10 мг% ´ 17,104 мг% ´ 0,0259 мг% ´ 0,2495 мг% ´ 0,3229 мкг% ´ 0,1791 мкг% ´ 0,1574 мг% ´ 0,4113 мкг% ´ 0,0186 мкг% ´ 0,0349 мг% ´ 0,01 мг% ´ 113,6 |
Вопросы к экзаменационным билетам
по биологической химии
1. Роль биохимии в развитии науки, промышленности и сельском хозяйстве.
БЕЛКИ. АМИНОКИСЛОТЫ
2. Классификация аминокислот.
3. Заменимые и незаменимые аминокислоты.
4. Моноаминодикарбоновые кислоты. Роль глютаминовой кислоты в обмене веществ.
5. Гетероциклические аминокислоты. Структура и биологическая роль гистидина.
6. Серосодержащие аминокислоты. Роль метионина и цистеина в обмене веществ.
7. Роль белков в организме животных.
8. Классификация белков.
9. Первичная структура белковой молекулы.
10. Вторичная структура молекулы белка.
11. Коллаген. Особенности его структуры, роль в организме.
12. Третичная структура белка.
13. Четвертичная структура белка. Примеры строения и функционирования олигомерных белков.
ФЕРМЕНТЫ
14. Химическая природа ферментов, их структура. Понятие об изоферментах и мультиэнзимных комплексах. Активный центр ферментов. Общее представление о механизме действия ферментов.
15. Активный центр ферментов.
16. Общие свойства ферментов.
17. Действие ингибиторов на активность ферментов. Типы ингибирования.
18. Специфичность действия ферментов.
19. Классификация и номенклатура ферментов.
20. Применение ферментов в научных исследованиях, в медицинской, ветеринарной и с/х практике.
НУКЛЕИНОВЫЕ КИСЛОТЫ
21. Структура и биологическая роль мононуклеотидов.
22. Структура, биологическая роль и пути биосинтеза АТФ в клетке.
23. Первичная структура нуклеиновых кислот.
24. Структура, свойства и функции основных классов РНК.
25. Особенности структуры и роль тРНК.
26. Структура и биологическая роль мРНК.
27. Рибосомы, их строение и роль в биосинтезе белка.
28. Структура и биологическая роль ДНК. Укладка ДНК в хроматине и в хромосомах.
29. Принцип комплементарности азотистых оснований в нуклеиновых кислотах, его роль.
30. Генетический код, его свойства.
ВИТАМИНЫ
31. Классификация витаминов.
32. Коферментная функция витаминов.
33. Витамин группы А.
34. Витамин группы Д.
35. Витамин Е.
36. Витамин К.
37. Витамин F.
38. Витамин В1. Методы доклинического выявления недостаточности тиамина.
39. Витамин В2.
40. Витамин В3.
41. Витамин M (фолиевая кислота).
42. Витамин РР.
43. Витамин В6.
44. Витамин Н.
45. Витамин С.
46. Антианемические витамины.
47. Причины возникновения гипо- и авитаминозов.
48. Общая характеристика метаболизма витаминов.
биологическое окисление
49. Биологическое окисление. Последовательность расположения переносчиков в дыхательной цепи.
50. Пиридинзависимые дегидрогеназы.
51. Флавинзависимые дегидрогеназы.
52. Ферменты цитохромной системы.
53. Компоненты дыхательной цепи неферментной природы.
54. Окислительное фосфорилирование. Пути биосинтеза АТФ.
ОБМЕН УГЛЕВОДОВ
55. Переваривание и всасывание углеводов. Особенности
переваривания углеводов у жвачных.
56. Понятие о балластных веществах, их биологическая роль.
57. Биосинтез и распад гликогена в печени.
58. Гликолиз.
59. Гликогенолиз.
60. Аэробное окисление глюкозы.
61. Цикл трикарбоновых кислот.
62. Баланс энергии распада глюкозы.
63. Пентозный цикл.
64. Пути биосинтеза глюкозы в организме.
65. Особенности спиртового и молочно-кислого брожения.
66. Глюконеогенез, его значение.
ОБМЕН ЛИПИДОВ
67. Классификация липидов.
68. Переваривание и всасывание липидов. Особенности переваривания у жвачных.
69. Структура и биологическая роль желчных кислот в переваривании и всасывании липидов.
70. b-окисление жирных кислот.
71. Баланс энергии распада жирных кислот (на примере пальмитиновой кислоты).
72. Биосинтез жирных кислот.
73. Синтез фосфатидной кислоты и ее роль в обмене липидов.
74. Биосинтез сфингозинсодержащих липидов.
75. Метаболизм и биологическая роль холестерина.
76. Метаболизм кетоновых тел.
77. Нарушение обмена липидов.
78. Кетозы у крупного рогатого скота.
ОБМЕН БЕЛКОВ
79. Роль белков в питании. Азотистый баланс. Белковый минимум.
80. Переваривание и всасывание белков. Особенности переваривания у жвачных.
81. Трансаминирование.
82. Дезаминирование аминокислот.
83. Декарбоксилирование аминокислот. Роль и распад биогенных аминов.
84. Пути обезвреживания аммиака в организме.
85. Биосинтез мочевины.
86. Общие пути биосинтеза аминокислот.
87. Роль аминотрансфераз в обмене белков. Применение их в медицинской, ветеринарной и с/х практике.
88. Незаменимые пищевые факторы.
89. Взаимосвязь обмена белков, углеводов и липидов.
90. Роль микрофлоры желудочно-кишечного тракта в переваривании веществ у жвачных.
ГОРМОНЫ
91. Гормоны щитовидной железы.
92. Гормоны мозгового слоя надпочечников.
93. Гормоны коры надпочечников.
94. Гормоны поджелудочной железы.
95. Гормоны гипофиза.
96. Половые гормоны.
97. Женские половые гормоны.
Опыт 9. Получение золя мыла
Ход работы. Налейте в пробирку 10 мл дистиллированной воды и, добавляя небольшие кусочки настроганного мыла, интенсивно ее взбалтывайте. В начале (при малых концентрациях мыла) образуется истинный прозрачный раствор со щелочной реакцией (рН>7). С увеличением концентрации часть молекул мыла и молекул высших карбоновых кислот (получающихся в процессе гидролиза) будет конденсироваться. Это заметно по опалесценции раствора. Определите рН раствора при растворении мыла. В дальнейшем система становится грубодисперсной, мутной.
Вопросы и задачи
1. Что такое раствор? Истинный и коллоидный растворы.
2. Влияние структуры вещества на его способность растворяться.
а) Почему жир хорошо растворяется в бензине, хлороформе, гексане, но плохо растворим в воде?
б) Почему NaCl хорошо растворяется в воде, но очень плохо в гидрофобных растворителях?
3. Дать определение молярной, нормальной концентрации и массовой доли (процентной концентрации)?
4. Что такое pH?
5. Чему равно значение pH растворов:
1.0 M HCl, 0.1 М HCl, 0.01 M HCl
6. Рассчитать pH 0,01н раствора CH3COOH. Константа диссоциации кислоты равна 1,75·10-5.
7. Значения pH крови, желудочного сока, молока.
8. Ионное произведение воды. Почему при повышении температуры воды происходит увеличение [H+]? Что при этом происходит с [OH-].
9. Почему pH дистиллированной воды обычно несколько меньше 7.
10. Почему растворы мыла, стиральных порошков и соды имеют значение pH > 7?
11. Показать различие между общей и активной кислотностью. Что такое степень диссоциации?
12. Дать определение кислотно-основного индикатора. Привести примеры индикаторов.
13. Методы определения pH.
14. Буферные растворы. Влияние добавления кислоты, щелочи и воды на pH буферного раствора. Буферная ёмкость. Буферные системы плазмы крови.
15. Что такое диффузия. Привести примеры.
16. Осмотическое давление. Онкотическое давление
17. Тургор. Его функции.
18. Гемолиз эритроцитов. Почему нельзя вводить в кровь дистиллированную воду?
19. Гипотонический, гипертонический и изотонический растворы. Физиологический раствор.
20. Почему длительное нахождение в воде с высоким содержанием солей (например, в воде Мёртвого моря) вызывает химические ожоги?
21. Плазмолиз, деплазмолиз. Почему вакуоль растительной клетки сжимается при помещении в гипертонический раствор?
22. Какие системы изучает коллоидная химия?
23. Методы получения золей.
24. Строение мицеллы.
25. Какой будет знак заряда частицы золя, если к раствору, содержащему избыток AgNO3, добавить раствор KBr?
26. Почему в присутствии мыла растительное масло и вода образуют стойкую эмульсию?
27. Что такое молоко с точки зрения коллоидной химии?
28. Почему сахароза (дисахарид) при растворении в воде образует истинный раствор, а крахмал (полисахарид) – коллоидный?
содержание
Предисловие ...............................................................................…...... 3
БИОЛОГИЧЕСКАЯ ХИМИЯ
Раздел 1. Методы исследования в биохимии ………. 4
Работа 1. Колориметрический метод определения концент-
рации окрашенных веществ в растворах. Принцип и техника колориметрирования. Устройство и правила работы на КФК-2 .................................................................. 4
Раздел 2. состав и свойства белков ……..…….………. 11
2.1. анализ аминокислотного состава белков …… 11
Работа 2. Цветные реакции на белки ..........................................…... 11
Работа 3. Выделение белков из тканей и биологических
жидкостей. Изучение состава простых и сложных
белков .........................................................................…......20
Работа 4. Растворимость и реакции осаждения белков ........…........27
Вопросы для тестового контроля ...................................….............31
РАЗДЕЛ 3. ФЕРМЕНТЫ……………………………………………. 32
Работа 5. Ознакомление с действием некоторых ферментов ....…..32
Работа 6. Зависимость каталитической активности ферментов
от температуры и рН среды ...............................…............34
Работа 7. Определение активности аминотрансфераз в
сыворотке крови по методу Кинга ............................…....35
Вопросы для тестового контроля ..............................................…...37
РАЗДЕЛ 4. ВИТАМИНЫ ……………………………………………38
Работа 8. Качественные реакции на некоторые витамины .........….38
Работа 9. Количественное определение аскорбиновой
кислоты в пищевых продуктах и моче ..................…..…..41
Вопросы для тестового контроля ..............................................…...44
РАЗДЕЛ 5. ОБМЕН ВЕЩЕСТВ ………………………………….…46
5.1. ХИМИЯ И ОБМЕН УГЛЕВОДОВ ……………………………. 46
Работа 10. Ортотолуидиновый метод определения глюкозы
в крови ...........................................................................…...46
Работа 11. Глюкозооксидазный метод определения
глюкозы в биологических жидкостях ...............................47
Вопросы для тестового контроля ...……..................…................…50
Задачи .......................................................................................………51
5.2. ХИМИЯ И ОБМЕН ЛИПИДОВ ……………………..……...53
Работа 12. Количественное определение холестерина
в сыворотке крови методом Илька .....................….......53
Работа 13. Определение концентрации общего холестерина
в сыворотке и плазме крови
энзиматическим методом.....................….....................55
Работа 14. Экспресс-метод определения содержания
кетоновых тел в крови, моче и молоке ...................….58
Вопросы для тестового контроля ....…..........................…..........59
5.3. Химия и обмен белков и аминокислот…….… 61
Работа 15. Количественное определение белка в сыворотке
крови биуретовым методом ............................…..…..61
Вопросы для тестового контроля ............................................... 63
5.4. ХИМИЯ И ОБМЕН НУКЛЕОПРОТЕИДОВ.……….…… ..64
Вопросы для тестового контроля........ ...............................….....64
5.5. ВОДНО-МИНЕРАЛЬНЫЙ ОБМЕН ………………………..66
Работа 16. Количественное определение кальция в сыворотке
крови по методу Ваарда ...................…..................... 66
Работа 17. Определение неорганического фосфора в крови …..68
РАЗДЕЛ 6. ГОРМОНЫ ……….………………………………… 70
Работа 18. Качественные реакции на гормоны .................…….. 70
Перечень названий рефератов по теме «Гормоны» ..............… 73
РАЗДЕЛ 7. Биохимия молока ………….…………...…… 74
Работа 19. Качественные реакции на некоторые составные
части молока ........................….............................…… 74
Приложения .…………………………………………….….……. 79
Сроки и условия хранения исследуемой пробы при
определении некоторых показателей крови ................................ 79
Таблица перевода основных биохимических показателей
в систему СИ..........................................................…..........…....… 80
Вопросы к экзаменационным билетам
по биологической химии ............................................................... 81
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ ………………….. 85
Работа 1. Определение рН растворов ......…................................. 85
Работа 2. Буферные растворы ....................................................... 89
Работа 3. Методы получения коллоидных систем (гидрофобные
и гидрофильные золи и эмульсии)……....................... 92
Вопросы и задачи.........................................…................….......... 96
Учебное издание
БИОЛОГИЧЕСКАЯ, ФИЗИЧЕСКАЯ
И КОЛЛОИДНАЯ ХИМИЯ
Методические указания
к лабораторным работам и контрольные вопросы и задачи для студентов II курса агротехнического факультета специальности «Зоотехния»
Петрозаводск
Издательство ПетрГУ
2007
Рассмотрены и утверждены к печати на заседании редакционной комиссии по отрасли науки и техники «биология» 11 сентября 2007 г.
Печатаются по решению редакционно-издательского совета
Петрозаводского государственного университета
Составители
В. В. Осташкова, канд. биол. наук;
В. П. Андреев, доктор хим. наук;
Я. П. Нижник, канд. хим. наук
ПРЕДИСЛОВИЕ
Настоящие методические указания содержат лабораторные работы по биологической, физической и коллоидной химии, выполняемые студентами II курса агротехнического факультета специальности «Зоотехния» в процессе изучения предмета. На лабораторных занятиях студенты овладевают методами экспериментальных исследований, закрепляют теоретические знания, анализируют полученные на практических занятиях результаты. В каждой лабораторной работе излагаются цель и задачи, поставленные перед студентом, принцип используемого метода, ход работы, предлагается проанализировать результаты проведенных исследований и сделать выводы. Представленные в конце каждого раздела вопросы и задачи способствуют лучшему усвоению теоретического материала при самоподготовке.
БИОЛОГИЧЕСКАЯ ХИМИЯ
РАЗДЕЛ 1. МЕТОДЫ ИССЛЕДОВАНИЯ В БИОХИМИИ
РАБОТА 1. КОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ОКРАШЕННЫХ ВЕЩЕСТВ В РАСТВОРАХ. ПРИНЦИП И ТЕХНИКА КОЛОРИМЕТ-РИРОВАНИЯ. УСТРОЙСТВО И ПРАВИЛА РАБОТЫ НА КФК-2
Цель работы: ознакомиться с одним из наиболее распространенных в биохимии методов количественного определения веществ в исследуемом растворе.
Задачи:
· ознакомиться с основными принципами и правилами работы на КФК-2;
· измерить оптическую плотность двух окрашенных растворов;
· подобрать наиболее оптимальную длину волны и размер кюветы для определения оптической плотности предложенных растворов.
Фотометрия — метод количественного анализа, основанный на определении концентрации вещества по спектру поглощения, испускания или флуоресценции.
В зависимости от характера возникающих изменений выделяется несколько видов фотометрии (колориметрия, нефелометрия, турбидиметрия, флуориметрия, рефрактометрия, поляриметрия и др.). Фотометрические методы анализа характеризуются высокой чувствительностью, достигающей 10-4-10-6 % определяемого элемента в твердых образцах и 10-5-10-7 % – в водных растворах. Колориметрический метод получил самое широкое распространение среди биохимических методов количественного определения веществ в биологических объектах.
Принцип метода. В основе этого метода лежит закон Бугера-- Ламберта - Бера, согласно которому существует прямо пропорцио-нальная зависимость между концентрацией вещества в окрашенном растворе и степенью поглощения света данным раствором.
Интенсивность поглощения света зависит не только от количества и природы растворенного вещества, но и от толщины слоя раствора, длины волны падающего света, температуры раствора.
D = ecl ,
где D - оптическая плотность;
e - коэффициент экстинкции (л/моль·см);
с - молярная концентрация (моль/л);
l- - толщина слоя раствора (см).
Степень поглощения света окрашенным раствором выражается оптической плотностью (экстинкцией), под которой понимают логарифм отношения интенсивности света, падающего на раствор, к интенсивности света, прошедшего через раствор [D = lg(I0/I)]. Величина оптической плотности обозначается буквой Е или D. Чем больше оптическая плотность, тем меньше света пропускает раствор. Для определения оптической плотности или светопропускания используют фотоэлектроколориметры.
1.Устройство фотоэлектроколориметра КФК-2
Колориметр фотоэлектрический концентрационный (КФК-2) предназначен для количественного определения веществ в окрашенных растворах по их оптической плотности или коэффициенту светопропускания в диапазоне волн 315-980 нм. КФК-2 состоит из оптического блока (передняя часть прибора), где находятся осветитель, светофильтр, оптика, кюветное отделение, фотометрическое устройство и регистрирующий прибор, и блока питания (задняя часть), где расположен стабилизатор напряжения с выпрямителем и силовой трансформатор.
Источником света в колориметре служит галогенная лампа. Приемниками излучения являются фотоэлемент Ф-26 для работы в диапазоне волн 315-540 нм и фотодиод ФД-24К для работы в специальном диапазоне 590-980 нм.
Световой поток лампы с помощью специальных устройств конденсируется, усиливается и проходит через светофильтр, кювету с исследуемым раствором и падает на приемник излучения. При этом световое излучение преобразуется в электрические сигналы, которые подаются на измерительный прибор. Показания микроамперметра пропорциональны световому потоку, проходящему через исследуемый раствор.
2. Выбор светофильтра
При проведении фотоэлектроколориметрии следует учитывать, что в данном методе используется монохроматический свет, причем различных длин волн. Для преобразования полихроматического света в монохроматический используются светофильтры. В КФК-2 имеется набор из 11 светофильтров. Использование конкретного светофильтра позволяет пропускать через раствор лучи определенной длины, поглощение которых наиболее характерно для исследуемого вещества. Обычно эффективная длина волны и цвет светофильтра указаны в применяемом методе. Если же такой ссылки нет, то выбрать нужный светофильтр можно с помощью таблицы.
Таблица
| Окраска исследуемого раствора | Цвет нужного светофильтра | Длина волны пропускаемого света, нм |
| Желтая | синий | 420 - 450 |
| Оранжевая | синий | 430 – 460 |
| Красная | зеленый | 460 - 500 |
| Пурпурная | зеленый | 490 - 530 |
| Синяя | оранжевый | 590 |
| Сине-зеленая | красный | 600 - 650 |
| Голубая | красный | 750 |
| Сине-фиолетовая | красный | 750 |
Примечание. Выбор светофильтра по данной таблице приблизителен, так как некоторые растворы одинакового цвета могут избирательно поглощать лучи с различной длиной волны. Поэтому при подборе светофильтра желательно знать спектр поглощения исследуемого вещества, причем выбор его осуществляют таким образом, чтобы он пропускал лучи с длиной волны, максимально поглощаемой исследуемым раствором. Таким образом, при выборе светофильтра оптимальной длиной волны окажется та, при прохождении которой через исследуемый раствор оптическая плотность будет максимальной.
3. Подбор кювет
Известно, что чем толще слой жидкости, через который проходит луч света, тем больше будет поглощение светового пучка и тем выше показание оптической плотности исследуемого раствора. К колориметру прилагается набор кювет, отличающихся расстоянием между рабочими гранями, через которые проходит световой поток. Это расстояние (в мм) указано на одной из рабочих граней. На боковой стенке кюветы имеется метка, до которой необходимо наливать жидкость. При работе с летучими растворами кюветы закрывают специальными крышками.
К каждому прибору прилагается набор кювет с толщиной слоя исследуемого раствора от 1 до 50 мм. Подбор кювет осуществляется таким образом, чтобы оптическая плотность исследуемого раствора не была ниже величины 0,15 и выше 0,7. Именно в этих пределах наиболее точно выполняется закон Бугера -- Ламберта - Бера. Следовательно, при интенсивной окраске раствора необходимо взять кюветы с меньшим расстоянием между рабочими гранями, а при слабой окраске – с большим расстоянием.
4. Общая схема прибора и обозначения

1 - рукоятка установки светофильтра (около рукоятки маркировка по длине волны);
2 – ручка перемещения кювет в кюветном отделении;
3 – ручка включения чувствительности фотоприемников (обозначена цифрами 1, 2 и 3 черного цвета при работе в диапазоне волн от 315 до 540 нм и красного цвета - в диапазоне от 590 до 980 нм);
4 – микроамперметр (имеет две шкалы: по верхней измеряют коэффициент светопропускания, а по нижней – оптическую плотность раствора);
5 – ручка «грубой» настройки микроамперметра;
6 – установка «точной» настройки микроамперметра;
7 – крышка кюветного отделения.
5. Правила работы на КФК-2
I. Подготовка прибора к работе
1. Установить нужный светофильтр (рукоятка 1).
2. Рукоятку 3 (чувствительность фотоэлемента) установить на цифру 1 соответствующего цвета: при работе в диапазоне волн от 315 до 540 нм чувствительность обозначена цифрами черного цвета, в диапазоне от 590 до980 нм – красного цвета.
3. Проверить, выключен ли микроамперметр (рукоятки 5 и 6 должны быть повернуты до отказа влево).
4. Прибор включить (вилку – в сеть; тумблер, расположенный на задней стенке в нижнем левом углу, переключить в положение «вкл»). При этом загорается лампочка накаливания.
5. Прибор прогреть в течение 15-20 минут.
II. Измерение оптической плотности раствора
1. Кювету с контролем или растворителем поставить в дальнее (от исследователя) гнездо кюветодержателя; кювету с исследуемым раствором (опыт) – в ближнее гнездо кюветодержателя.
2. Кювету с контролем (или растворителем) поместить в световой поток поворотом ручки 2 до отказа влево.
3. Закрыть крышку кюветного отделения (7).
4. Установить стрелку микроамперметра на 0 по нижней шкале поворотом ручки 5 («грубой» настройки). В случае необходимости воспользоваться ручкой 6 («точной» настройки).
Примечание. Если не удается вывести стрелку микроамперметра на 0, то необходимо повысить чувствительность фотоэлемента. Для этого необходимо:
а) микроамперметр выключить (рукоятки 5 и 6 до отказа влево);
б) рукоятку переключения чувствительности фотоэлемента (3) поставить на цифру 2 соответствующего цвета;
в) вывести стрелку микроамперметра на 0 по нижней шкале (то есть повторить действия, указанные в пункте 4).
Если и в этом случае стрелка микроамперметра не выводится на 0, необходимо еще раз повысить чувствительность фотоэлемента, повторяя все действия, перечисленные в пунктах «а», «б» и «в», но установив рукоятку 3 на цифру 3 соответствующего цвета.
5. Заменить в световом потоке кювету с контролем на кювету с исследуемым раствором (опытом), поворачивая рукоятку 2 до отказа вправо.
6. Записать величину оптической плотности исследуемого раствора по нижней шкале микроамперметра.
7. Микроамперметр выключить (рукоятки 5 и 6 до отказа влево).
III. Завершение работы на приборе
1. Реактивы из кювет вылить.
2. Кюветы сполоснуть дистиллированной водой и поставить в чашку Петри вверх донышком (кюветы необходимо полоскать только после полного завершения работы или методики, в промежутках между отдельными измерениями этого делать не следует !).
3. Прибор выключить (тумблер, расположенный на задней стенке в левом углу, переключить в положение «выкл.»; вилку вынуть из розетки).
4. Крышку кюветного отделения закрыть.
Примечание. При работе на КФК-2 необходимо соблюдать следующие правила:
1. До включения прибора в сеть проверить заземление.
2. Не оставлять прибор включенным без надобности.
3. Следить за чистотой прибора, не проливать реактивы.
4. Не хлопать крышкой кюветного отделения.
5. Особенно осторожно обращаться с кюветами, не царапать, протирать только мягкой и чистой тряпочкой (марлей).
6. При смене светофильтра работу продолжать не ранее чем через 5 минут.
7. При переключении светофильтров и замене кювет в кюветодержателе микроамперметр должен быть выключен (рукоятки 5 и 6 должны находиться в крайнем левом положении!).
6. Определение концентрации вещества в растворе
по оптической плотности
Определение концентрации вещества в окрашенном растворе по оптической плотности можно осуществить двумя способами – путем сравнения с оптической плотностью стандартного раствора (такой способ используется, например, в ортотолуидиновом методе определения глюкозы в крови) или, более точно, в результате построения калибровочной кривой. В этом случае готовят ряд растворов определяемого вещества с известными концентрациями (стандартные растворы), проделывают с ними необходимые химические реакции и измеряют на ФЭКе их оптическую плотность. Полученные результаты отражают графически, откладывая по оси абсцисс концентрацию вещества, а по оси ординат – соответствующую ей оптическую плотность. Определив оптическую плотность исследуемого раствора, находят по калибровочной кривой содержание в нем вещества.
Результаты проведенных исследований оформляют в виде таблицы:
| Длина волны | Цвет светофильтра | Е голубого раствора | Е желтого раствора |
Выводы:
Дата: 2019-12-10, просмотров: 421.