Релаксационный эффект объясняется тем, что перемещение иона в электрическом поле сопровождается разрушением ионной атмосферы в одном положении иона и образованием ее в другом. Этот процесс происходит не мгновенно, в течение некоторого времени, называемого временем релаксации. В результате ионная атмосфера теряет центральную симметрию и позади движущегося иона возникает избыток заряда противоположного знака. Действующая при этом сила электростатического притяжения тормозит движение иона.
Электрофоретический эффект торможения возникает за счет того, что сольватированная ионная атмосфера, обладая зарядом, противоположным по знаку заряда центрального иона, движется в противоположном направлении. Таким образом, сольватированный центральный ион под действием электрического напряжения не в неподвижной среде, а в среде, перемещающейся ему на встречу, что приводит к снижению его скорости движения.
Силы релаксационного и электрофоретического торможения зависят от ионной силы раствора, природы растворителя и температуры.
Электроды II рода. Хлорсеребряный электрод. Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала хлорсеребряного электрода.
Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала хлорсеребряного электрода.
Электродами второго рода называют сложные многофазные электроды, формально обратимые как относительно катионов, так и относительно анионов.
Состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и содержащего тот же анион, что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag | AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl, опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag + RT/nF·ln aAg+ = E°Ag+/Ag + RT/nF·ln ПР(AgCl)/aCl- = E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный раствор:
AgCl= Ag+ + Cl-

Схема хлорсеребряного электрода:
1. Серебряная проволока
2. Слой AgCl
3. Раствор KCl
4. Микрощель
Билет 3
Молярная электропроводность и факторы, влияющие на неё
Классификация шкал, водородный потенциал
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора Смолярная электропроводность связана следующим соотношением:
λ = 1000к/С ,Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении
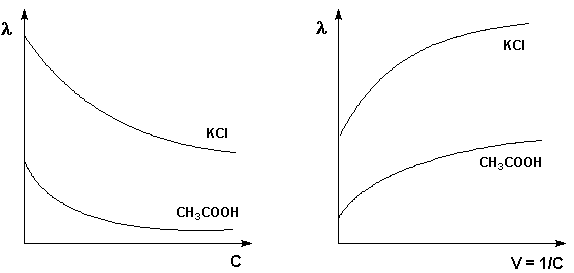
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса:
λ = α F ( U + + U - )
λ = α (λК + λА) [ λ ] = [см*м2/моль]
2.
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
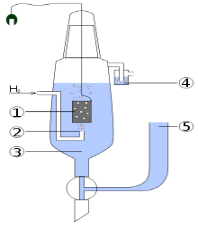 1. Платиновый электрод.
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Дописать.
Билет 4
1. Подвижность и гидротация. Скорость движения ионов. Закон Кольрауша.
2. Электроды 1ого рода. Схема записи, реакция, уравнение Нернста
9. Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и гидратация ионов.
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся независимо один от другого.
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле.
Заряд и радиус иона, т. е. его природа: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже подвижность иона в растворе.
Природа растворителя, его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры гидратированного иона и меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора. При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора. Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита и его количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его размер и снижает его подвижность.Чем выше диэлектрическая проницаемость (полярность) растворителя, тем сильнее сольватируется ион; при этом увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его природы, от природы растворителя и температуры, но не зависит от природы другого иона в данном электролите.
2.------------------
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
(обратимость относительно тех или иных ионов означает зависимость его потенциала от концентрации данных ионов)
( переписать стандартный водородный электрод)
Билет 5
1.Кондуктометрия.Кондуктометрическое титрование
2.Электроды.Электроды 2 рода.Схема записи,процесс происходящий на электроде.Формула Нернста.
Кондуктометрия - это метод анализа, основанный на измерении электропроводности анализируемого раствора.
Для подобных измерений созданы специальные приборы — кондуктометры.
В основе их — схема из четырех сопротивлений — мост Уитстона (рис. 13.6).
Кондуктометрическое титрование .
а) А этот метод применяется для определения концентрации веществ. Принцип основан на том, что в т.н. критических точках титрования (КТТ) резко меняется зависимость проводимости раствора от количества титранта. Три примера кривых титрования приведены на рис. 13.8.
б) Чтобы объяснить первую кривую, обратимся к реакции
I. При добавлении в ячейку NaOH подвижные ионы H+ связываются с гидроксил–ионами b заменяются на менее подвижные ионы Na+. Поэтому электропроводность ячейки снижается и в критической точке титрования (VKTT) она минимальна.
II. Но затем, по мере добавления избыточных количеств ионов Na+ и OH-, которые уже ни с чем не связываются и ничего не замещают, а просто накапливаются в ячейке, электропроводность, очевидно, опять повышается.
в) При титровании слабого электролита (рис. 13.8,б) небольшой подъем χ наблюдается за-долго до VKTT — из-за того, что увеличивается степень диссоциации электролита. Но после VKTT проводимость начинает возрастать гораздо быстрей.
2.
Электродом, называют электронопроводящую фазу (металлы или полупроводники), контактирующую с ионным проводником (электролитом).
Электродами второго рода называют сложные многофазные электроды, формально обратимые как относительно катионов, так и относительно анионов.
Состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и содержащего тот же анион, что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag | AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl, опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag + RT/nF·ln aAg+ = E°Ag+/Ag + RT/nF·ln ПР(AgCl)/aCl- = E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный раствор:
AgCl= Ag+ + Cl-
6 билет
1. Потенциометрия. Потенциометрическое титрование.
2. Подвижность ионов и гидратация. Скорость движения ионов. Закон Кольрауша.
Измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия.
Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
определить в растворе концентрацию соли FeCl3. Составим гальванический эле-мент -один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
до титрования в левом полуэлементе ОВ-пары ещѐ нет, так как имеется только один ее компонент — ионы Fe3+.
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 .
Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением еѐ компонентов:
ΔΨ = Ψ (Fe3+/Fe2+) = Ψ0Fe3+/Fe2+) +  ∙ lg
∙ lg  . (15.26,а-б)
. (15.26,а-б)
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).
Б. В критической точке титрования (КТТ) будет оттитровано всѐ количество Fe3+, так что в растворе останутся только про-дукты реак-ции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возник-нет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
ΔΨ = Ψ (Sn4+/Sn2+) = Ψ0 (Sn4+/Sn2+) + 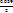 ∙ lg
∙ lg 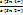 . (15.27,а-б)
. (15.27,а-б)
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ про-должает снижаться.
е) Но теперь критический объѐм титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объѐме, можно найти и количе-ство исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
Заметим, что самомỳ критическому объѐму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
9. Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и гидратация ионов.
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся независимо один от другого.
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле.
Заряд и радиус иона, т. е. его природа: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже подвижность иона в растворе.
Природа растворителя, его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры гидратированного иона и меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора. При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора. Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита и его количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его размер и снижает его подвижность.Чем выше диэлектрическая проницаемость (полярность) растворителя, тем сильнее сольватируется ион; при этом увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его природы, от природы растворителя и температуры, но не зависит от природы другого иона в данном электролите.
Дата: 2019-07-30, просмотров: 623.