Электропроводность раствора характеризует не только величину удельной электропроводности (χ), но и эквивалентной (λ), которую относят к 1 молярной массе эквивалента.
Эквивалентная электропроводность представляет собой проводимость раствора, помещённого между одинаковыми электродами, расположенных на расстоянии 1 м, при этом S электрода должна быть такой, чтобы V раствора между ними содержалась молярная масса эквивалента вещества.
λ= α * V = χ * 10-3/С
V – разведение равное 10 -3
С – молярная концентрация
χ – удельная электропроводность
Разведение (V) показывает объём раствора (м3) в котором разведена 1 молярная масса эквивалента.
λ = α (λК + λА) [ λ ] = [см*м2/моль]
λ (эквивалентная электропроводность), как и χ (удельная электропроводность) зависит от природы растворителя, температуры и степени диссоциации. Механизм влияния этих факторов такой же, как и для χ.
Зависимость λ от концентрации для сильных и слабых электролитов представлена на графике:

С увеличением разбавления эквивалентная электропроводность растёт и в области разбавления раствора стремится к предельному значению λ∞.
Предельная эквивалентная электропроводность λ∞ - предельная электропроводность бесконечно разбавленного раствора характеризующееся полной диссоциацией электролита и отсутствии сил электростатического взаимодействия между ионами.
λ∞ = λ∞А + λ∞К
Предельная эквивалентная электропроводность λ∞ катионов или предельная подвижность катионов.
Величина предельной эквивалентной электропроводности λ∞ бесконечно разбавленного раствора электролита представляет собой сумму независимых величин предельных подвижностей ионов.
Из интернетов
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора Смолярная электропроводность связана следующим соотношением:
λ = 1000к/С ,Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении
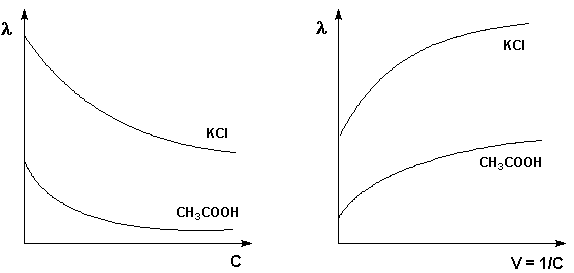
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса:
λ = α F ( U + + U - )
Дата: 2019-07-30, просмотров: 261.