Электродом, называют электронопроводящую фазу (металлы или полупроводники), контактирующую с ионным проводником (электролитом).
Электродные процессы представляют собой ОВР, протекающие на электродах. В ходе этих реакций происходит переход электронных зарядов из одной фазы в другую в результате чего на поверхности одной фазы сосредотачиваются отрицательные заряды, а на поверхности другой положительные, что что приводит к образованию двойного электрического слоя, которому соответствуют определённые скачки потенциала.
Электронопроводящая фаза, вместе с раствором или расплавом электролита образует полуэлемент. Один полуэлемент окислительный другой восстановительный. Вместе они образуют гальванический элемент.
Гальванический элемент работает за счёт окислительно-восстановительной химической реакции, вследствие которой является перенос электронов, а, следовательно, появление электрического тока.
В гальваническом элементе возникают 3 потенциала:
Контактный
Диффузионный
Электродный
Ме1 активный, а Ме2 пассивный, то Ме1 будет отдавать электроны (Ме0 1 –ne Men+1), (Mez+2 +ne Me02)
ε0 = ϕок – ϕвос + ϕкон + ϕдиф
Электродвижущая сила электрохимической цепи гальванического элемента равна алгебраической сумме скачков потенциала возникающих на границе всех фаз.
Химическим гальваническим элементом называют устройство из 2ух электродов, в котором химическая энергия превращается в электрическую. Между растворами отдельных электродов устанавливают контакт с помощью электрического мостика, заполненного насыщенным раствором KCl или NaCl. Этот мостик обеспечивает электрическую проводимость между растворами, но препятствуют их взаимной диффузии.
Электродный потенциал рассчитывается по уравнению Нернста.
Из учебника
Двойной электрический слой возникает в результате окислительно- восстановительных процессов и отражает способность материала электрода к окислению. Чем легче материал электрода окисляется, тем больше количество ионов, при прочих равных условиях, выходит из кристаллической решётки электрода в раствор и тем отрицательнее его потенциал. Поэтому потенциал электрода, измеренный в нормированных условиях, получил название окислительно- восстановительного потенциала.
Уравнение Нернста.
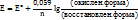
Е- стандартный электродный потенциал
n – число электронов, присоединяемых или теряемых одной частицей вещества
уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Стандартные электродные потенциалы. Стандартный водородный электрод. Измерение электродных потенциалов.
Стандартный электродный потенциал- потенциал, возникающий на границе металл/раствор при активности катионов металла в растворе 1 моль/л и температуре 298К.
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Для определения стандартного электродного потенциала(φ0), исследуемый электрод требуется поместить в раствор с активностью потенциалообразующих ионов, равной единице. Например, для экспериментального определения φ0Zn2+/Znможно воспользоваться цинковым электродом, помещённым в раствор цинка с aZnSO4 =1.Раствор водородного электрод и ячейку, заполненную раствором сульфата цинка, необходимо электрически соединить солевым мостиком. Если убрать мостик, цепь окажется разомкнутой; ток между ячейками с раствором протекать не сможет, и электрические измерения станут невозможными.
Электроды I рода. Водородный газовый электрод. Устройство водородного газового электрода. Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала водородного газового электрода.
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
(обратимость относительно тех или иных ионов означает зависимость его потенциала от концентрации данных ионов)
Газовые электроды, обратимые относительно анионов, обычно образуются при опускании инертного металла, насыщенного газом, в раствор хорошо растворимого электролита, анионом которого является восстановленная форма газа.
Примером таких электродов являются: (Pt)Cl2| HCl; (Pt)O2 | NaOH.
На их поверхности протекает реакция газ+ ze= анион. Например, в кислородном электроде: O2 + 2H2O +4e = 4OH-; в хлорном Сl2 +2e = 2Cl-. Их потенциал описывается выражением: φ=φ0+𝑅𝑇𝑧𝐹𝑅𝑇𝑙𝑛(𝑎ГАЗ𝑎АНИОН)=φ0−𝑅𝑇𝑧𝐹𝑅𝑇𝑙𝑛(𝑎АНИОН)
Газовые электроды могут быть обратимыми и относительно катиона. Типичным примером такого электрода является водородный электрод, характеризующийся реакцией: H2 -2e = 2H+
Дата: 2019-07-30, просмотров: 259.