Уравнение
Е0=  ln K
ln K
Где К- константа равновесия реакции.
Е0- стандартная ЭДС
R- универсальная газовая постоянная(8,314 Дж/моль*К)
Т-температура по Кельвину
Позволяет на основе экспериментальных данных рассчитать константу равновесия реакции, реализованной в гальваническом элементе:
K= exp (  ).
).
Билет 1
Удельная электропроводность, факторы
Классификация шкал, стеклянный электрод, схема, уравнение
Удельная электропроводность растворов сильных и слабых электролитов.
Удельная электрическая проводимость рассчитывается по формуле :

Удельная электрическая проводимость есть сила тока, создаваемая ионами, находящимися в 1 м3 раствора через площадку в м2 при напряжении в 1 вольт
В целом удельная электрическая проводимость зависит от природы электролита, природы растворителя, температуры и концентрации ионов в растворе.
Ионнообменные электроды. Стеклянный электрод. Схема записи электрода. Электродный процесс на стеклянном электроде. Уравнение Нернста для стеклянного электрода. Применение стеклянного электрода в лабораторной практике: преимущества и недостатки.
Особенность данных электродов состоит в том, что они включают такую (обычно твердую) фазу, которая избирательно высвобождает в раствор или сорбирует из него те или иные ионы. Это приводит к созданию разности потенциалов
Наиболее известным и важным является стеклянный электрод, используемый в рН-метрах. Он представляет собой хлорсеребряный электрод, заключенный в стеклянную оболочку из специального токопроводящего стекла, заканчивающуюся тонкостенным шариком. Ag| AgCl| HCl
Принцип действия основан на том,что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз силиката Na:
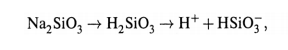
Ионы водорода частично переходят в раствор, что создает разность потенциалов (∆Ψ) между поверхностью и жидкой средой. величина ∆Ψ зависит от концентрации ионов H + в растворе.
Причем, в данном случае у нас — две поверхности: - внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода; - внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора. Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.
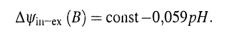

Билет 2
Релакс. и фор.эффекты
Классификация,схема записи и описание хлорсеребрянного проводника.
Дата: 2019-07-30, просмотров: 321.