Состояние энергетики и пути ее развития. Предмет и метод термодинамики. Техническая термодинамика как теоретическая база специальных теплотехнических дисциплин. Термодинамическая система и окружающая среда. Термодинамическое равновесие. Неравновесные состояния и процессы. Параметры состояния. Уравнение состояния. Термодинамическая поверхность.
Первое начало термодинамики как закон сохранения и превращения энергии. Виды энергии. Внутренняя энергия как функция состояния. Теплота и работа - формы передачи энергии. Работа, связанная с изменением объема. Внешняя работа. Энтальпия. Аналитические выражения и формулировки первого закона термодинамики.
Методические указания
При изучении темы студент должен внимательно разобраться в таких понятиях, как термодинамическая система, рабочее тело и внешняя среда, равновесное и неравновесное состояние рабочего тела, термодинамический процесс. Необходимо усвоить суть таких понятий, как равновесный и неравновесный, обратимый и необратимый термодинамические процессы; что теплота и работа представляют собой определенные формы передачи энергии - тепловую и механическую, и что они взаимопревращаемы.
Взаимное превращение теплоты и работы в тепловой машине осуществляется с помощью рабочего тела, которое, благодаря тепловому механическому воздействию, должно обладать способностью значительно изменять свой объем. Поэтому в качестве рабочего тела в тепловых машинах используется газ или пар. Усвоить, что физическое состояние рабочего тела в термодинамике определяется тремя параметрами: абсолютным давлением р, удельным объемом v и абсолютной температурой Т. Эти параметры связаны между собой уравнением состояния
f(p, v, T)=0.
Для понимания физической сути изучаемых закономерностей термодинамики и принципов работы различных теплотехнических устройств, необходимо овладеть умением графического изображения любых процессов в термодинамических диаграммах. Необходимо уяснить, что графически можно изображать только равновесные обратимые процессы.
Следует разобраться в разнице понятий «работа изменения объема» и «внешняя работа» и уметь дать графическую интерпретацию их в диаграмме p-υ.
Необходимо уяснить принципиальную разницу между внутренней энергией, однозначно определяемой данным состоянием рабочего тела, а также работой и теплотой, которые появляются лишь при наличии процесса перехода рабочего тела из одного состояния в другое, а, следовательно, зависят от характера этого процесса. [1].
Вопросы для самопроверки
1. Приведите определение термодинамической системы.
2. Что такое рабочее тело?
3. Какое число независимых параметров определяет состояние рабочего тела? Почему?
4. Какие процессы называют равновесными и какие неравновесными, обратимыми и необратимыми?
5. Какая разница между термодинамическим процессом и круговым (циклом)?
6. Что такое внутренняя энергия рабочего тела?
7. Что такое теплота и работа процесса?
8. В чем сущность первого закона термодинамики?
9. Что такое энтальпия?
Параметры идеального газа
Уравнение состояния идеального газа. Универсальная газовая постоянная. Нормальные физические условия. Смеси идеальных газов. Способы задания состава смеси. Теплоемкость идеальных газов. Истинная и средняя теплоемкости. Элементы квантовой теории теплоемкости. Внутренняя энергия и энтальпия идеальных газов:
Методические указания
Для большинства теплотехнических установок, в которых в качестве рабочего тела используют газ, он считается идеальным. Такой газ подчиняется уравнению состояния Менделеева - Клапейрона.
При изучении раздела о теплоемкостях обратить внимание на то, что теплоемкость идеального газа зависит от температуры. Студент должен уметь подсчитать теплоту с учетом зависимости теплоемкости от температуры, пользоваться таблицами средних и истинных теплоемкостей. [1, с. 4-19].
Вопросы для самопроверки
1. Что такое теплоемкость? Какие существуют теплоемкости?
2. В чем разница между средней и истинной теплоемкостями?
3. Как вычислить теплоемкость смеси идеальных газов при массовом задании смеси? При объемном (мольном) задании?
4. Как вычислить среднюю теплоемкость в интервале температур от 0 до t.
Как рассчитать теплоту процесса через средние теплоемкости от 0 до t.
6. Как определяют газовую постоянную смеси идеальных газов, заданную объемными долями?
Второе начало термодинамики
Формулировки второго начала термодинамики. Обратимые и необратимые процессы. Основные причины необратимости процессов. Термодинамические циклы: прямые и обратные, обратимые и необратимые. Термический коэффициент полезного действия цикла теплового двигателя. Прямой цикл Карно и его КПД. Обратный цикл Карно и его холодильный коэффициент. Теорема Карно. Максимальная работа цикла. Доказательство существования энтропии. Термодинамические процессы и циклы в T-s - диаграмме. Средне-интегральная температура подвода (отвода) теплоты и эквивалентный цикл Карно. Возрастание энтропии при необратимых процессах. Аналитическое выражение второго закона термодинамики для необратимых процессов. Необратимая адиабата. Теплообмен с конечной разностью температур. Возрастание энтропии изолированной системы. Статистический смысл второго начала термодинамики. Энтропия и термодинамическая вероятность состояния.
Эксергия как мера работоспособности системы. Эксергия массы вещества в объеме, потока тепла и потока вещества. Потеря эксергии при необратимых процессах. Эксергетический КПД. Энтропийный метод расчета потерь энергии необратимых процессов.
Методические указания
Первые начало  термодинамики указывает лишь на количественную сторону взаимопревращения теплоты и работы, но он не отвечает на вопрос: каковы условия взаимного перехода различных видов энергии? Опыт показывает, что в теплоту любой вид энергии может переходить самопроизвольно, а преобразование в замкнутом процессе теплоты целиком в работу невозможно. Действительно, проинтегрировав выражение
термодинамики указывает лишь на количественную сторону взаимопревращения теплоты и работы, но он не отвечает на вопрос: каковы условия взаимного перехода различных видов энергии? Опыт показывает, что в теплоту любой вид энергии может переходить самопроизвольно, а преобразование в замкнутом процессе теплоты целиком в работу невозможно. Действительно, проинтегрировав выражение
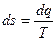

по замкнутому контуру, получим
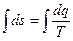
Но так как 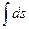 = 0, поскольку s - функция сстояния, то
= 0, поскольку s - функция сстояния, то
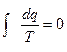
Учитывая, что  , тогда и только тогда, когда q на отдельных участках цикла меньше нуля, т. е. наряду с подводом теплоты в цикле должны быть процессы и с отводом теплоты. Но это и означает, что полностью подведенную теплоту в цикле нельзя превратить в работу.
, тогда и только тогда, когда q на отдельных участках цикла меньше нуля, т. е. наряду с подводом теплоты в цикле должны быть процессы и с отводом теплоты. Но это и означает, что полностью подведенную теплоту в цикле нельзя превратить в работу.
Все самопроизвольные процессы в природе односторонни: вода сама по себе течет лишь с гор на равнины, электрический ток распространяется по проводу от большего потенциала к меньшему, теплота передается от горячего тела к холодному. Можно, конечно, заставить протекать эти процессы в обратном направлении, но для этого необходима компенсация. В тепловом двигателе, в котором происходит несамопроизвольный процесс превращения теплоты в работу, компенсирующим самопроизвольным процессом является переход теплоты от теплоотдатчика к теплоприемнику. В холодильных машинах переход теплоты от холодного тела к горячему компенсируется затратой работы. Термический КПД любого цикла можно выразить через средне -интегральные температуры процессов подвода и отвода теплоты Т/ и Т// в виде
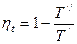
Эта формулировка показывает, что при выбранных минимальной и максимальной температурах холодильника и источника теплоты наивысшее значение 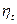 достигается, когда
достигается, когда 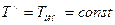 и
и 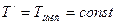 , т. е. при изотермическом подводе и отводе теплоты. Такой цикл (цикл Карно) имеет первостепенное значение в термодинамике, являясь, по существу, выражением второго закона термодинамики. При изучении второго закона термодинамики студент встречается с функцией состояния - энтропией. Изменение энтропии рабочего тела в элементарном процессе определяется по формуле
, т. е. при изотермическом подводе и отводе теплоты. Такой цикл (цикл Карно) имеет первостепенное значение в термодинамике, являясь, по существу, выражением второго закона термодинамики. При изучении второго закона термодинамики студент встречается с функцией состояния - энтропией. Изменение энтропии рабочего тела в элементарном процессе определяется по формуле
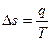 ,
,
где q - количество теплоты, участвующего в процессе; Т - абсолютная температура рабочего тела. Из формулы следует, что так как всегда Т>0, то знак 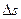 совпадает со знаком q: при подводе теплоты (q>0) энтропия тела возрастает (
совпадает со знаком q: при подводе теплоты (q>0) энтропия тела возрастает ( 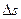 >0), а при отводе (q<0) - убывает (
>0), а при отводе (q<0) - убывает ( 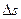 <0).
<0).
Рассмотрим изменение энтропии простейшей системы, состоящей из источника теплоты с температурой Ти и газа с температурой Тг. Изменение энтропии такой системы запишется в виде
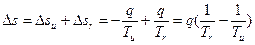
Для обратимых процессов Тг= 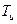 , очевидно
, очевидно 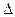 s=0. Если рассматривается система, состоящая из холодильника с температурой Тх и газа с температурой Тг, то получаем
s=0. Если рассматривается система, состоящая из холодильника с температурой Тх и газа с температурой Тг, то получаем
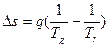 и
и 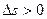
где знак > относится к необратимым процессам. Таким образом, если для отдельного тела энтропия может увеличиваться (при q›0), уменьшаться (при q<0) или оставаться без изменения (при q=0), то для изолированной системы она может или расти (необратимый процесс), или оставаться постоянной (обратимый процесс). Важно усвоить, что рост энтропии изолированной системы связан с неизбежным уменьшением ее работоспособности. Максимально возможная работа, которую можно получить за счет теплоты, если холодильником является окружающая среда, называется эксергией этой теплоты. Введение понятия эксергии теплоты дает возможность количественно оценить потерю работоспособности за счет необратимости процессов. Разность между подводимой к системе эксергией и отводимой от нее характеризует потери эксергии. Поэтому степень необратимости процессов можно характеризовать эксергетическим КПД
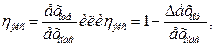 где ехпод, ехотв, - подводимая и отводимая эксергия, ∆ехподв- ехотв потеря эксергии.
где ехпод, ехотв, - подводимая и отводимая эксергия, ∆ехподв- ехотв потеря эксергии.
Применимость второго закона термодинамики ограничена земным опытом. Распространение его на Вселенную, как сделал Клаузиус, приводит к неправильным выводам. Клаузиус, рассматривая Вселенную как изолированную систему, в которой все процессы необратимы, сделал вывод, что «энтропия Вселенной стремится к максимуму», и отсюда, как следствие –«тепловая смерть Вселенной». Несостоятельность теории Клаузиуса «тепловой смерти» Вселенной имеет также и другое обоснования:
а) дифференциальные соотношения термодинамики несправедливы для микромира, в котором расстояния между частицами материи сравнимы с дифференциалом исследуемого объема;
б) решения дифференциальных уравнений зависят от конкретных условий на границе исследуемой области, но на границе бесконечной Вселенной эти условия неизвестны.
Вопросы для самопроверки
1. Что такое термодинамический цикл?
2. В чем состоят термическая и механическая необратимости процессов?
3. Что такое эксергия?
4. Что такое прямой и обратный циклы Карно?
5. Что называется термическим КПД и холодильным коэффициентом произвольного цикла? Чему они равны для цикла Карно?
6. Почему обратный цикл Карно является самым эффективным среди других циклов, осуществляемых в заданном интервале температур?
7. В чем сущность второго закона термодинамики?
8. Приведите аналитическое выражение второго закона термодинамики для обратимых и необратимых процессов.
9. Как изменяется энтропия изолированной системы при протекании в ней обратимых и необратимых процессов?
Дата: 2016-10-02, просмотров: 354.