Прежде чем приступить к анализу сухого образца или раствора, следует провести визуальные наблюдения, отметив его цвет, однородность и т.д. После этого проводят предварительные испытания. В случае раствора определяют значение рН. Если образец сухой, его переводят в раствор. Анализ начинают с проведения дробных реакций.
Приступая к систематическому анализу по выбранной схеме (она должна быть записана в журнале), берут в работу не более половины полученного раствора, чтобы иметь возможность при необходимости повторить анализ.
Все разделения на основе осаждения должны быть проведены очень тщательно, с соблюдением указанных в методике условий и контролем полноты осаждения.Отделенные от раствора осадки перед растворением для дальнейшего анализа надо промыть, а промывные воды соединить с центрифугатом. Если центрифугат или раствор, получившийся после растворения осадка, разбавлены, их можно сконцентрировать упариванием.
На каждой стадии разделения смеси на группы и подгруппы, как и в начале анализа, рекомендуется брать для дальнейшей работы не весь получившийся раствор, а часть, оставляя порцию на случай повторной работы. Это позволит значительно сэкономить время при проверке анализа, так как исключит трудоемкие этапы разделений. Обнаружение ионов желательно подтвердить несколькими аналитическими реакциями.
Лабораторная работа № 1
Анализ смеси катионов I и II групп
Цель работы: провести качественный анализ раствора, в котором возможно присутствие ионов NH4+, K+, Na+, Mg2+, Ca2+, Ba2+.
Подготовка к выполнению работы и проведение анализа.
1. Ознакомиться с техникой выполнения основных операций (с. 6–10);
2. Изучить основные аналитические реакции указанных ионов, используя растворы их солей;
3. Ознакомиться с рекомендациями к выполнению контрольных анализов (с. 10);
4. Получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа
 | |||
 | |||
рН > 7 рН ≤ 7
|
нет
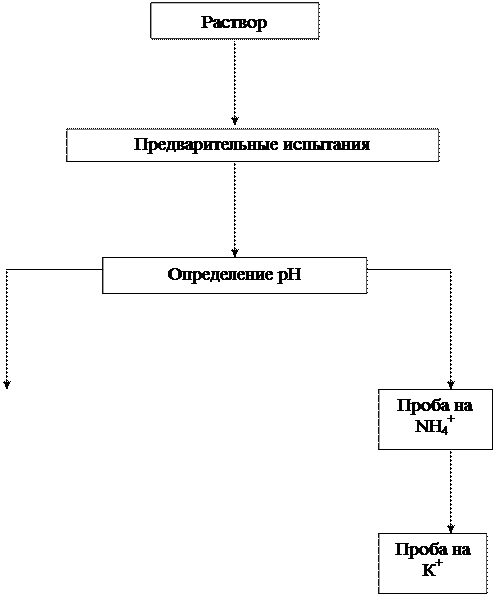
Рис. 1. Схема предварительных испытаний смеси
катионов I и II групп
 |
нет
да
Осадок Раствор
нет
да
нет
нет да
да
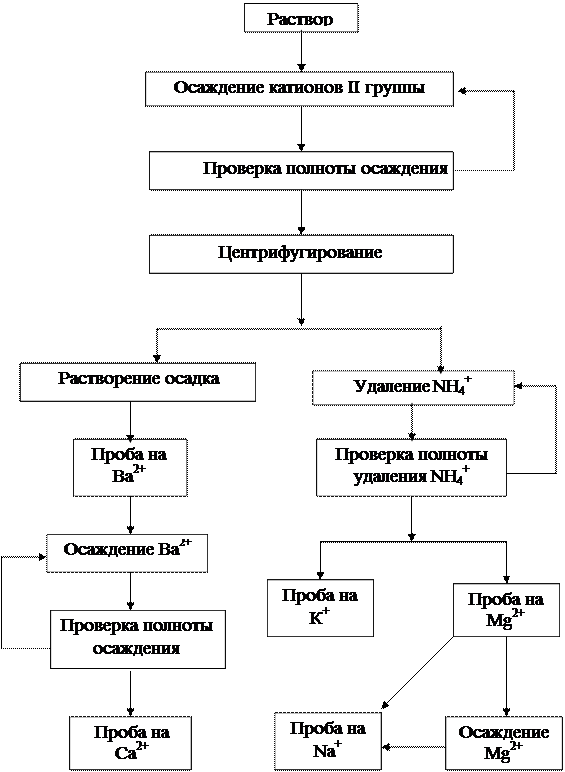
Рис. 2. Схема анализа смеси катионов I и II групп
(рис. 1, 2) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец – табл. 3).
Анализируемый раствор делят на три части: с одной проводят предварительные испытания, другую подвергают систематическому анализу, третью оставляют для проверки полученных результатов.
Предварительные испытания
(проводятся с отдельными порциями исследуемого раствора)
1.1. Реакция среды.Определяют рН раствора с помощью универсальной индикаторной бумаги.
1.2. Обнаружение ионов NH4+. Определение проводят, действуя на исследуемый раствор раствором щелочи NaOH или КОН при нагревании:
NH4+ + OH- ® NH3 + H2O
Определение проводят в «газовой камере», состоящей из двух часовых стекол одинакового размера. На нижнее стекло помещают
1–2 капли анализируемого раствора, 1–2 капли 2 н. раствора NaOH и накрывают другим стеклом, на вогнутую поверхность которого прикреплен кусочек влажной индикаторной бумаги. Для ускорения реакции камеру слегка нагревают на водяной бане. Посинение индикаторной бумаги свидетельствует о наличии в растворе ионов NH4+.
1.3. Проба на присутствие ионов К+(выполняется только в случае отсутствия ионов NH4+). Если проба 1.2 дала отрицательный результат, на предметное стекло помещают каплю исследуемого раствора и нагревают его на плитке до появления каемочки сухой соли.

Рис. 3. Кристаллы K2PbCu(NO2)6
На некотором расстоянии от нее наносят каплю Na2PbCu(NO2)6 (реактив для обнаружения ионов К+). Реактив осторожно подводят к сухой каемочке соли и через 2–3 мин рассматривают выпавшие кристаллы под микроскопом. Форма кристаллов показана на рис. 3.
Если в растворе присутствуют ионы К+, то образуются кубические кристаллы К2PbCu(NO2)6 черного или коричневого цвета. Ионы NH4+ образуют такие же кристаллы и поэтому мешают реакции. При выполнении этой реакции полезно провести холостой опыт (см. с. 10).
Систематический ход анализа
Дата: 2016-10-02, просмотров: 350.