Методические указания к лабораторным занятиям
по дисциплинам «Аналитическая химия»
И «Аналитическая химия и физико-химические
методы анализа» для студентов
Химико-технологических специальностей
Минск 2002
УДК 543
Рассмотрены и рекомендованы к изданию редакционно-издательским советом университета.
| Составители: А. Е. Соколовский, | |
| Н. А. Коваленко, Н. Ф. Поповская, | |
| Е. В. Радион | |
| Под редакцией канд. хим. наук Е. В. Радион | |
| Рецензент доцент кафедры общей и неорганической химии Т. Л. Залевская |
По тематическому плану изданий учебно-методической литературы университета на 2002 год. Поз.7.
Для студентов химико-технологических специальностей.
| © Учреждение образования «Белорусский государственный технологический университет», | |
| © Соколовский А. Е., Коваленко Н. А., Поповская Н. Ф., Радион Е. В., составление, 2002 |
ВВЕДЕНИЕ
Главным содержанием всех химико-аналитических работ являются разделение компонентов анализируемого вещества и выделение их, идентификация компонентов анализируемого вещества и количественное определение компонентов. Идентификациякомпонентов – задача качественного анализа, количественное их определение – задача количественного анализа. Разделениекомпонентов необходимо для обоих видов анализа.
В соответствии с этим курс аналитической химии условно делится на 2 больших раздела – «Методы обнаружения и разделения элементов (качественный анализ)» и «Методы количественного определения элементов (количественный анализ)».
Изучение основ качественного анализа имеет целью закрепить знание теоретических основ аналитической химии; изучить качественные реакции катионов и анионов, выявляющих сходство и различие их химико-аналитических свойств; освоить методы анализа смесей катионов и анионов (разделение и идентификация).
Качественный анализ неорганических веществ включает анализ катионов и анализ анионов и предусматривает подразделение их на группы. Аналитическую группу составляют сходные по химико-аналитическим свойствам ионы. Сходство химико-аналитических свойств ионов характеризуется главным образом общими реакциями, а различие – частными реакциями. При изучении аналитической химии необходимо прежде всего знать сходство и различие свойств ионов, которые позволяет предвидеть Периодический закон Д.И.Менделеева.
В основу классификации ионов в аналитической химии положено различие в растворимости образуемых ими соединений. При систематическом ходе анализа ионы выделяют из сложной смеси не поодиночке, а целыми группами, пользуясь одинаковым отношением их к действию некоторых реагентов, называемых групповыми реагентами. Классификация катионов и анионов приведена в табл. 1 и 2.
В химическом анализе используют все типы химических реакций. Каждую реакцию и операцию необходимо осуществлять при вполне определенных условиях, благоприятствующих им и препятствующих протеканию нежелательных процессов (коллоидообразование, соосаждение, гидролиз и т.п.).
Направление и полнота протекания химических процессов в растворах зависят от условий, при которых они осуществляются (концентрация реагирующих веществ, температура, рН среды, катализаторы, время и т.д.). Скорость протекания химических реакций зависит от концентрации реагирующих веществ в растворе, температуры и др. факторов. Растворимость веществ, константы диссоциации слабых электролитов зависят от температуры и от природы электролита.
Таблица 1
Классификация катионов
| I группа | II группа | III группа | IV группа | V группа |
| K+, Na+, NH4+, Mg2+ и др. | Ba2+, Sr2+, Ca2+ и др. | Al3+, Cr3+, Fe3+, Fe2+, Mn2+, Zn2+, Co2+, Ni2+ | Cu2+, Cd2+, Bi3+, Hg2+, AsV, AsIII, SbV, SbIII, SnIV, SnII и др. | Ag+, Hg22+, Pb2+ |
| Группового реагента не имеют | Групповой реагент – (NH4)2CO3 | Групповой реагент – (NH4)2S | Групповой реагент – H2S(в присутствии HCl) | Групповой реагент – HCl |
| Сульфиды растворимы в воде | Сульфиды не растворимы в воде (или вместо них образуются нерастворимые в воде гидроксиды) | |||
| Карбонаты растворимы в воде | Карбонаты не растворимы в воде | Сульфиды (или гидроксиды) растворимы в разбавленных кислотах | Сульфиды не растворимы в разбавленных кислотах |
Таблица 2
Классификация анионов
| № гр. | Характеристика группы | Анионы, образующие группу | Групповой реагент |
| I | Соли бария малорастворимы в воде | SO42-, S2O32-, SO32-, CO32-, PO43-, CrO42-, Cr2O72-, F-, C2O42- | BaCl2 (при рН»7–9) |
| II | Соли серебра малорастворимы в воде и разбавленной HNO3 | Cl-, Br-, I-, SCN-, [Fe(CN)6]4-, [Fe(CN)6]3- | AgNO3 (в присут-ствии 2 н. HNO3) |
| IIII | Соли бария и серебра растворимы в воде | NO3-, NO2-, ClO4-, CH3COO-, MnO4- и др. | Группового реагента нет |
ОРГАНИЗАЦИЯ ЗАНЯТИЙ ПО КАЧЕСТВЕННОМУ
АНАЛИЗУ
Изучение методов обнаружения и разделения элементов начинается с ознакомления с основными аналитическими реакциями ионов, поэтому при выполнении лабораторных работ Вы должны:
1. Самостоятельно и индивидуально выполнить описанные в методических указаниях (или учебных пособиях) реакции обнаружения соответствующих катионов и анионов: пробирочные, капельные, микрокристаллоскопические;
2. Провести контрольные анализы образцов, в состав которых входят соединения изученных элементов (растворы, сухие смеси и т.п.).
Вся работа в практикуме фиксируется в лабораторном журнале. В табл. 3 приведены образцы записей в лабораторном журнале при изучении аналитических реакций ионов и выполнении контрольных анализов. Эта таблица составляется на развернутом листе тетради. Во всех случаях необходимо отмечать внешний эффект реакции.
Таблица 3
Образцы записей
| Ион | Реагент, условия проведения реакции | Аналитическая реакция | Аналитический эффект |
| Ba2+ | K2Cr2О7 в присутствии ацетатного буфера при нагревании | 2Ba2+ + K2Cr2О7 + H2O ® 2BaCrО4¯ + 2K+ + 2H+ | Выпал желтый кристаллический осадок |
ПОСУДА И РАБОЧЕЕ МЕСТО
При изучении пробирочных реакций обнаружения и разделения элементов используется полумикрометод, а при выполнении микрокристаллоскопических и капельных реакций – микрометод анализа. Это требует чистоты рабочего места, используемой посуды, реагентов, а также внимания и аккуратности в работе.
Всю используемую в работе посуду следует тщательно вымыть с помощью ерша содовым раствором, сполоснуть несколько раз водопроводной, а затем 2 раза дистиллированной водой. В табл. 4 приведен перечень наименований химической посуды, которая используется для выполнения практикума.
Таблица 4
Лабораторная работа № 1
Подготовка к выполнению работы и проведение анализа.
1. Ознакомиться с техникой выполнения основных операций (с. 6–10);
2. Изучить основные аналитические реакции указанных ионов, используя растворы их солей;
3. Ознакомиться с рекомендациями к выполнению контрольных анализов (с. 10);
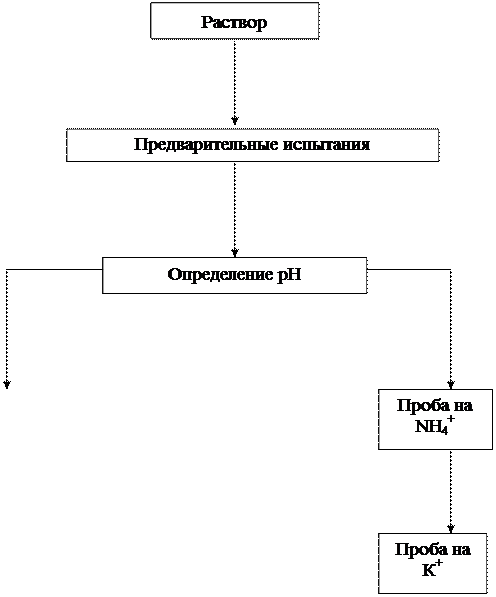
4. Получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа
 | |||
 | |||
рН > 7 рН ≤ 7
|
нет
Рис. 1. Схема предварительных испытаний смеси
катионов I и II групп
 |
нет
да
Осадок Раствор
нет
да
нет
нет да
да
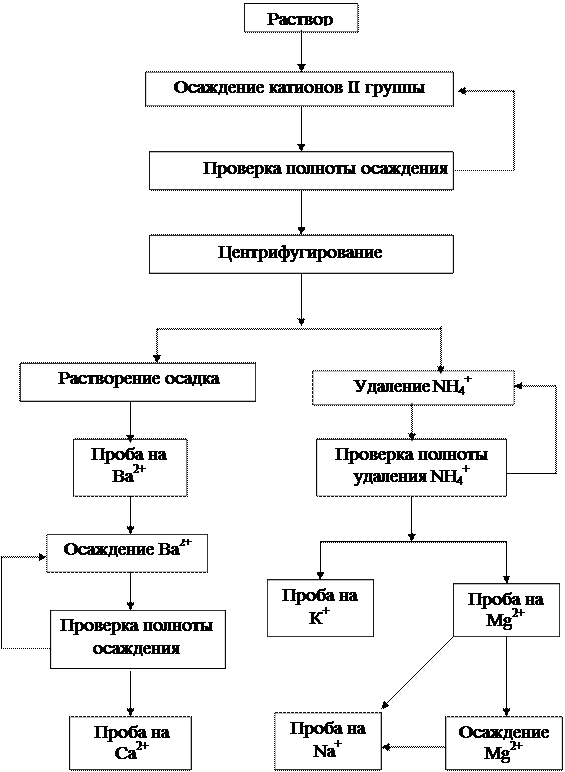
Рис. 2. Схема анализа смеси катионов I и II групп
(рис. 1, 2) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец – табл. 3).
Анализируемый раствор делят на три части: с одной проводят предварительные испытания, другую подвергают систематическому анализу, третью оставляют для проверки полученных результатов.
Предварительные испытания
(проводятся с отдельными порциями исследуемого раствора)
1.1. Реакция среды.Определяют рН раствора с помощью универсальной индикаторной бумаги.
1.2. Обнаружение ионов NH4+. Определение проводят, действуя на исследуемый раствор раствором щелочи NaOH или КОН при нагревании:
NH4+ + OH- ® NH3 + H2O
Определение проводят в «газовой камере», состоящей из двух часовых стекол одинакового размера. На нижнее стекло помещают
1–2 капли анализируемого раствора, 1–2 капли 2 н. раствора NaOH и накрывают другим стеклом, на вогнутую поверхность которого прикреплен кусочек влажной индикаторной бумаги. Для ускорения реакции камеру слегка нагревают на водяной бане. Посинение индикаторной бумаги свидетельствует о наличии в растворе ионов NH4+.
1.3. Проба на присутствие ионов К+(выполняется только в случае отсутствия ионов NH4+). Если проба 1.2 дала отрицательный результат, на предметное стекло помещают каплю исследуемого раствора и нагревают его на плитке до появления каемочки сухой соли.

Рис. 3. Кристаллы K2PbCu(NO2)6
На некотором расстоянии от нее наносят каплю Na2PbCu(NO2)6 (реактив для обнаружения ионов К+). Реактив осторожно подводят к сухой каемочке соли и через 2–3 мин рассматривают выпавшие кристаллы под микроскопом. Форма кристаллов показана на рис. 3.
Если в растворе присутствуют ионы К+, то образуются кубические кристаллы К2PbCu(NO2)6 черного или коричневого цвета. Ионы NH4+ образуют такие же кристаллы и поэтому мешают реакции. При выполнении этой реакции полезно провести холостой опыт (см. с. 10).
Систематический ход анализа
Анализ фильтрата
2.2.1. Удаление ионов NH4+.Фильтрат переносят в фарфоровый тигель, выпаривают досуха и прокаливают на плитке до полного разложения аммонийных солей. Когда прекратится выделение белого дыма, в тигель (после полного остывания!) добавляют несколько капель дистиллированной воды для растворения сухого остатка. Каплю полученного раствора переносят на часовое стекло и добавляют 1–2 капли реактива Несслера. При действии его на растворы, содержащие ионы NH4+, образуется красно-бурый осадок:
NH3 + 2K2[HgI4] + 3KOH ® HN-Hg2IOH¯ + 7KI + 2H2O
Таким способом проверяют полноту удаления ионов NH4+.
2.2.2. Обнаружение ионов К+. 1–2 капли раствора, полученного по п.2.2.1, переносят на предметное стекло и анализируют аналогично п.1.3.
2.2.3. Обнаружение ионов Мg2+. К отдельной порции раствора (2–3 капли), полученного по п.2.2.1, добавляют несколько капель 2 н. раствора КОН. Содержимое пробирки нагревают на водяной бане. Образование белого аморфного осадка указывает на присутствие ионов Мg2+.
2.2.4. Обнаружение ионов Na+ ведут различно в зависимости от присутствия или отсутствия в исследуемом растворе ионов Мg2+.
Ионы Мg2+ отсутствуют. Порцию исследуемого раствора, не содержащего ионов Мg2+ и NH4+, выпаривают досуха в фарфоровой чашке. На предметное стекло наносят каплю раствора KH2SbO4 и вносят в нее несколько крупинок сухого остатка. Если ионы Na+ присутствуют, под микроскопом отчетливо видны прозрачные кристаллы зернообразной формы (рис. 4).
 |
Рис. 4. Кристаллы NaH2SbO4
При выполнении этой реакции необходимо провести холостой опыт, т.к. в растворе самого реактива практически всегда под микроскопом заметны кристаллы. Они имеют другую форму, которая отличается от приведенной на рис. 4.
По выбору студента эту реакцию можно выполнять как пробирочную. В этом случае в пробирку наливают 2–3 капли исследуемого раствора. Затем создают строго нейтральную среду, добавляя кислоту или щелочь до рН=7 (по индикаторной бумаге). К полученному раствору прибавляют равный объем раствора реактива KH2SbO4 и перемешивают стеклянной палочкой. Образование белого кристаллического осадка свидетельствует о наличии в растворе ионов Na+. (Необходимо убедиться в том, что осадок кристаллический!). Если осадок не выпадает, надо потереть палочкой о стенки пробирки и охладить ее содержимое.
Ионы Мg2+ присутствуют. Исследуемый раствор, полученный по п.2.2.1, обрабатывают при нагревании 2 н. раствором КОН и, проверив полноту осаждения, центрифугируют. Фильтрат нейтрализуют 2 н. раствором НСl (избыток кислоты недопустим из-за разложения KH2SbO4 в кислой среде) и выпаривают досуха. Сухой остаток растворяют в небольшом количестве воды. В полученном растворе обнаруживают ионы Na+ микрокристаллоскопической реакцией с KH2SbO4.
Анализ осадка
2.3.1. Растворение осадка. Осадок карбонатов растворяют в
8-10 каплях 2 н. уксусной кислоты.
2.3.2. Обнаружение ионов Ва2+.К отдельной порции уксуснокислого раствора, полученного по п.2.3.1, нагретой до кипения, добавляют несколько капель K2Cr2O7 и CH3COONa. Раствор K2Cr2O7 добавляют до изменения желтого цвета анализируемого раствора на оранжевый. После охлаждения в раствор над осадком добавляют еще несколько капель K2Cr2O7, проверяя таким образом полноту осаждения ионов Ва2+:
2Ва2+ + K2Cr2O7 + Н2О ® 2ВаCrО4¯ + 2К+ + 2Н+
После полного осаждения ионов Ва2+ осадок ВаCrО4 отделяют центрифугированием. Фильтрат используют для обнаружения ионов Са2+.
2.3.3. Обнаружение ионов Са2+.К фильтрату, полученному по п.2.3.2, добавляют 4-5 капель раствора (NH4)2C2O4 и нагревают содержимое пробирки на водяной бане. Выпадение белого кристаллического осадка СаС2О4 указывает на присутствие ионов Са2+.
Если ионы Ва2+ в анализируемом растворе не обнаружены, наличие ионов Са2+ лучше проверить в свежей порции уксуснокислого раствора, полученного по п.2.3.1.
Вопросы к лабораторной работе
1. Аналитические группы катионов.
2. Общая характеристика катионов I группы.
3. Методы разложения и удаления солей аммония.
4. Аналитические реакции ионов К+, Na+, NH4+.
5. Систематический ход анализа катионов I группы.
6. Общая характеристика катионов II группы.
7. Действие группового реагента, роль NH4OH и NH4Cl при осаждении катионов II группы. Обосновать условия проведения осаждения (значение рН, температура).
8. Характерные и специфические реакции катионов Ba2+ и Ca2+.
9. Систематический ход анализа катионов I-II групп.
Лабораторная работа № 2
Подготовка к выполнению работы и проведение анализа.
1. Повторить технику выполнения основных операций (с. 6–10);
2. Изучить основные аналитические реакции указанных ионов, используя растворы их солей;
3. Ознакомиться с рекомендациями к выполнению контрольных анализов (с. 10);
4. После этого получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа (рис. 5) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец – табл. 3).
Анализируемый раствор делят на три части: в одной проводят предварительные испытания, другую подвергают систематическому анализу, третью оставляют для проверки полученных результатов.
Предварительные испытания
(проводятся с отдельными порциями исследуемого раствора)
1.1. Проба на присутствие ионов Fe2+. Ион Fe2+ открывают первым, так как он легко окисляется кислородом воздуха до Fe3+. Небольшую порцию раствора подкисляют 2 н. НСl и приливают к ней 1-2 капли раствора K3[Fe(CN)6], стараясь не перемешивать содержимое пробирки. Выпадение синего осадка Fe3[Fe(CN)6]2 свидетельствует о наличии иона Fe2+. Следует иметь ввиду, что в присутствии катионов III группы осадок будет несколько менее синим.

Рис. 5. Схема анализа смеси катионов III группы
1.2. Проба на присутствие ионов Fe3+. К отдельной порции исследуемого раствора, подкисленной 2 н. HCl, прибавляют несколько капель раствора K4[Fe(CN)6]. Выпадение синего осадка Fe4[Fe(CN)6]3 свидетельствует о наличии иона Fe3+. Присутствие катионов III группы несколько изменяет темно-синий цвет осадка.
1.3. Проба на присутствие ионов Zn2+.1–2 капли раствора помещают на полоску фильтровальной бумаги, смоченную раствором дитизона. Появление характерного малиново-красного окрашивания свидетельствует о присутствии ионов Zn2+.
Систематический ход анализа
Анализ фильтрата
2.2.1. Обнаружение ионов хрома.Желтая окраскараствора указывает на присутствие ионов CrO42-. Концом капилляра, содержащего исследуемый раствор, прикасаются к полоске фильтровальной бумаги и оставляют в таком положении несколько секунд. Полученное влажное пятно обводят по периферии капилляром с раствором бензидина. Если в исследуемом растворе присутствует CrO42-, то по краям пятна появится синее кольцо.
2.2.1. Обнаружение ионов алюминия.1–2 капли исследуемого раствора наносят на полоску фильтровальной бумаги, затем помещают на это пятно 1 каплю 2 н. HCl. Через несколько секунд пятно обрабатывают ализарином и помещают полоску над емкостью с концентрированным раствором NH4OH. В присутствии ионов алюминия пятно окрашивается в розовый цвет, характерный для алюминиевого лака. Если алюминий в растворе отсутствует, то пятно окрасится в фиолетовый цвет, характерный для ализарина в щелочной среде.
Анализ осадка
Обнаружение ионов марганца.
Ионы железа отсутствуют. Если в предварительных испытаниях обнаружено, что ионы железа в исследуемом растворе отсутствуют, то к осадку после центрифугирования осторожно, по стенке пробирки пипеткой вводят 2 н. раствор Н2С2О4. В присутствии ионов марганца образуется малиново-розовое комплексное соединение марганца H[Mn(C2O4)2]. Образующееся соединение неустойчиво, поэтому раствор перемешивать не следует.
Ионы железа присутствуют. К исследуемому осадку предварительно добавляют несколько кристалликов NaF, а затем вводят Н2С2О4 до появления малиново-розового окрашивания, характерного для ионов марганца.
Вопросы к лабораторной работе
1. Общая характеристика катионов III группы.
2. Теоретические основы осаждения сульфидов.
3. Действие группового реагента, роль NH4OH и NH4Cl при осаждении катионов III группы.
4. Характерные и специфические реакции катионов Al3+, Cr3+, Fe2+, Fe3+, Mn2+, Zn2+.
Лабораторная работа № 3
Анализ смеси анионов
Цель работы: провести качественный анализ раствора, в котором возможно присутствие анионов I, II и III аналитических групп.
В противоположность катионам, анионы в большинстве случаев не мешают обнаружению друг друга, поэтому ихоткрывают дробным методом, т.е. в отдельных порциях исследуемого раствора. В соответствии с этим при анализе анионов групповые реагенты применяют обычно не для разделения групп, а лишь для того, чтобы установить их наличие или отсутствие. Если установлено отсутствие анионов всей группы, то не следует проводить реакции на отдельные анионы. В этом смысле проведение групповых реакций значительно облегчает работу и экономит время. Существуют некоторые смеси анионов, для определения состава которых необходимо проведение систематического анализа.
Поскольку в данной работе Вы познакомитесь лишь с элементами качественного анализа анионов, то задача на смесь анионов будет включать не все, а некоторые анионы I, II и III аналитических групп: SO42–, CO32–, PO43–, Cl–, I–, NO2–, NO3–.
Подготовка к выполнению работы и проведение анализа.
1. Повторить технику выполнения основных операций (с. 6–10);
2. Изучить основные аналитические реакции указанных анионов, используя растворы их солей;
3. Ознакомиться с рекомендациями к выполнению контрольных анализов (с. 10);
4. После этого получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа (рис. 6) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец – табл. 3).
Предварительные испытания
1.1. Испытание реакции исследуемого раствора.Если реакция исследуемого раствора кислая (рН=2), то внем не могут присутствовать анионы летучих и неустойчивых кислот, т.е. CO32-.
1.2. Проба на анионы I группы. К 2 каплям нейтрального или слабощелочного раствора (рН=7–8) добавляют 2–3 капли раствора BaCl2. Образование осадка указывает на присутствие анионов I группы. Кислые растворы необходимо предварительно нейтрализовать раствором Ba(OH)2.
1.3. Проба на анионы II группы. К 2–3 каплям исследуемого раствора прибавляют 2–3 капли AgNO3. При этом может образоваться осадок. К нему прибавляют несколько капель HNO3. Если осадок не растворяется в азотной кислоте, то это указывает на присутствие анионов II группы.
1.4. Проба на выделение газов. Несколько капель исследуемого раствора (лучше крупинку твердого вещества) обрабатывают 2 н. раствором серной кислоты и слегка встряхивают пробирку, осторожно

да нет
нет
да
Рис.6. Схема анализа смеси анионов
постукивая по ее нижней части. Образование газа указывает на возможность присутствия CO32– или NO2–.
Открытие анионов I группы
Если предварительные испытания показали наличие анионов I группы, то проводят их осаждение из отдельной порции раствора объемом 1–2 мл, как описано в п.1.2. Затем осадок отделяют от раствора центрифугированием и проверяют полноту осаждения.
2.1. Обнаружение сульфат-ионов. Если осадок, полученный по п.1.2, нерастворим в разбавленной соляной кислоте, то это указывает на присутствие сульфат-ионов.
2.2. Обнаружение карбонат-ионов. Если растворение осадка, полученного по п.1.2, в разбавленной соляной кислоте сопровождается выделением пузырьков газа, то следует проверить присутствие карбонат-ионов по помутнению раствора Ba(OH)2. Реакцию проводят в специальном приборчике, представляющем собой пробирку, плотно закрытую пробкой с отверстием, в которое вставляется отводная трубка. На дно пробирки помещается анализируемый раствор или твердое вещество, сюда же добавляют 2 н. раствор соляной кислоты, после чего пробирку плотно закрывают пробкой. Отводную трубочку быстро опускают в пробирку с раствором Ba(OH)2. В случае выделения CO2 баритовая вода мутнеет вследствие образования BaCO3.
2.3. Обнаружение фосфат-ионов. Осадок, полученный по п.2.1, отмывают дистиллированной водой от хлорид-ионов (см. с.8). Качественная реакция на них должна быть отрицательной. После этого осадок растворяют в минимальном объеме 2 н. азотной кислоты. Избыточную азотную кислоту нейтрализуют 2 н. раствором NaOH или КОН до значения рН»7 (по универсальной индикаторной бумаге). К полученному раствору добавляют несколько капель раствора AgNO3. Выпадение желтого осадка Ag3PO4 указывает на присутствие в анализируемом растворе фосфат-иона. Осадок Ag3PO4 обладает свойством растворяться в 2 н. растворе HNO3, а также в NH4OH. Для убедительности следует провести такие испытания.
Открытие анионов II группы
3.1. Обнаружение хлорид-ионов. К отдельной порции анализируемого раствора добавляют несколько капель 2 н. HNO3 до кислой реакции и несколько капель AgNO3. Образовавшийся осадок отделяют от раствора центрифугированием, промывают (см. с. 8), после чего к нему добавляют 25 %-ный раствор NH4OH. Тщательно перемешивают содержимое пробирки стеклянной палочкой. Нерастворившийся осадок отделяют центрифугированием. К центрифугату добавляют 3–4 капли раствора KBr. Появление обильной мутиAgBr указывает на присутствие в исследуемом растворе хлорид-ионов. При обнаружении хлорид-ионов протекают следующие реакции:
Cl- + Ag+ = AgCl↓
AgCl↓ + 2NH4OH = [Ag(NH3)2]Сl + 2H2O
[Ag(NH3)2]Сl + KBr + 2HNO3 = AgBr↓ +KCl +2NH4NO3
3.2. Обнаружение иодид-ионов.К отдельной порции анализируемого раствора прибавляют 2–3 капли 2 н. раствора серной кислоты и несколько капель бензола или хлороформа. Затем в эту же пробирку по одной капле добавляют хлорную воду, каждый раз хорошо взбалтывая ее содержимое. При наличии в растворе иодид-ионов идет реакция
2I– + Cl2 = I2 + 2Cl–,
которая сопровождается появлением характерной для I2 фиолетовой окраски бензольного или хлороформного слоя. При дальнейшем прибавлении хлорной воды окраска исчезает вследствие окисления I2 до иодноватой кислоты:
I2 + 5Cl2 + 6H2О = 2HIO3 + 10HCl
Открытие анионов III группы
4.1. Обнаружение нитрит-ионов. Обнаружению нитрит-ионов мешают ионы-окислители. Анионы-восстановители (I–) могут находиться в растворе вместе с нитрит-ионами только при pН≥7.
Нитрит-ионы обнаруживают в отдельной порции раствора с помощью раствора Грисса-Илосвая (α-нафтиламин+сульфаниловая кислота). При выполнении этой реакции к капле нейтрального или уксусно-кислого раствора на капельной пластинке (или на часовом стекле) прибавляют по одной капле реактива Грисса-Илосвая. В присутствии NO2– тотчас или спустя некоторое время (в зависимости от количества нитрит-иона) появляется характерная красная окраска.
Кроме того, нитрит-ионы можно обнаружить, используя следующую реакцию:
2NO2– + 2I– + 4H+ = I2 + 2NO + 2H2O.
К 2–3 каплям анализируемого раствора добавляют 1–2 капли
2 М HCl или CH3COOH и 2–3 капли раствора KI. Раствор буреет вследствие выделения I2. При добавлении 1–2 капель крахмала появляется темно-синяя окраска.
По выбору студента эту реакцию можно выполнить как капельную. На фильтровальную бумагу наносят последовательно каплю раствора крахмала, каплю 2 М CH3COOH и каплю раствора KI. Капля должна оставаться бесцветной. Вносят каплю анализируемого раствора. Если нитриты присутствуют, то появляется синяя окраска.
4.2. Обнаружение нитрат-ионов. Обнаружению NO3– мешают анионы-окислители (NO2–). Если присутствие NO2- в растворе доказано, его необходимо удалить следующим образом. В 4 каплях анализируемого раствора растворяют около 0,1 г карбамида, после чего полученную смесь по каплям прибавляют к 2–4 каплям 2 н. раствора H2SO4:
2NO2– + 2H+ + CO(NH2)2 = CO2↑ + 2N2↑ + 3H2O
Каждую следующую каплю прибавляют только после того, как закончится бурная реакция с предыдущей каплей. Когда весь раствор будет прибавлен, дают жидкости некоторое время постоять, после чего отдельную порцию ее испытывают на нитрит-ион реакцией с KI в присутствии крахмала.
Если NO2– отсутствует, удобнее всего открывать NO3– реакцией с дифениламином. При выполнении ее в тщательно вымытую пробирку добавляют 3–4 капли исследуемого раствора, смачивая им стенки пробирки, затем весь раствор выливают из пробирки. По стенке пробирки, смоченной анализируемым раствором, аккуратно пускают каплю дифениламина, приготовленного на концентрированной серной кислоте. Появление интенсивной синей окраски указывает на присутствие NO3–. Большие количества I– могут помешать этой реакции.
Вопросы к лабораторной работе
1. Аналитические группы анионов.
2. Общая характеристика анионов I, II и Ш групп.
3. Характерные и специфические реакции анионов SO42–, CO32–, PO43–, Cl–, I–, NO2–, NO3–.
Лабораторная работа № 4
Анализ смеси солей
Цель работы: провести анализ предложенной смеси на содержание в ней катионов и анионов.
В качестве контрольной задачи Вы получите смесь сухих солей, полностью растворимую в воде. В состав смеси могут входить катионы и анионы, со способами обнаружения которых Вы ознакомились при выполнении предыдущих работ.
Так как анализ ведут главным образом мокрым путем, исследуемое вещество (или смесь их) должно быть пpeждe всего растворено. Для этого ~0,1 г его растворяют в 10–25 мл дистиллированной воды. Полученный раствор делят на 2 части: одна предназначается для обнаружения катионов, вторая – для обнаружения анионов (см. схему анализа на рис. 7). Анализ целесообразно начинать с обнаружения катионов: наличие некоторых из них свидетельствует об отсутствии ряда анионов.
Перед выполнением работы ознакомьтесь с рекомендациями к выполнению контрольных анализов (см. с. 10). Все испытания проводят с отдельными порциями исследуемого раствора. Результаты анализа вносят в таблицу (образец – табл. 3).
1.Предварительныеиспытания
В предварительных испытаниях обнаруживают NH4+, Fe2+, Fe3+, Zn2+ реакциями, описанными в работах № 1 и № 2.
Подготовка раствора к открытию катионов I и II групп
Во избежание окисления (NH4)2S до (NH4)2SО4 кислородом воздуха и связанного с этим осаждения катионов II группы в виде сульфатов необходимо сразу же после центрифугирования разрушить избыток (NH4)2S в центрифугате кипячением его с кислотой.
Для этого переносят раствор в фарфоровую чашку, подкисляют его СН3СООН и упаривают до половины объема. Отцентрифугировав выпавшую серу, центрифугат выпаривают досуха и прокаливают для удаления солей аммония, избыток которых помешал бы полноте осаждения катионов II группы карбонатом аммония. Сухой остаток растворяют после охлаждения в 10–12 каплях 2 н. раствораHCl и исследуют на катионы I и II групп по схеме, описанной в работе № 1.
Обнаружение анионов
Анализ анионов проводят дробным методом, описанным в работе № 3, используя вторую часть полученного раствора.
Вопросы к лабораторной работе
1. Систематический ход анализа катионов I–III групп.
2. Систематический ход анализа катионов I–III групп в присутствии
PO43–-ионов.
3. При растворении соли в кислоте наблюдается бурное выделение
газа. Присутствие каких анионов можно предполагать?
4. В составе растворимой в воде соли обнаружен катион Ва2+. Какие
анионы в составе соли заведомо отсутствуют?
Программа коллоквиума № 1
«Теоретические основы аналитической химии. Качественный анализ»
Предмет аналитической химии. Классификация методов анали-за. Цели и задачи качественного анализа.
Методические указания к лабораторным занятиям
по дисциплинам «Аналитическая химия»
Дата: 2016-10-02, просмотров: 327.