Гидролитические ацетогенные
Комплекс оргашче- Высшие жирные кис-
ских веществ лоты
Ацетогенез и дегидрогенизация Водородпродуцирующие бактерии Высшие жирные кис- На, СО2, СН3СООН
Метанобразующие бактерии
Метаногенез
На, СО2, СНзСООН
СН4, СО2
 Галактозо-КНг
Галактозо-КНг
|Аспартат{
|
|
Оксал о ацетат
I
Малат Фумарат
| Фактор |
Сукцинат
ATP I
Сукцинил-СоА
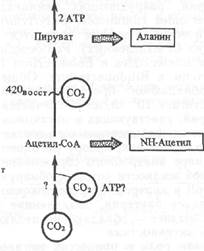
(С02) 1 факт°Р 420ВОСС а-кетоглутарат

Гексозофосфат
Триоэофосфат
АТР
Фосфоенолпирув ат
Пентоэофосфат
Рис. 3.
Предполагаемая схема автотрофной ассимиляции СО2 у бактерий Methanobacterium thermoautotrophicum
После создания Хангейтом Р. Э. в 1985 г. упрощенной техники культивирования метанобразующих бактерий удалось выделить 30 видов метаногенов, принадлежащих к 14 родам и 6 семействам. Некоторые представители метанобразующих бактерий приведены в табл. 11.9. По форме клеток метаногены являются кокками или палочками различных размеров и подвижности. Некоторые представители Methanobacterium и особенно Methanothrix могут образовывать даже нитеобразные клетки. Строение клеточной стенки у метаногенов отличается от таковой у обычных бактерий.
В качестве субстрата многие метаногены потребляют формиат, который трансформируют в метан:
4HCOOH-CH4+3CO2+2H2O
Таблица 9. Характеристика метанобразующих бактерий
| Род и вид | Характеристика культуры | Субстрат |
Methanobacterium
formicum
bryantii
thermoautotrophicum Methanobrevibacterium
ruminantium
smithi
orboriphilus Methanococcus
vannielii
voltae
thermoiithotrophicus
mazei
Methanomicrobium mobile
Methanobacterium cariaci marisnigri
Methanospirillum hunga-tei
Methanosarcina barken
Methanolhrix soehngenii
Methanothermus fervidus
Палочки от длинных до нитеобразных; в клеточной стенке содержится псевдомуреин
Комки, короткие палочки; в клеточной стенке содержится псевдомуреин
Подвижные нерегулярные небольшие кокки; в клеточной стенке содержатся полипептидные субъединицы
Подвижные короткие палочки и нерегулярные подвижные небольшие кокки; в клеточной стенке содержатся полипептидные субъединицы
Подвижные небольшие нерегулярные кокки; в клеточной стенке содержатся полипептидные субъединицы Подвижные палочки; в клеточной стенке содержатся полипептиды
Нерегулярные кокки, сгруппированные в пакеты; в клеточной стенке содержатся гетерополисахариды Палочки от длинных до нитей; в клеточной стенке не содержится муравьиная кислота
Неподвижные палочки; в клеточной стенке содержится псевдомуреин
Водород и формиат
Водород
То же
Водород и формиат
То же
Водород
Водород и формиат То же
»
Водород, метанол, метиламин, ацетат Водород и формиат
То же
Водород и формиат
Водород, ацетат, метанол, метиламин
Ацетат
Водород
При переработке различных коммунальных и промышленных стоков пищевых производств основным субстратом для метаногенов является ацетат, который также превращается в метан:
СН3СООН -СН4 + СО2.
К этой группе метаногенов относятся Methanosarcina barkeri Methanococcus mazei, Methanothrix soengenii. При конверсии ацетата в метан с их помощью очень мало изменяется свободная энергия субстрата (AG6 = —32 кДж), поэтому скорость их роста низка и их генерация длится не менее 10 сут.
Некоторые метаногены, как следует из таблицы 9, конвертируют в метан также метанол и метиламин:
4/3 СН3СООН -СН4 + ½ СО2 + 2/3 H 2 O .
4/3 СН 3 NH2 + 2/3 H2O - С H4 + 1/3 CO2.
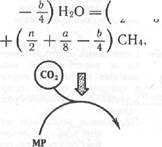
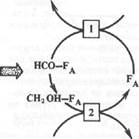
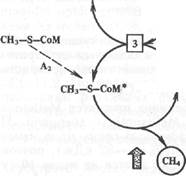
Метан при метановом брожении получается также из СО2 и Н2, образующегося в результате деятельности в основном ацетогенных бактерий. Предполагаемая схема восстановления СО2 до метана представлена на рис. 11.4. Согласно этой схеме переносчиками С] являются метаноптерин (МР) и 7,8-дигидрометанопте-рин (ДНМР) , коферменты FA и М.
Количество газа, получаемого из 1 моля кислоты в процессе брожения, можно определить по уравнению Басвелла:
| - + со2 + |
HS - CoM
 сnнa0b + ( „ - i
сnнa0b + ( „ - i
COOH-DHMP
t
НСО-МР
HS - CoM СНгОН-8-СоМ
CH,-&-CoM
„ CoM*
Рис. 11.4. Предполагаемая схема восстановления СО2 в метан метаногенами
где п, a , b — число атомов углерода, водорода и кислорода в соответствующей кислоте при 30 °С и нормальном давлении.
С увеличением длины углеродной цепи кислоты увеличивается количество получаемого газа. Так, из 1 г муравьиной кислоты получается газа 540 мл, из 1 г уксусной — 823 мл, из 1 г масляной — 1055 мл, из 1 г капроновой — 1224 мл.
Исследования, проведенные экологами, показали, что при термофильном метановом сбраживании паточной барды спиртового производства с содержанием СВ 4,2 % при суточной замене 10 % среды из 1 объема ферментационной жидкости выделяется 22 объема газа. Общее содержание кислот в жидкой среде 2,5 %, в том числе муравьиной — 0,46 %, уксусной — 0,79 %, пропио-новой — 0,86 %, масляной — 0,39 %. Экспериментально установлено, что по скорости сбраживания органические кислоты распределяются в следующем нарастающем порядке: пропионовая, капроновая, валериановая, муравьиная, масляная, уксусная. Наиболее интенсивно сбраживается уксусная кислота.
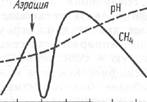
Метаногенез зависит в большой степени от химического состава среды и физических факторов. Прежде всего необходимо иметь в виду, что метаногены строгие анаэробы и кислород является для них ядом. Значение окислительно-восстановительного потенциала (еН), при котором лимитируется рост метаноге-нов, равно 330 мВ; оптимум — примерно — 400 мВ. Присутствие одной молекулы О2 в 10 л воды ингибирует метаногенез. Однако наши исследования показали, что кратковременная аэрация метантенка не приводит к гибели метаногенов, так как сопутствующая факультативно анаэробная микрофлора утилизирует кислород и через 2 сут метаногенез возобновляется (рис. 5).
Мета-нобразующие бактерии хорошо развиваются и метаболизируют субстрат в метан при рН 6—8. Однако различные представители по-разному реагируют на из-
| РН |
|
|
менение рН среды. В метан-тенках рН поддерживают на уровне, близком к нейтральному или щелочному.
|
|
| 2 4 6 8 10 12 сут Рис. 5. Влияние кратковременной аэрации среды на метаногенез при сбраживании свиного навоза в термофильных условиях |
По температурному оптимуму различные метаногены сильно различаются. В природе встречаются как психрофилы, так и термофилы, выживающие даже при 97 °С. Большинство ме-тантенков работает в мезо-фильном режиме при 35— 45 °С. Термофильная ферментация (при 50—57 °С) идёт менее интенсивнее, чем мезофильная, однако процесс отличается меньшей стабильностью.
Биомасса метанобразующих бактерий состоит из 54 % углерода, 20 % кислорода, 10 % водорода, 12 % азота, 2 % фосфора и 1 % серы. Кроме того, в биомассе содержатся калий, натрий, кальций, магний и ряд микроэлементов, наиболее важные из которых кобальт, молибден и никель. Чтобы обеспечить формирование клеточной массы, в среде должны содержаться необходимые питательные вещества. Соотношение ХПК: N:P должно быть 700:5:1, нельзя допускать избытка азота (C:N не менее 20:1). Уровень токсичности ионов аммиака для метанобразующих бактерий 1500—2000 мг/л; цианида (CN~) —0,5—1,0 мг/л; калия, натрия и кальция — 3000—6000 мг/л.
Ингибирование метаногенеза вызывают сульфиты, которые при метановом брожении сульфатвосстанавливающие бактерии восстанавливают до H2S. Метаногенез ингибируется при концентрации сульфидов 100—159 мг/л. При метаногенезе на 50 % сокращается содержание растворимых солей тяжелых металлов при следующих концентрациях ионов (в мг/л}: железо— 1 —10; цинк— 10~4; кадмий— 10~7; медь —10~12 и 10~1 (для двухвалентной формы).
Процесс метаногенеза замедляется в присутствии различных детергентов (при их концентрации около 15 мг/л), антибиотиков и других веществ. Если метановое брожение не ингибировано, при 35 °С выход метана составляет 0,34—0,36 м3 из 1 кг расходованного ХПК или 0,91—0,93 м3 из 1 кг использованного органического углерода. Можно считать, что в среднем из 1кг ХПК получают 0,35 м3 метана. Если эти показатели ниже, то можно предполагать, что метаногенез ингибируется каким-либо фактором. Об этом свидетельствуют, например, изменение реакции среды (подкисление), накопление пропионата. Сумма летучих жирных кислот в среде не должна быть выше 250 мг/л.
Для восстановления интенсивности метанового брожения можно снижать скорость подачи субстрата, подщелачивать среду химическими веществами, разбавлять стоки водой, удалять токсические соединения путем предварительной обработки стоков. Интенсифицировать метановое брожение можно также, разделяя процесс на две стадии: первую — предварительную, в которой в отдельном аппарате или секции реализуется гидролиз субстратов, и вторую — собственно метаногенез. Это позволяет локализовать специфическую для каждой стадии микрофлору и обеспечить наиболее благоприятные условия для развития каждой группы микроорганизмов: в первой — преимущественно гидролитическую и ацетогенную, во второй — главным образом метаногены. Установлено, что метаногены любят адгезировать на поверхностях, поэтому во второй секции можно помещать специальные иммобилизующие средства (щетки, гранулы и т.д.).
Так как метанобразующие бактерии имеют низкую скорость роста, важно технологическими методами обеспечить их высокую концентрацию в биореакторе. Один из таких методов — иммобилизация клеток на поверхности носителей. Нами установлено, что на щетках из капроновых волокон уже через 2—3 нед ферментации накапливается в 2—3 раза больше метаногенов, чем в жидкости.
Оригинальный метод повышения концентрации биомассы разработан в 1970 г. Леттингом Г., Зендером А. и др. В биореакторе создают условия, способствующие естественному образованию гранул бактериальной биомассы под воздействием факторов среды и гидродинамического режима. Например, направляя поток среды снизу вверх, достигают выноса из реактора нефлокулирующих микроорганизмов. Этим создаются благоприятные условия для накопления биомассы флокулообразующих сарцин и нитеобразующих форм бактерий (например, из рода Methanot-hrix). Гранулообразованию способствует выбор специального субстрата. Так, Methanosarcina и Methanothrix утилизируют преимущественно ацетат, следовательно, в среде должен быть ацетат.
Для накопления в среде ацетата в начале процесса устанавливают небольшие скорости загрузки биореактора, чтобы создать условия для утилизации и трансформации всех высших жирных кислот. Кроме того, в среде должны быть ионы кальция, которые способствуют флокуляции. При таких условиях в нижней части биореактора постепенно накапливаются гранулы величиной 0,5— 2,5 мм с хорошими седиментационными свойствами. В реакторе не должно быть механического перемешивания, чтобы не деформировать и не разрушить гранулы. В верхней части биореактора необходимо устанавливать сепарационное устройство, в котором гранулы отделяются от жидкой фазы и возвращаются в нижнюю часть аппарата. Кроме того, в сепарационном устройстве отделяется также газовая фаза. По такому же принципу созданы и эффективно работают биореакторы с верхним вводом потока и с толстым слоем шлама (биореактор UASB — Upflow Anaerobic Sludge Blanket Reactor).
Схема такого биореактора приведена в табл. 10. В нижней части биореактора в слое высотой 1,5—2,5 м концентрация биомассы достигает 50—100 кг/м3; над этим слоем концентрация биомассы 5—20 кг/м3. В оптимальных условиях биореактор обеспечивает суточную загрузку ХПК до 15 кг/м3, полная замена субстрата происходит за 4 ч при степени очистки 70—90 %.
Таблица 10. Системы анаэробной очистки сточных вод
| Биореактор | Принцип действия и конструкция | Схема |
Анаэробные лагуны Система отстойников, в Стони
которых стоки пребыва- I Биогаз Виозоз
ют от нескольких недель .T_i_i_i_ __ t M 1Т,{]'илц?н-
7777Z
до 2 мес. газы свободно г.. ъныеамю
выделяются в атмосферу
Продолжение
| Биореактор | Принцип действия и конструкция | Схема | |
| Двухступенчатый биореактор
| Ферментационное пространство разделено на две части: в первой реализуется процесс биодеградации субстрата и ки- /-_. слотообразования, а во — | Виагаз | |
| ^_1 | |||
| Нисяояю- 7ки образоВа- | qj Метано- 5 генез s Hi з | ||
| 1 са | |||
Для анаэробного брожения стоков применяют различные биореакторы очень больших объемов, изготовленные из металла или железобетона, в виде вертикальных и горизонтальных цилиндров или прямоугольных резервуаров. В Китае, Индии и некоторых других странах Азии успешно используют небольшие биореакторы объемом до 10 м3 очень простой конструкции для утилизации отходов домашнего хозяйства. Количество таких биореакторов составляет более 10 млн. В развитых странах построено множество крупных биогазовых установок для очистки стоков промышленных предприятий и отходов ферм. Метановое брожение традиционно применяют при очистке городских стоков, для утилизации активного ила после аэробной ферментации.
В последнее время анаэробное метановое брожение применяют для детоксикации стоков. Установлено, что анаэробные бактерии деградируют не только углеводы, липиды, протеины, нуклеиновые кислоты, но и многие соединения нефтехимической промышленности, например бензольную кислоту.
4 С6Н5СООН + 18 Н20 - 15 СН4+ 13 СО2.
Адаптированные ассоциации анаэробов деградируют ацетальдегид, ацетон, бутанол, этилацетат, этилакрилат, глицерол, нитробензол, фенол, пропанол, пропиленгликоль, кретоновую, фумаровую и валериановую кислоты, винилацетат, парафины, синтетические полимеры и многие другие вещества и продукты.
Метановое брожение должно рассматриваться не только как средство защиты окружающей среды, но и как метод получения газообразного топлива, ценных органических удобрений и даже кормовых добавок. Так, в начале 60-х годов Институтом биохимии им. А. Н. Баха при участии Института микробиологии им. А. Кирхенштейна Латвии был создан метод получения концентрата витамина В12 путем метанового сбраживания мелассной барды спиртового производства. Витамин B12 содержится в биомассе бактерий метанового брожения.
В разделе об аэробных системах очистки стоков уже говорилось, что в городах, где за 1 сут сбрасывается 550 тыс. м3 стоков, успешно работают комбинированные системы, состоящие из 27 аэротенков объемов 39 000 м3 и 6 метантенков объемом 6500 м3 каждый. Метантенки работают в мезофильном режиме, длительность замены субстрата 17 сут. После метанового брожения биомасса отделяется и высушивается с использованием энергии биогаза. Сухой продукт, получаемый в количестве 280 т/сут, служит удобрением.
Финской фирмой «Тампелла» предложена рациональная система очистки стоков пищевых и бумажных заводов. Биореактор «Таман» сконструирован с учетом возможности реализации двухстадийного процесса (кислая и метаногенная стадии), причем на метаногенной стадии применяется гранулооб-разный шлам. Интенсификация метанообразования обеспечивается в результате выноса из зоны метаногенеза свежего субстрата с важными ингибиторами, а также наличия во второй зоне большой биомассы метанобразующих бактерий. Обе зоны могут быть размещены в одном вертикальном цилиндре, разделенном горизонтальной перегородкой на верхнюю зону объемом 300 м3 и нижнюю — 350 м . На молочном заводе, перерабатывающем за год 63 млн л молока и производящем 3000 т сыра, 2 тыс. т сливочного масла, 1,2 млн т мороженого и 17 млн л товарного молока, система очистки «Таман» обеспечивает хорошую очистку стоков.
Количество перерабатываемых стоков, м3/сут 500
ХПК, т/сут 1,3
БПКл, т/сут 0,6
Дата: 2019-07-30, просмотров: 330.