ОБЩАЯ БИОТЕХНОЛОГИЯ
Современное состояние и перспективы развития биотехнологии

С древних времен известны отдельные биотехнологические процессы, используемые в сферах практической деятельности человека. К ним относятся хлебопечение, виноделие, пивоварение, приготовление кисломолочных продуктов и т. д. Наши предки не имели представления о сути процессов, лежащих в основе таких технологий, но в течение тысячелетий, используя метод проб и ошибок, совершенствовали их. Биологическая сущность этих процессов была выявлена лишь в XIX в. благодаря научным открытиям Л. Пастера. Его работы послужили основой для развития производств с использованием разнообразных видов микроорганизмов. В первой половине XX в. стали применять микробиологические процессы для промышленного получения ацетона и бутанола, антибиотиков, органических кислот, витаминов, кормового белка.
Успехи, достигнутые во второй половине XX в. в области цитологии, биохимии, молекулярной биологии и генетики, создали предпосылки для управления элементарными механизмами жизнедеятельности клетки, что способствовало бурному развитию биотехнологии. Благодаря селекции высокопродуктивных штаммов микроорганизмов, эффективность биотехнологических процессов увеличилась в десятки и сотни раз.
Особенностью биотехнологии является то, что она сочетает в себе самые передовые достижения научно-технического прогресса с накопленным опытом прошлого, выражающимся в использовании природных источников для создания полезных для человека продуктов. Любой биотехнологический процесс включает ряд этапов:
подготовку объекта, его культивирование, выделение, очистку, модификацию и использование полученных продуктов. Многоэтапность и сложность процесса обусловливает необходимость привлечения к его осуществлению самых разных специалистов: генетиков и молекулярных биологов, цитологов, биохимиков, вирусологов, микробиологов и физиологов, инженеров-технологов, конструкторов биотехнологического оборудования и др.
Характеристика различных видов биотехнологической продукции и ее основные потребители.
Селекция продуцентов БАВ.
Неотъемлемым компонентом в процессе создания наиболее ценных и активных продуцентов, т.е. при подборе объектов в биотехнологии, является их селекция.
Выделение м/о из естественных мест обитания предполагаемого продуцента отбирают образцы материала (берут пробы материала) и производят посев в селективную среду, т.е. получают накопительные культуры. Следующим этапом является выделение чистой культуры с дальнейшим изучением изолированного микроорганизма. Главным путем селекции является сознательное конструирование геномов на каждом этапе отбора нужного продуцента.
В развитии микробных технологий сыграли важную роль методы, базирующиеся на селекции спонтанно возникающих измененных вариантов, характеризующихся нужными полезными признаками. При таких методах обычно используется ступенчатая селекция: на каждом этапе отбора из популяции микроорганизмов отбираются наиболее активные варианты (спонтанные мутанты), из которых на следующем этапе отбирают новые, более эффективные штаммы.
Процесс селекции наиболее эффективных продуцентов значительно ускоряется при использовании метода индуцированного мутагенеза. В качестве мутагенных воздействий применяются УФ, рентгеновское и гамма-излучения, определенные химические вещества. Однако и этот прием также не лишен недостатков, главным из которых является его трудоемкость и отсутствие сведений о характере изменений.
Применение перечисленных подходов в сочетании с приемами классической селекции является сутью современной селекции микроорганизмов-продуцентов.
Продукты микробного синтеза
Антибиотики -- один из первых продуктов микробиологического синтеза, которые широко производят для медицины и сельского хозяйства. Большинство антибиотиков накапливается вне клеток микроорганизма-продуцента, которыми в основном являются Актиномицеты, некоторые грибы и бактерии, главным образом их мутантные формы. Антибиотические препараты, употребляемые преимущественно в медицине, отличаются высокой степенью чистоты. На корм животным чаще идёт концентрат среды после выращивания в ней продуцента, иногда вместе с биомассой, содержащий значительное количество др. продуктов обмена веществ продуцента, в том числе витамины, аминокислоты, нуклеотиды и т.п. Некоторые антибиотики (фитобактериомицин, трихотецин, полимиксин) используются как средства защиты растений от фитопатогенных микроорганизмов.
Витамины, провитамины, коферменты. Методом микробиологического синтеза производят в основном витамин B12, а частично и витамин B2 и его коферментную форму -- флавинадениндинуклеотид (ФАД), каротиноиды, эргостерин. Кроме того, развивается производство разных др. соединений этого типа (никотинамидные коферменты и др.). Витамин B12 получают практически только путём микробиологического синтеза. Основными продуцентами при этом служат пропионовокислые бактерии, актиномицеты, а также комплекс метанобразующих бактерий, использующих отходы бродильной промышленности (послеспиртовые, ацетоно-бутиловые барды и др.) и применяемых в основном для получения кормового концентрата (высушенная среда с биомассой продуцента). Многие микроорганизмы способны к сверхсинтезу витамина B2 с активным выделением его в среду, но в качестве промышленных продуцентов употребляют наиболее активные культуры, главным образом грибы Eremothecium ashbyii и Ashbya gossipii. Помимо свободного витамина, при помощи Е. ashbyii получают также ФАД. в-каротин -- провитамин витамина А, получаемый также другими способами (извлечение из моркови и др. объектов, химический синтез), образуется наряду с другими каротиноидами многими микроорганизмами и содержится в клетках, придавая биомассе характерную окраску от жёлтой до красных тонов; однако наибольший практический интерес представляет культура Blakeslea trispora -- самый активный синтетик, которым и пользуются в основном в качестве продуцента при промышленном биосинтезе. Эргостерин -- провитамин витамина D2 -- содержится в клетках многих дрожжей; основным источником его промышленного получения служат пекарские дрожжи. Однако уже имеются дрожжевые культуры со значительно более высоким уровнем накопления эргостерина. Комплекс витаминов и коферментов синтезируется, кроме того, в процессе развития дрожжей и накапливается в дрожжевой биомассе, которая привлекает всё более пристальное внимание как источник этих соединений.
Ферменты, синтезируемые микроорганизмами, и создаваемые на их основе ферментные препараты приобрели большое значение в народном хозяйстве, особенно в пищевой промышленности. Продуцентами ферментов -- протеаз, амилаз, фосфатаз, целлюлаз, пектиназ, глюкозооксидазы, липаз, каталазы -- служат многие мицелиальные грибы, некоторые актиномицеты и бактерии. В зависимости от локализации фермента подвергают обработке микробную массу или фильтрат, свободный от микробных клеток. Получение чистых ферментных препаратов связано со значительными технологическими трудностями. Такие препараты обычно очень дороги; поэтому в промышленности используют комплексные препараты, содержащие, например, протеазы и липазы, протеазы и амилазы.
Аминокислоты. Наблюдаемый во многих странах недостаток ряда аминокислот в рационах человека и кормах животных вызвал промышленное их получение, в том числе и методом микробиологического синтеза. Существенное преимущество микробиологического синтеза аминокислот перед химическим методом заключается в получении их непосредственно в виде природных изомеров (L-формы). Из аминокислот наиболее важны Лизин и Глутаминовая кислота. Продуцентами аминокислот обычно служат культуры бактерий, относящихся к родам Brevibacterium и Micrococcus; для производства используются преимущественно мутанты-ауксотрофы, осуществляющие сверхсинтез соответствующей аминокислоты с выделением её в среду.
Нуклеотиды. Широкое развитие микробиологического синтеза нуклеотидов, в частности инозиновой, гуаниловой и др. кислот, получил в Японии, где они используются главным образом как добавки к специфическим продуктам восточной кухни. В будущем нуклеотиды приобретут, вероятно, более важное значение в качестве регуляторов многих энзиматических и гормональных процессов в животном организме. Накопление нуклеотидов происходит преимущественно в культуральной жидкости, т. е. вне клеток продуцентов. Для нуклеотидов, как и аминокислот, используются биохимические мутанты с выраженным сверхсинтезом нужного соединения.
Белок и белково-витаминные препараты. Особое значение как источник белка имеет микробная биомасса. Производство такой биомассы на дешёвом сырье рассматривают как одно из средств устранения растущего белкового дефицита в питании человека и животных. Наиболее интенсивное развитие получили промышленные методы синтеза так называемых кормовых дрожжей, применяемых в виде сухой биомассы как источник белка и витаминов в животноводстве. Кормовые дрожжи содержат значительном количество белка (до 50--55%), в состав которого входят незаменимые аминокислоты, например лизин, Триптофан, Метионин; они богаты витаминами, многими микроэлементами. Для выращивания кормовых дрожжей использовали преимущественно дешёвое углеводное сырьё -- гидролизаты отходов деревообрабатывающей промышленности, непищевых растительных материалов (подсолнечная лузга, стержни кукурузных початков и т.п.), сульфитные щелока, различные виды барды и т.д. Ныне в крупных промышленных масштабах организуется производство дрожжей на углеводородах (налканах, газойле, различных фракциях нефти). Большие запасы этого сырья позволяют планировать крупнотоннажное производство микробной биомассы. Для получения белково-витаминной биомассы изучается также возможность применения бактерий. Многие бактерии хорошо растут на углеводородах, в частности газообразных (например, на метане), а также на др. источниках углерода (например, на метаноле и уксусной кислоте). Углеводороды и их производные привлекают внимание и как сырьё для микробиологического синтеза отдельных физиологически активных соединений (аминокислот, витаминов, нуклеотидов и т.д.).
К числу продуктов микробного синтеза следует отнести и некоторые средства защиты растений: бактериальные энтомопатогенные препараты (например, энтобактерин, инсектин, дендробациллин), вызывающие гибель вредных насекомых и предотвращающие их массовое размножение. Указанное действие вызывают своеобразные «белковые кристаллы» -- носители токсичности, расположенные в микробных клетках.
Экстрагирование ферментов
Все ферменты являются водорастворимыми белками, поэтому наилучшим экстрагентом для них является вода. Для извлечения ферментов из дрожжей или бактерий необходимо подвергнуть механическому или автолитическому разрушению их клеточные стенки, обладающие высоким диффузионным сопротивлением. Оболочки мицелиальных нитей имеют меньшее диффузионное сопротивление, чем оболочки бактериальных и дрожжевых клеток, поэтому дезинтеграции культуры грибов не требуется.
Извлечение ферментов проводят как из влажных, так и из сухих поверхностных культур грибов. Сухая культура может храниться длительное время без потери активности ферментов, и из нее получают более концентрированные экстракты. Технологически это выгоднее, но при подсушивании культуры имеют место потери активности, и потому экстрагирование целесообразно вести из влажной культуры. При экстрагировании различные водорастворимые вещества извлекаются из культуры с неодинаковой скоростью, происходит их частичное фракционирование, удельная активность ферментов в экстракте повышается в 3,5 – 4 раза по сравнению с исходной культурой в результате отделения большой части веществ (до 75 %) с нерастворимым остатком – биошротом.
На полноту экстрагирования ферментов из культур оказывают влияние многие факторы: температура, рН, длительность процесса, конструктивные особенности экстракционных аппаратов, природа извлекаемого фермента, количество отобранного экстракта с единицы массы загруженной в аппарат культуры и т. д.
Одновременно с ферментами экстрагируются многие другие соединения, и часто скорость извлечения балластных веществ больше скорости экстрагирования из культуры целевого фермента. Поэтому рациональнее пойти на некоторые потери фермента и закончить экстрагирование на оптимальном значении отношения активности фермента в экстракте к сумме извлекаемых веществ. Этот вопрос решается экспериментально для каждого вида продуцента.
Влиять на процесс экстрагирования с помощью такого фактора, как температура, практически невозможно, так как ферменты очень термолабильны и инактивируются даже при 35 – 40 °С (рис. 3). Кроме того, повышение температуры до 35 – 40 °С влечет за собой увеличение содержания сухого вещества в экстракте и уменьшение удельной ферментативной активности на 1 г сухого вещества, повышение опасности инфицирования экстрактов. Поэтому при проведении экстракции в заводских условиях стремятся подавить развитие микрофлоры путем максимального снижения температуры воды до 22 – 25 °С и применения антисептиков (формалин, бензол, толуол, хлороформ и др.). В большинстве случаев ферменты наиболее полно извлекаются при рН 5 – 7.
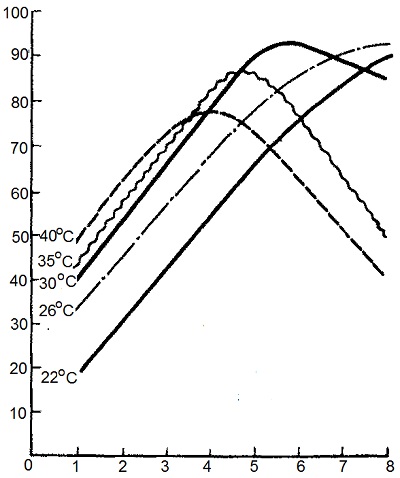
Рис.3. Влияние температуры на процесс экстрагирования
Для получения концентрированных экстрактов при небольших потерях ферментов с биошротом необходимо применять специальные экстракционные установки. Ранее широко использовались диффузионные батареи (рис. 4). В них можно получить экстракт с содержанием сухого вещества от 7 до 14 % в зависимости от вида культуры, среды и величины отбора экстракта. Но эти установки для экстрагирования ферментов из поверхностной культуры имели сравнительно небольшую производительность, требовали больших затрат ручного труда, и в них наблюдались сравнительно большие потери активности.
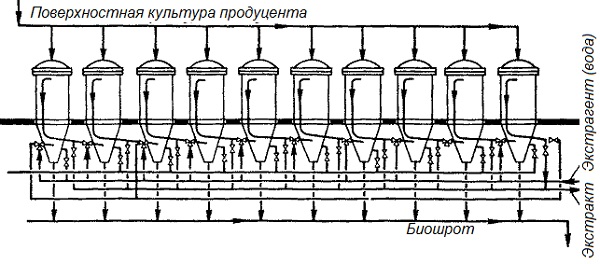
Рис.4. Диффузные батареи
Более перспективным в этом отношении является экстрактор непрерывного действия фирмы «Ниро Атомайзер» (Япония), работающий под избыточным давлением (рис. 6). Экстрактор представляет собой наклонную цилиндрическую емкость, снабженную двумя шнеками, теплообменными рубашками и насосами. Культура через дозирующее устройство 5 подается внутрь цилиндра, а с противоположной стороны вводится растворитель (вода).
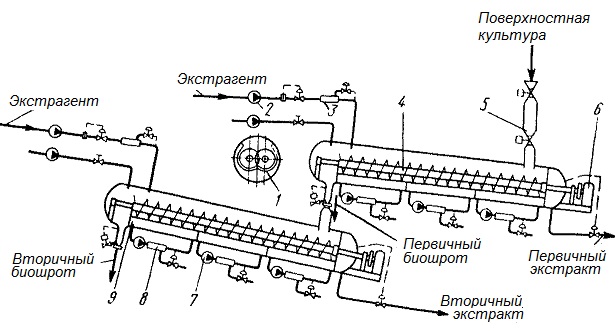
Рис.5. Экстрактор непрерывного действия фирмы «Ниро Атомайзер» (Япония)
Экстракт выходит из установки через самоочищающийся фильтр, а биошрот удаляется с противоположного конца. В случае необходимости, если ферменты экстрагируются не полностью, можно осуществлять двухступенчатое экстрагирование, увеличивая длительность процесса. Вторичный экстракт может быть использован в качестве растворителя для первой ступени экстрагирования. Общая продолжительность экстрагирования регулируется частотой вращения шнеков. Вторичный биошрот используется как компонент среды или после обеспложивания в кормопроизводстве.
Биореакторы
Промышленное производство биопрепаратов представляет собой сложный комплекс взаимосвязанных физических, химических, биофизических, биохимических, физико-химических процессов и предполагает использование большого количества разнотипного оборудования, которое связано между собой материальными, энергетическими потоками, образующими технологические линии.
Основным аппаратурным элементом биотехнологического процесса является биореактор - ферментер (рис. 10). Биореакторы предназначены для культивирования микроорганизмов, накопления биомассы, синтеза целевого продукта.
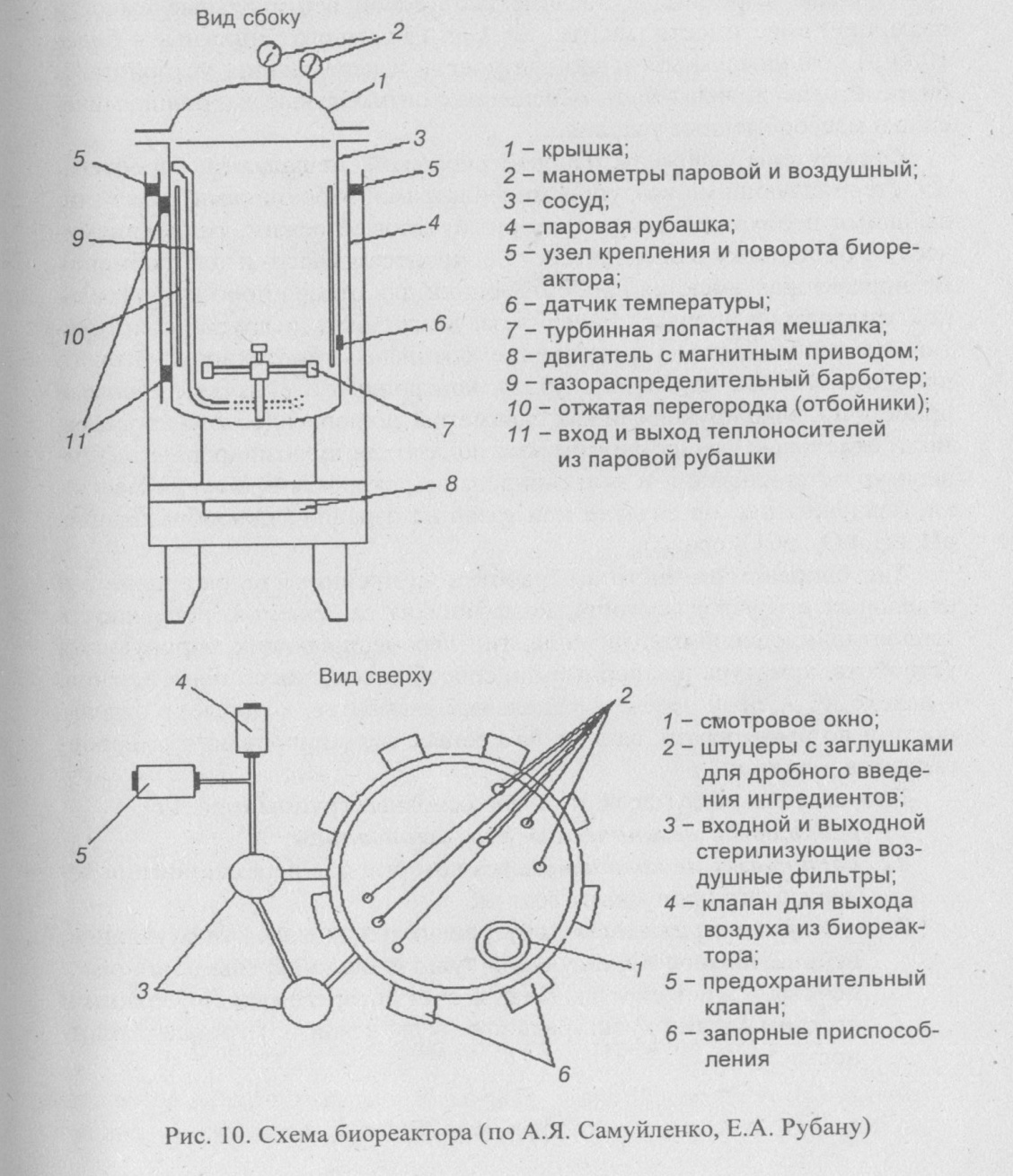
Биореакторы изготавливают из высоколигиро-ванных марок стали, иногда из титана. Внутренняя поверхность биореактора должна быть отполирована.
Типовые ферментеры представляют собой вертикальные ёмкости различной вместимости (малые - от 1 до 10 л, многотоннажные - более 1000 л) с минимальным числом штуцеров и передающих устройств. В биореакторах должны быть обеспечены оптимальные гидродинамические и массообменные условия.
Ферментеры снабжены паровой рубашкой, мешалками, барботера-ми, стерилизующими воздушными фильтрами, отбойниками, обеспечивающими необходимые температурный, газовый режим, гидродинамическую обстановку в биореакторе (т.е. процессы массо- и теплообмена). В биореакторах имеются пробоотборцики для отбора проб культураль-ной жидкости в процессе биосинтеза. Могут быть и другие конструктивные особенности, учитывающие специфику биотехнологического процесса. Работа отдельных узлов контролируется измерительными приборами, фиксирующими как параметры технологического процесса, так и отдельные физико-химические показатели культивирования (температуру стерилизации и культивирования, скорость вращения мешалки, давление, расход воздуха или газов на аэрацию, пенообразование, рН, еН, рО2, рСО2 среды).
Тип биореактора, чистота обработки внутренних стенок аппарата и отдельных его узлов, ёмкость, коэффициент заполнения, поверхность теплоотдачи, способ отвода тепла, тип перемешивающих, аэрирующих устройств, арматура и запорные приспособления, способ пеногашения, — далеко не полный перечень отдельных элементов, которые, в отдельности и во взаимосвязи, влияют на процесс культивирования микроорганизмов и клеток.
Биореакторы подразделяют на три основные группы (рис. 11):
1) реакторы с механическим перемешиванием;
2) барботажные колонны, через которые для перемешивания содержимого пропускают воздух;
3) эрлифтныереакторы с внутренней или внешней циркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком воздуха, за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
Биореакторы первого типа используют чаще всего, так как они позволяют легко изменять технологические условия и эффективно доставлять к растущим клеткам воздух, определяющий характер развития микроорганизмов и их биосинтетическую активность. В таких реакторах воздух подают в культуральную среду под давлением через разбрызгиватель - кольцо с множеством маленьких отверстий. При этом
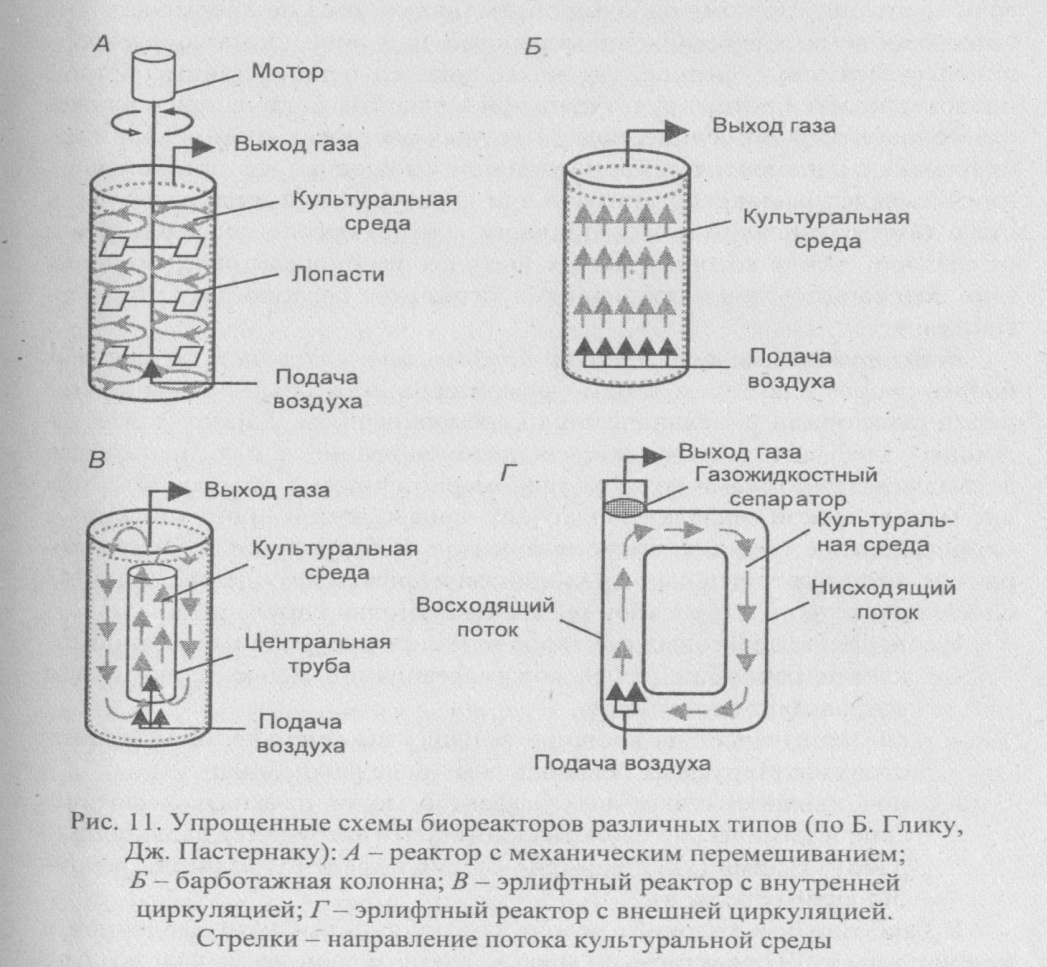
Биореакторы первого типа используют чаще всего, так как они позволяют легко изменять технологические условия и эффективно доставлять к растущим клеткам воздух, определяющий характер развития микроорганизмов и их биосинтетическую активность. В таких реакторах воздух подают в культуральную среду под давлением через разбрызгиватель - кольцо с множеством маленьких отверстий. При этом цели используют мешалки - одну или несколько. Мешалки, разбивая крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. Эффективность распределения воздуха зависит от типа мешалки, числа оборотов, физико-химических свойств среды.
При интенсивном перемешивании культуральной среды происходит ее вспенивание, поэтому рабочий объем биореактора не превышает 70% общего объема. Свободное пространство над поверхностью раствора используется как буферное, где накапливается пена, и таким образом предотвращается потеря культуральной жидкости. В пенящейся жидкости условия аэрации лучше, чем в плотных растворах (при условии непрерывного перемешивания и циркуляции слоя пены, т.е. при исключении нахождения микроорганизмов вне культуральной жидкости). Вместе с тем вспенивание может привести к переувлажнению фильтров в отверстиях, через которые воздух выходит из биореактора, уменьшению потока воздуха и к попаданию в ферментер посторонних микроорганизмов.
Конструктивные особенности барботажных колонн и эрлифтных биореакторов дают этим типам ферментеров некоторые преимущества перед реакторами с механическим перемешиванием. Барботажные колонны более экономичны, так как перемешивание в них происходит восходящими потоками воздуха равномерно по всему объему. Отсутствие механической мешалки исключает один из путей проникновения в биореактор посторонних микроорганизмов. В барботажных биореакторах не возникает сильных гидродинамических возмущений (сдвигов слоев жидкости культуральной среды относительно друг друга).
Уменьшение сдвиговых факторов важно по следующим причинам: клетки рекомбинантных микроорганизмов менее прочны, чем нетрансформированные;
клетка отвечает на внешние воздействие уменьшением количества синтезируемых белков, в том числе рекомбинантных; под влиянием сдвиговых эффектов могут изменяться физические и химические свойства клеток, что затрудняет дальнейшую работу с ними (ухудшаются условия выделения, очистка рекомбинантных белков).
В барботажных колоннах воздух подают под высоким давлением в нижнюю часть биореактора; по мере подъема мелкие пузырьки воздуха объединяются, что влечет неравномерное его распределение. Кроме того, подача воздуха под высоким давлением приводит к сильному пе-нообразованию.
В эрлифтных биореакторах воздух подают в нижнюю часть вертикального канала. Поднимаясь, воздух увлекает за собой жидкость к верхней части канала, где расположен газожидкостный сепаратор (здесь частично выходит воздух). Более плотная деаэрированная жидкость опускается по другому вертикальному каналу ко дну реактора и процесс повторяется. Таким образом, в эрлифтном биореакторе культуральная среда вместе с клетками непрерывно циркулирует в биореакторе.
Эрлифтные биореакторы выпускаются в двух конструктивных вариантах. В первом - реактор представляет емкость с центральной трубой, которая обеспечивает циркуляцию жидкости (реакторы с внутренней циркуляцией). У эрлифтного биореактора второго типа культуральная среда проходит через отдельные независимые каналы (реактор с внешней системой циркуляции).
Эрлифтные биореакторы более эффективны, чем барботажные колонны, особенно в суспензиях микроорганизмов с большей плотностью или вязкостью. Перемешивание в эрлифтных ферментерах более интенсивно и вероятность слипания пузырьков минимальна.
Для стерилизации биореактора применяют пар под давлением. Внутри биореактора не должно быть «мертвых зон», недоступных для пара во время стерилизации. Стерилизации подлежат все клапаны, датчики, входные и выходные отверстия.
Стерильность обеспечивается и герметизацией биотехнологического оборудования, работающего в асептических условиях. Стерильная передача жидкости осуществляется через штуцеры парового затвора. Технологическая обвязка биореактора исключает контаминацию куль-туральной жидкости посторонней микрофлорой и возможности попадания продуктов биосинтеза в окружающую среду. Основные агенты, контаминирующие клеточные культуры — бактерии, дрожжи, грибы, простейшие, микоплазмы, вирусы. Источники контаминации - воздух, пыль, питательные среды, рабочие растворы, оборудование, рабочий персонал.
Требования к проведению отдельных процессов в стерильных условиях с аэрацией культур.
Методы, применяемые для исключения возможности попадания в культуру посторонней микрофлоры, основаны либо на задержке, либо на уничтожении микроорганизмов (рис. 6.1).
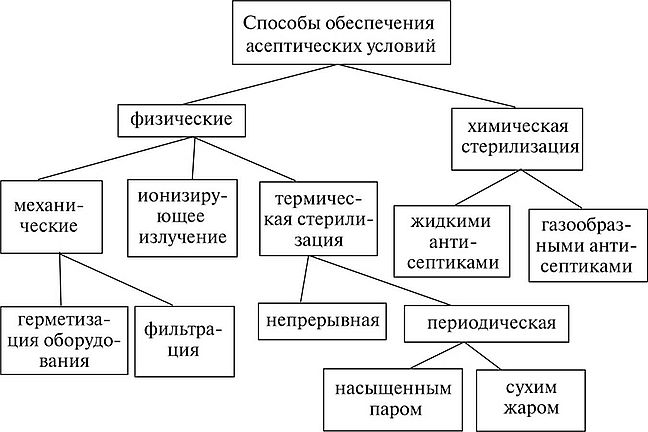
Рис. 6.1. Способы обеспечения асептических условий
К методам, основанным на первом принципе, можно отнести стерилизующую фильтрацию воздуха и жидкостей (растворов питательных веществ), а также герметизацию технологического оборудования и коммуникаций. К методам, основанным на уничтожении микроорганизмов, относятся термическая, химическая и радиационная стерилизации (ионизирующее излучение). В биотехнологии наиболее распространена термическая стерилизация. Она применяется для стерилизации оборудования и коммуникаций, питательных сред и технологических растворов, для создания тепловых барьеров, препятствующих прониканию микроорганизмов в аппарат во время отбора проб, внесения посевного материала и добавок. В качестве стерилизующего агента при термической стерилизации обычно используют насыщенный водяной пар различного давления и температуры. Химическую стерилизацию применяют обычно для тех элементов оборудования, которые не выдерживают нагревания до температуры 110—130 °С, необходимой для тепловой стерилизации (некоторые датчики и другие средства
КИПиА, фильтры для воздуха и жидкостей). В качестве агентов химической стерилизации используют формальдегид, оксид этилена, Р-пропиолактон и др.
Радиационная стерилизация основана на губительном воздействии ионизирующего излучения на клетки микроорганизмов. Она пока не нашла широкого применения в микробиологической промышленности.
СТЕРИЛИЗАЦИЯ КИПЯЧЕНИЕМ
Стерилизацию металлических инструментов и резиновых трубок проводят кипячением. Так как споры некоторых бактерий сохраняют жизнеспособность при кипячении в воде в течение нескольких часов, то рекомендуется стерилизацию кипячением проводить в 2%-ном растворе карбоната натрия в течение 10 мин. В этих условиях споры погибают.
СТЕРИЛИЗАЦИЯ СУХИМ ЖАРОМ
Сухим жаром стерилизуют стеклянную посуду. При этом пробирки, колбы предварительно закрывают ватными пробками. Чтобы избежать заражения простерилизованных предметов из воздуха, их перед стерилизацией заворачивают в оберточную бумагу и вынимают только перед работой.
Пипетки перед стерилизацией с концов закрывают ватой. Затем их обертывают длинными полосками бумаги шириной 3,5–4 см. Бумагу наматывают по спирали, начинная с конца пипетки, который будет погружен в среду. Концы обертки закрепляют ниткой. Тонкие пипетки обертывают бумагой вместе по несколько штук.
Чашки Петри заворачивают в бумагу в форме квадрата, сторона которого приблизительно равна трем диаметрам чашки. Чашку Петри помещают на середину листа, загибают его с двух противоположных сторон кверху так, чтобы края налегали друг на друга. Два свободных конца загибают вниз. При таком обертывании у чашек легко различать верх и низ.
Подготовленную таким образом посуду помещают в сушильный шкаф, в котором нагревают ее при температуре 160–170°С в течение 2 ч (с момента установления нужной температуры). При таком нагревании погибают не только бактерии, но и их споры.
Температуру в сушильном шкафу выше 175°С допускать не следует, так как при этом ватные пробки буреют, а бумажная обертка становится ломкой.
ПАСТЕРИЗАЦИЯ
В основе пастеризации лежит нагревание жидкостей до температуры меньше 100°С. Целью ее является уничтожение неспороносных бактерий в жидкостях, теряющих питательные свойства при кипячении (молоко, пиво, вино и др.). Осуществляется пастеризация путем нагревания жидкостей при 60°С в течение 30 мин, или при 75°С в течение 15 мин, или при 80°С в течение 10 мин.
ХОЛОДНАЯ СТЕРИЛИЗАЦИЯ
Органические жидкости, не выносящие нагревания, освобождают от бактерий, пропуская через стерильные мелкопористые фильтры. Эти фильтры задерживают микроорганизмы, их называют бактериальными фильтрами.
Бактериальные фильтры имеют разные номера. Фильтры № 1 имеют средний диаметр пор 0,3 мкм и являются наиболее надежными. Фильтры № 5 имеют самые большие отверстия пор, диаметром 1,2 мкм.
Перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в теплую дистиллированную воду и кипятят 30 мин, меняя 2– 3 раза воду.
Рис. 15
Устройство автоклавов:
а – вертикальный автоклав: 1 – подставка, 2 – водомерная трубка, 3 – воронка, 4 – предохранительный клапан, 5 – манометр, 6 – крышка, 7 – винтовые зажимы, 8 – котел, 9 – кожух, 10 – камера стерилизации, 11 – водопаровая камера, 12 – паровыпускной клапан;
б – горизонтальный автоклав: 1 – постамент, 2 – нагревательный элемент. 3 – крышка котла, 4 – предохранительный клапан, 5 – вентиль, 6 – кожух, 7 – паровая камера, 8 – стерилизационная камера, 9 – манометр паровой камеры, 10 – трехходовой кран, 11 – сифонная трубка паровой камеры, 12 – опорное кольцо, 13 – крышка паровой камеры, 14 – штурвал, 15 – впускной кран,
16 – манометр котелка, 17 – трехходовой кран котелка, 18 – сифонная трубка котелка, 19 – патрубок, 20 – воронка, 21 – водоуказательная колонка, 22 – котелок.
Крышку автоклава привинчивают болтами к корпусу. Завинчивают болты попарно, крест-накрест, чтобы избежать перекоса крышки, который может возникнуть при завинчивании болтов по кругу.
Открывают краны и включают источник обогрева. Когда пар из выпускного крана начинает выходить непрерывной струей, его закрывают и наблюдают за постепенным повышением давления в рабочей камере по манометру.
Отсчет времени стерилизации начинают с того момента, когда в автоклаве установится заданное давление.
Таблица 5
Рисунок 3 - Полипропиленовый глубинный фильтр
Фильтры с готовыми фильтрующими элементами характеризуются большой надежностью в работе. Фильтрующие элементы изготавливают из высокоэффективных, механически прочных фильтрующих материалов. Форма и размер фильтрующих элементов зависит от характера фильтрующего материала. Фильтры с готовыми фильтрующими элементами обеспечивают возможность длительной и эффективной работы.
Очистка целевого продукта
Эта стадия необходима при получении очищенного целевого продукта, например, ферментных препаратов степени очистки более двухкратной. Эта стадия приводит к росту себестоимости получаемого целевого продукта. Для проведения процессов ионообмена, перегонки, ректификации, выпаривания, кристаллизации и других в микробиологическом производстве применяют оборудование химической технологии.
Для очистки ферментов применяют избирательную сорбцию (связывание) каолином, трифосфатом кальция, гидроксидом алюминия и другими адсорбентами. Таким образом проводят сорбцию либо фермента, либо балластных белков, которые затем разделяют центрифугированием. Фермент из сорбента отделяют раствором фосфатного буфера.
На последнем этапе продукт отделяют от примесей, концентрируют и стабилизируют. После стабилизации продукта в зависимости от того, каким должен быть конечный продукт: сухим или жидким, его обезвоживают или сразу упаковывают и отправляют на хранение и далее – потребителю.
Выделение и очистка целевого продукта
Продукты микробного синтеза поступают из биореактора в виде водных суспензий или растворов, при этом характерно невысокое содержание основного компонента и наличие многих примесных веществ.
В большинстве промышленных производств на первом этапе переработки культуральной жидкости производят отделение массы продуцента от жидкой фазы - сепарацию. Жидкость далее также подвергается переработке, если содержит метаболиты, представляющие практическую ценность. В производствах, где целевым продуктом являются клетки как источник белка, культуральная жидкость подвергается лишь очистке, позволяющей использовать водную фазу многократно и снизить образование сточных вод.
Технологические приемы, используемые для отделения клеток от среды зависят от природы продуцента. Например, сахаромицеты (хлебопекарные дрожжи) имеют относительно большие клетки и способны флотироваться, поэтому после сгущения биомассы флотацией их отделяют на обычных барабанных вакуум-фильтрах. В дальнейшем биомассу, снятую с фильтра, подвергают прессованию и получают продукт с высоким содержанием живых клеток, имеющих высокую хлебопекарную активность.
Дрожжи же рода Candida, служащие источником кормового белка плохо флотируются и фильтруются. Поэтому дрожжи, растущие на углеводородах, а также бактерии-продуценты белка на основе метана и метанола, на первом этапе сепарируются, причем в несколько ступеней. Оставшаяся вода удаляется путем выпаривания, а все компоненты жидкой фазы остаются в конечном продукте. К аналогичному приему прибегают и при производстве бактериальных энтомопатогенных препаратов и удобрений. Конечный продукт удается получить в активной форме лишь в принципе отказавшись от выделения его из культуральной жидкости: содержимое реактора выпаривают и сушат в условиях, обеспечивающих жизнеспособность конечного продукта. Неутилизированные компоненты культуральной жидкости могут отразиться на способности продукта к хранению.
При выделении и очистке метаболитов биомасса, если она не содержит заметных количеств целевого продукта, осаждается добавлением извести или других твердых компонентов, увлекающих клетки или мицелий на дно - физическое осаждение.
Отделение твердой фазы (мелкодисперсный клеточный материал, внутриклеточные биополимеры возможно и методом фильтрации. Так как фильтруемая суспензия склонная к гелеобразованию, то производительность фильтров быстро падает. Предотвратить это можно добавлением в смесь или на фильтрующую ткань размолотых вулканических пород, содержащих оксиды кремния и алюминия, тогда осадки приобретают пористую структуру.
Некоторые виды биомассы отделяют центрифугированием. Осаждение взвешенных частиц происходит под действием центробежной силы. После разделения образуется 2 фракции: биомасса (твердая) и культуральная жидкость.
Культуральная жидкость перерабатывается путем экстракции, ионообмена, кристаллизации или с помощью микро- и ультрафильтрации через полимерные мембраны со специально подобранным размером пор.
Для выделения и очистки продуктов, находящихся внутри клеток продуцента (например интерферонов, гормонов) вводится стадия разрушения клеточных оболочек (дезинтеграция биомассы); обычно для этого применяются механические, химические или комбинированные методы.
К физическим методам дезинтеграции относятся обработка ультразвуком, вращение лопасти или вибратора, встряхивание со стеклянными бусами, продавливание через узкое отверстие под давлением, раздавливание замороженной клеточной массы, растирание в ступке, осмотический шок, замораживание-оттаивание, декомпресия (сжатие с последующим резким снижением давления).
Химические и химико-ферментативные методы более избирательны. Клетки могут быть разрушены толуолом или бутанолом, антибиотиками, ферментами. Культуральную жидкость освобождают от сопутствующих растворимых веществ и фракционируют.
Освобождение от растворимых веществ производят несколькими способами:
1. Осаждение - физическое (нагревание, охлаждение, разбавление, концентрирование) или химическое (с помощью органических и неорганических веществ).
Осаждение органическими растворителями основано на снижении диэлектрической постоянной среды. Устойчивость белковых растворов обусловлена наличием гидратного слоя у молекулы. Если его разрушить, белки осаждаются. Для этого молекулы добавляемых веществ должны быть более гидрофильны, чем молекулы белков. В качестве осадителей используют этанол, метанол, ацетон, изопропанол. При разных количествах растворителя и разных значения рН осаждаются разные фракции. Пример: 50% этанол осаждает 80% протеазы и 3-5% амилазы, 70% спирт осаждает 98% амилазы.
Высаливание - механизм тот же, что и при действии органических веществ, гидратируются диссоциирующие ионы неорганических солей. Как наиболее дешёвый реагент используют сульфат аммония. Также применяют сульфаты натрия, магния и фосфат калия.
2. Экстракция. При твердожидкофазной экстракции вещество из твердой фазы переходит в жидкую, при жидкожидкофазной - из одной жидкости в другую (например, хлорофилл из спиртовой вытяжки переходит в бензин). Для извлечения антибиотиков, витаминов, каротиноидов, липидов применяют жидкожидкофазную экстракцию, когда культуральную жидкость смешивают с органическими растворителями.
3. Адсорбция - частный случай экстракции, когда экстрагирующий агент - твердое тело. Адсорбция применяется для веществ, имеющих функциональные группы, заряженные положительно или отрицательно. В качестве адсорбента используют иониты на основе целлюлозы: - катионит - карбоксиметилцеллюлоза (КМЦ); - анионит - диэтиламиноэтилцеллюлоза (ДЭАЭ), а также сефадексы на основе декстрана и т.д. Адсорбция идет по ионообменному механизму.
Более тонкую очистку веществ осуществляют несколькими способами.
Наибольшее распространение получила хроматография. Каплю образца наносят на специальную бумагу (хроматография на бумаге) или пластинку стекла или пластмассы, покрытую тонким слоем инертного сорбента, например, целлюлозы или силикагеля (хроматография в тонком слое или тонкослойная хроматография). Затем такую пластинку одним концом помещают в смесь растворителей (например, воды и спирта).
По мере движения растворителей по пластинке, они подхватывают те молекулы образца, которые растворяются в них. Растворители выбирают таким образом, чтобы они связывались сорбентом по-разному. В результате молекулы образца, более растворимые в связанном растворителе, движутся медленнее, а другие, более растворимые в слабо сорбированном растворителе, движутся быстрее. Через несколько часов пластинку сушат, окрашивают и определяют положение различных молекул.
Гель-фильтрация обычно используется и для разделения молекул, и для определения их размеров.
Гораздо более эффективен метод аффинной хроматографии (хроматография по сродству). В основе этого метода лежат биологически важные взаимодействия, происходящие на поверхности белковых молекул. При аффинной хроматографии используется нерастворимый матрикс, ковалентно связанный со специфичными лигандами (антителами или субстратом ферментов), которые присоединяют определенный белок.
Экстракты разрушенных клеток можно фракционировать, подвергая их высокоскоростному центрифугированию. Такая обработка делит клеточные компоненты по их размеру: более крупные частицы при центрифугировании движутся быстрее. Крупные компоненты экстракта, в том числе ядра или неразрушенные клетки, быстро оседают (седиментируют) при относительно низких скоростях и образуют осадок на дне центрифужной пробирки. Центрифугирование является, как правило, первым этапом фракционирования, с его помощью разделяются только значительно отличающиеся по размеру компоненты. Чтобы достигнуть более высокой степени разделения фракций, необходимо гомогенат наслоить тонким слоем поверх солевого раствора.
При ультрацентрифугировании различные фракции седиментируют с различной скоростью и образуют отдельные полосы, которые можно выделить. Во избежание перемешивания осажденных компонентов солевой раствор должен содержать инертный и хорошо растворимый материал (например, сахарозу), плотность которого постепенно увеличивается сверху вниз, формируя градиент плотности. При седиментации сквозь такие градиенты сахарозы различные компоненты клетки собираются в отдельные полосы, которые можно выделить.
Электрофорез - метод разделения белков и нуклеиновых кислот в свободном водном растворе и пористом матриксе, в качестве которого можно использовать полисахариды, например, крахмал или агарозу. Биомолекулы обычно несут суммарный положительный или отрицательный заряд, обусловленный наличием на их поверхности положительно или отрицательно заряженных групп аминокислот.
22 Аппаратурное оформление стадий выделения, концентрирования, очистки и сушки БАВ.
Культуральная жидкость, образующаяся в процессе ферментации, представляет собой сложную многофазную систему: в водной фазе содержатся клетки продуцента, продукты их жизнедеятельности, непотребленные компоненты питательной среды, мельчайшие капельки жира, пузырьки воздуха, как правило, мел. В свою очередь водная фаза культуральной жидкости (нативный раствор) включает большое (число органических и неорганических веществ, коллоидных фракций белков, сухой остаток культуральной жидкости — до 17% и более; содержание биомассы в культуральной жидкости достигает 8—10%. Концентрация целевого продукта чаще всего не превышает 1,5%, что составляет менее 10% сухого остатка.
Взависимости от целевого назначения конечного продукта (для здравоохранения, технических целей, сельского хозяйства и т. д.) реализуют различной степени сложности схемы производства, при этом учитывают и место накопления целевого продукта — внутриклеточно или внеклеточно.
Если способы выделения целевых продуктов можно разделить на несколько типовых групп (рис. 106), то очистка каждого из них практически индивидуальна, поскольку зависит от физико-химических свойств конкретного вещества.

Рисунок 5.1 – Возможные способы выделения целевого продукта
Примером наиболее простой схемы может служить производство биовита (кормового антибиотика), базирующегося на использовании продуцента антибиотика хлортетрациклина. Кальциевый комплекс хлортетрациклина осажадают из культуральной жидкости при рН выше 7,0. Формирующийся при этом осадок увлекает с собой и клетки продуцента. Так в осадке вместе с биомассой оказываются внеклеточный антибиотик и внутриклеточный витамин B12. Осадок фильтруют, высушивают, размельчают, добавляют отруби в качестве наполнителя и фасуют. Этот комплекс используют в качестве добавки к корму для скота.
ОБЩАЯ БИОТЕХНОЛОГИЯ
Современное состояние и перспективы развития биотехнологии

С древних времен известны отдельные биотехнологические процессы, используемые в сферах практической деятельности человека. К ним относятся хлебопечение, виноделие, пивоварение, приготовление кисломолочных продуктов и т. д. Наши предки не имели представления о сути процессов, лежащих в основе таких технологий, но в течение тысячелетий, используя метод проб и ошибок, совершенствовали их. Биологическая сущность этих процессов была выявлена лишь в XIX в. благодаря научным открытиям Л. Пастера. Его работы послужили основой для развития производств с использованием разнообразных видов микроорганизмов. В первой половине XX в. стали применять микробиологические процессы для промышленного получения ацетона и бутанола, антибиотиков, органических кислот, витаминов, кормового белка.
Успехи, достигнутые во второй половине XX в. в области цитологии, биохимии, молекулярной биологии и генетики, создали предпосылки для управления элементарными механизмами жизнедеятельности клетки, что способствовало бурному развитию биотехнологии. Благодаря селекции высокопродуктивных штаммов микроорганизмов, эффективность биотехнологических процессов увеличилась в десятки и сотни раз.
Особенностью биотехнологии является то, что она сочетает в себе самые передовые достижения научно-технического прогресса с накопленным опытом прошлого, выражающимся в использовании природных источников для создания полезных для человека продуктов. Любой биотехнологический процесс включает ряд этапов:
подготовку объекта, его культивирование, выделение, очистку, модификацию и использование полученных продуктов. Многоэтапность и сложность процесса обусловливает необходимость привлечения к его осуществлению самых разных специалистов: генетиков и молекулярных биологов, цитологов, биохимиков, вирусологов, микробиологов и физиологов, инженеров-технологов, конструкторов биотехнологического оборудования и др.
Дата: 2019-07-30, просмотров: 783.