Печеночная недостаточность (ПН) характеризуется снижением одной, нескольких или всех функций печени ниже уровня, необходимого для обеспечения нормальной жизнедеятельности организма. ПН делится на виды по следующим признакам:
1) по числу нарушенных функций - на парциальную и тотальную,
2) по течению - на острую и хроническую,
3) по исходу - летальную и нелетальную.
Причины печеночной недостаточности. Можно выделить две группы причин печеночной недостаточности.
К первой группе относятся патологические процессы, локализующиеся в печени и в желчевыделительных путях, а именно:
а) гепатиты - вирусные, бактериальные, токсогенные;
б) дистрофии (гепатозы);
в) циррозы;
г) опухоли печени;
д) паразитарные поражения ее;
е) генетические дефекты гепатоцитов;
ж) камни, опухоли, воспаления желчевыделительных путей с выраженным холестазом.
Ко второй группе причин относятся патологические процессы вне печени, а именно:
а) шок, в том числе послеоперационный;
б) сердечная недостаточность;
в) общая гипоксия;
г) почечная недостаточность;
д) белковое голодание;
е) гипоавитаминоз E;
ж) дефицит селена;
з) эндокринопатии - в частности, острая недостаточность надпочечников;
и) метастазы опухолей в печень.
Патогенез печеночной недостаточности. Общий патогенез ПН может быть представлен в виде следующей цепи изменений: действие повреждающего фактора → 1) изменение молекулярной архитектоники мембран гепатоцитов → 2) усиление свободнорадикального перекисного окисления липидов (ПОЛ) → 3) частичная или полная деструкция мембран + повышение их проницаемости → 4) выход из лизосом их гидролаз, что потенцирует повреждение мембран клеток → 5) освобождение поврежденными макрофагами некрозогенного фактора и интерлейкина 1, способствующих развитию воспалительной и иммунной реакции в печени → 6) образование аутоантител и аутосенсибилизированных T-киллеров, вызывающих дополнительное аутоаллергическое повреждение гепатоцитов.
Каждое из перечисленных патогенетических звеньев может стать на определенной стадии развития печеночной недостаточности доминирующим, что должно быть учтено при выборе ее терапии.
Проявления и механизмы печеночной недостаточности:
1. Нарушение участия печени в углеводном обмене. Оно заключается в снижении способности гепатоцитов, с одной стороны, превращать глюкозу в гликоген, а с другой - расщеплять гликоген до глюкозы. Это обусловливает характерный признак ПН - неустойчивый уровень сахара крови. После приема пищи развивается гипергликемия, а натощак - гипогликемия.
2. Нарушение участия печени в липидном обмене. Оно характеризуется снижением способности гепатоцитов:
а) превращать более атерогенную форму холестерина (свободный холестерин) в менее атерогенный холестерин-эстер и б) образовывать фосфолипиды, обладающие антиатерогенным действием.
Оба эти изменения ведут к увеличению в крови уровня свободного холестерина и к снижению антиатерогенных фосфолипидов, что способствует отложению холестерина в стенках сосудов и развитию атеросклероза.
3. Нарушение участия печени в белковом обмене. Включает три вида изменений:
а) снижение синтеза гепатоцитами альбуминов, что ведет к гипоальбуминемии и гипоонкии крови, а на стадии развития портальной гипертензии способствует развитию асцита;
б) уменьшение биосинтеза ферментов и белков - прокоагулянтов (протромбина, проакцелерина, проконвертина), что обусловливает развитие коагулопатий, характеризующихся склонностью к кровоточивости. Этому способствует также уменьшение всасывания в кишечнике жирорастворимого витамина K, поскольку ПН сочетается с нарушением желчеобразовательной и желчевыделительной функций печени;
в) снижение активности процесса дезаминирования аминокислот и синтеза мочевины из аминогрупп и аммиака, что ведет к снижению в крови содержания мочевины.
4. Нарушение биосинтеза гепатоцитами ферментов. Заключается в уменьшении секреции гепатоцитами в кровь образуемых ими ферментов (холинэстеразы, НАД и др.). Кроме того, повреждение гепатоцитов сопровождается увеличением выхода из них в кровь внутриклеточных ферментов: аланинаминотрансферазы и глютаматаминотрансферазы.
5. Расстройство обмена витаминов. Состоит в:
а) снижение всасывания в кишечнике жирорастворимых витаминов A, D, E, K;
б) уменьшении способности гепатоцитов превращать провитамины в активные витамины (например, каротин в витамин A);
в) торможении процесса образования из витаминов коферментов (например, из пантотеновой кислоты - ацетил коэнзим A, из витамина B1 - кокарбоксилазы пирувата).
Все перечисленные изменения ведут к развитию эндогенных (печеночных) гиповитаминозов.
6. Нарушение антитоксической ("барьерной") функции печени. Оно характеризуется снижением обезвреживания печенью: а) кишечных ядов - фенольных ароматических соединений (фенола, индола, скатола), биогенных аминов (кадаверина, путресцина, тирамина), аммиака;
б) ядовитых метаболитов: низкомолекулярных жирных кислот (валериановой, капроновой), метилированных и аминных производных серусодержащих аминокислот (тауриновой, цистамина, метионина), токсического производного пирувата - ацетонина;
в) экзогенных ядов (грибкового, микробного, паразитарного происхождения, ядохимикатов и др.); снижается также инактивация купферовскими (зведчатыми) клетками коллоидальных частиц и микробов.
7. Нарушение образования и секреции печенью желчи, что ведет к развитию желтух.
Финалом нарастающей печеночной недостаточности является печеночная кома.
Эксперименты на печени.
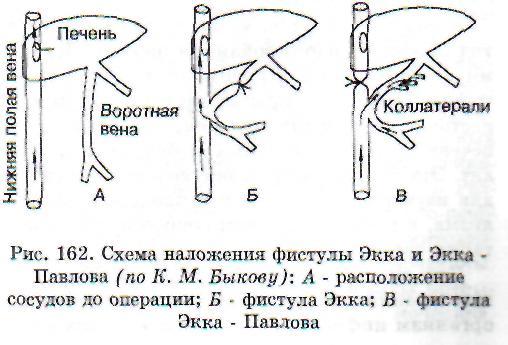
Наложение фистулы Экка - метод, примененный в 1877 г. русским исследователем Экком в лаборатории Н.В. Тарханова. Он заключается в следующем: между нижней полой и воротной венами у собак создается анастомоз. Воротная вена выше соустья перевязывается и вся кровь, оттекающая из органов брюшной полости, поступает непосредственно в нижнюю полую вену, минуя печень (рис. 162). Этот эксперимент позволил изучить обезвреживающую, а также мочевинообразовательную функции печени.
После операции Экка у животных уже через 3-4 дня при кормлении мясной пищей или через 10-12 дней при использовании молочно-растительной диеты, появлялись атаксия, манежные движения, периодически клонические и тонические судороги. В крови нарастало содержание аммиака, который в норме обезвреживается в печени, уменьшался синтез белков, нарушался обмен холестерина и образование желчи.
Обратная фистула Экка - Павлова. В 1893 г. И.П. Павлов предложил после наложения соустья на воротную и нижнюю полую вены перевязывать выше соустья не воротную, а нижнюю полую вену. При этом в печень устремляется кровь не только из пищеварительного тракта по воротной вене, но и из задней половины туловища. Животные с такой фистулой живут годами. На этой экспериментальной модели изучается функциональное состояние печени в разных условиях пищевой нагрузки.
Полное удаление печени. Производится в два приема. Вначале воспроизводится обратная фистула Экка - Павлова. Последствием этой опера-
579
ции является развитие коллатерального кровообращения. В результате часть венозной крови из задней части тела через v. azygos и внутренние грудные вены отводится в верхнюю полую вену, минуя печень. Через 3-4 недели после первой операции проводят вторую: воротная вена перевязывается и печень удаляется. В ближайшие часы после удаления печени у собак появляется мышечная слабость, адинамия, резко понижается содержание сахара в крови и при снижении его ниже 2,5 ммоль/л возможно развитие гипогликемической комы с последующей гибелью животного. Введением глюкозы можно несколько продлить жизнь животного. Одновременно в крови нарастает количество аммиачных соединений и понижается содержание мочевины. Собаки после такой операции живут не более 12-15 часов. Удаление печени является, по существу, экспериментальной моделью печеночной комы. После частичного удаления печени (до 3/4 органа) очень резких нарушений обмена не происходит ввиду того, что оставшаяся часть печени сохраняет свои функции и реализует компенсаторные возможности.
При изучении функциональной роли печени в норме и при патологии применяется также ангиостомический метод Е. С. Лондона, предложенный в 1919 г. К стенкам крупных кровеносных сосудов (воротная и печеночная вены) пришиваются металлические канюли (нержавеющие или серебряные), свободные концы которых выводятся через покровы брюшной стенки наружу. Канюли позволяют систематически брать кровь из сосудов и вводить в них различные вещества. Метод ангиостомии дал много ценного в изучении роли печени в билирубино-образовании, углеводном, белковом, жировом и солевом обменах.
Экспериментальной моделью является и метод перфузии изолированной печени. Донорами печени являются преимущественно лабораторные животные: крысы, кролики, кошки. В настоящее время для этих целей используется и печень крупных животных: собак, свиней и телят. Эта экспериментальная модель применима для изучения роли печени в процессах метаболизма, а также в решении вопросов трансплантации органа.
Для экспериментального воспроизведения заболеваний печени пользуются введением в организм инфекционных и токсических агентов. Сильным гепатотропным ядом является СС14 (четыреххлористый углерод). Парентеральное введение 0,2 мл/100 г 80% масляного раствора этого вещества вызывает альтерацию и некробиоз гепатоцитов в центральных зонах печеночных долек. Для указанных целей используют также хлороформ, семена гелиотропа. Жировой гепатит воспроизводится путем введения сернокислого гидразина и алкоголя. Токсическое действие алкоголя на печень выражается в сосудистых расстройствах и очаговых дистрофически-деструктивных изменениях паренхимы.
Вопрос 13.
Дата: 2019-07-30, просмотров: 428.