Общие кинетические закономерности протекания элементарных реакций не зависят от того, какие именно частицы — молекулы, свободные радикалы, ноны или комплексы — принимают участие в элементарном акте, каким образом и сколько связей разрывается или образуется в результате элементарного акта. Все эти факторы, однако, существенным образом определяют значения констант скорости или, точнее, энергий активации и предэкспоненциальных множителей, а также характер влияния среды, в которой происходит реакция, на значение кинетических параметров реакции.
В любой химической реакции происходит разрыв одних и образование других химических связей. Исключением являются лишь некоторые простейшие случаи реакции переноса электрона между частицами, например окислительно-восстановительные превращения ионов металлов:
Me1 n+ + Me2m+→Me1(n-1)+ + Me2(m+1)+ (6.1)
Формально не сопровождается разрывом химических связей взаимопревращение пространственных изомеров, например цистрансизомеризация замещенных этил снов. Фактически же при этом в ходе элементарного акта должен произойти разрыв π-связи между атомами, образующими кратную связь, чтобы обеспечить возможность поворота вокруг сохраняющейся σ-связн.
Разрыв и образование двухэлектронных связей может осуществляться по двум различным механизмам—с разрывом и без разрыва электронных пар.
Химические процессы, сопровождающиеся разрывом некоторых из существующих или образованием новых электронных пар, называются гомолитическими. Примером может служить реакция атома водорода с молекулой хлора
Ĥ + С1:С1→Н:С1 + С1 (6.2)
Химические процессы, в которых образование и (или) разрушение двухэлектронных связей идет без образования и разрыва электронных пар, называются гетеролитическими.
В качестве иллюстрации можно привести гидролиз йодистого метила:
СН3: I + :ОН- → С H 3 :ОН + I - (6.3)
В этом случае электронная пара, с участием которой была образована разрываемая связь С—I, остается у атома иода, превращающегося в ион I-, а новая связь С—О образуется с участием неподеленной пары электронов атома О, входящего в состав иона ОН-.
Общим для гомолитических и гетеролитических реакции является взаимопревращение атомных и молекулярных орбиталей. В реакции атома водорода с молекулой хлора молекулярная σ-орбиталь, образованная Зр-орбиталями атомов CI, и атомная ls-орбиталь атома Н превращаются в молекулярную σ-орбиталь молекулы HCI и атомную Зр-орбиталь атома CI. В реакции гидролиза йодистого метила атомная орбиталь, на которой находится неподеленная пара электронов в ионе ОН- и молекулярная σ-орбиталь, образованная из р-орбитали атома I и одной из sp3-гибридных орбиталей атома С, превращаются в атомную орбиталь иона I- с неподеленной парой электронов и новую σ-орбиталь, образующую связь С—О. Фактически эти реакции классифицированы соответственно как гомолитическая и гетеролитическая потому, что в первом случае на атомной орбитали, участвующей во взаимопревращениях орбиталей, находился неспаренный электрон, а во втором — неподеленная пара электронов.
Наряду с этим возможны реакции, в которых происходит синхронное превращение нескольких молекулярных орбиталей в несколько новых молекулярных орбиталей. Такие реакции получили название согласованных реакций.
Примером такой реакции может служить распад бромистого этила на этилен и бромистый водород:
CH 5 Br → CH 4 + HBr (6.4)
В ходе этой реакции молекулярные орбитали, образовывавшие σ-связн С—Н и С -Вr в исходном бромистом этиле, переходят в новые молекулярные орбитали — π-орбиталь этилена и σ- орбиталь молекулы НВr. В этом случае четыре электрона переходят со старых орбиталей на новые, но нет никаких оснований говорить ни о разрыве, ни о сохранении электронных пар и тем самым классифицировать процесс как гомолитический или гетеролитический.
При образовании активированного комплекса в той или иной мере затрагивается большое число атомов и химических связей в реагирующих частицах, а в случае реакций в растворах — и окружающих молекул растворителя. Например, в реакции гидролиза йодистого метила разрывается связь С—I и образуется связь С—О. Однако, помимо этого, при образовании активированного комплекса изменяется тип гибридизации молекулярных орбиталей связей С—Н, изменяется полярность связи О—Н и, существенной перестройке подвергаются сольватные оболочки вокруг реагирующих частиц. Тем не менее основными участниками химического превращения в этой реакции являются атомы С, I и О, и совокупность этих атомов можно рассматривать как реакционный центр активированного комплекса (можно изобразить этот реакционный центр в виде I***C***O. Реакционные центры различаются по числу формирующих их атомов. В зависимости от этого активированный комплекс называют двухцентровым, трехцентровьш и т. п. Связи между атомами в реакционном центре могут образовывать незамкнутую или замкнутую линию. В зависимости от этого активированный комплекс называют линейным или циклическим. В рассмотренном выше примере реакция гидролиза йодистого метила идет через линейный трехцентровый активированный комплекс.
В реакции распада бромистого этила на этилен и бромистый водород основными участниками химического превращения являются атомы С, один из атомов Н и атом Вг, и реакционный центр активированного комплекса можно изобразить в виде
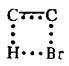
Это пример четырехцентрового циклического активированного комплекса.
Реакциями, идущими через активированный комплекс с двухатомным реакционным центром, являются реакция диссоциации частицы на две или обратная ей реакция рекомбинации частиц. Общая схема такой реакции может быть записана в виде
А—В↔А… B ↔ A + B (6.5)
Простейшим типом реакций, идущих через трехцентровый линейный активированный комплекс, являются реакции типа
А—В + С↔А – В…С↔А + В—С (6.6)
Такие реакции обычно называют реакциями замещения при соответствующем атоме во фрагменте В. Примером такой реакции является реакция гидролиза йодистого метила, которая представляет собой реакцию замещения при углеродном атоме радикала СН3. В случае если В является атомом, а не радикалом, то обычно говорят о реакции отрыва атома. Например, реакция
СН4 + С1→СН3 + НС1 (6.7)
является реакцией отрыва атома Н от молекулы метана атомом CL К этому же типу реакций относятся реакции переноса протона
В + НА → ВН+ +А- (6.8)
лежащие в основе всех кислотно-основных равновесий.
Если в (6.6) связь между А и В кратная, то образуются не две, а одна частица:
А=В +С ↔ А — В…С↔А—В—С (6.9)
В этом случае говорят о присоединении частицы С по двойной связи А=В. Обратную реакцию — отщепление С от ABC с образованием π-связи — называют элиминированием.
В реакционном центре линейного активированного комплекса может принимать участие и большее число атомов. Так, через четырехцентровый активированный комплекс идут реакции образования свободных радикалов при взаимодействии двух валентно-насыщенных молекул по общей схеме
А—В+С— D ↔ A ...В...С… D → A + B - C + D ' (6.10)
или в случае, когда одна из разрываемых связен двойная, по схеме
A — B + C = D ↔ A …В…С… D ↔ A + B —С— D (6.11)
По схеме, обратной (6.11), идут реакции диспропорционирования свободных радикалов, например:
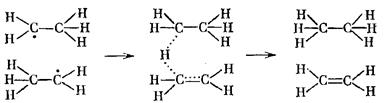
В циклическом активированном комплексе может также участвовать большое число атомов. Например, в комплексе глюкозы с α-оксипиридином
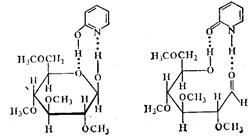
при переходе глюкозы из пиранозной формы в нециклическую синхронно разрываются четыре связи и образуются четыре новые связи. В результате этой реакции проходит мутаротация глюкозы, г. е. обращение конфигурации у первого углеродного атома. Этим объясняется сильное каталитическое действие α-оксипиридина в реакции.
Активированный комплекс одного и того же типа может реализоваться в случае как гомолитического, так и гетеролитического процесса. Например, реакции (6.3) и (6.7) идут через линейный трехцентровый активированный комплекс по типу (6.6). Однако первый процесс является гетеролитическим - связь С—I разрывается с переходом пары электрона на атом I, а новая связь С—О завязывается с участием неподеленной пары электронов ОН-. Второй процесс, наоборот, является гомолитическим — двухэлектронная связь Н—С1 образуется с участием неспаренного электрона атома Сl и одного из 1S-электронов атома Н, участвующего в образовании связи С—Н. Электронная пара, образующая эту связь, при этом разрывается и второй электрон остаётся в виде неспаренного электрона на атоме С свободного метила.
Дата: 2019-07-30, просмотров: 342.