Для мономолекулярной реакции скорость реакции определяется концентрацией молекул вещества А:
v = k *[ A ]
где k — коэффициент пропорциональности, который называется константой скорости реакции; [А] — молярная концентрация вещества А.
В случае бимолекулярной реакции, ее скорость определяется концентрацией молекул не только вещества А, но и вещества В:
v = k *[ A ]*[ B ]
В случае тримолекулярной реакции, скорость реакции выражается уравнением:
v = k *[ A ]2*[ B ]
В общем случае, если в реакцию вступают одновременно т молекул вещества А и n молекул вещества В, т. е.
тА + пВ = С,
уравнение скорости реакции имеет вид:
v = k *[ A ] m *[ B ] n
Это уравнение есть математическое выражение закона действующих масс в общем виде.
Чтобы понять физический смысл константы скорости реакции, надо принять в написанных выше уравнениях, что [А] = 1 моль/л и [В] = 1 моль/л (либо приравнять единице их произведение), и тогда v = k. Отсюда ясно, что константа скорости k численно равна скорости реакции, когда концентрации реагирующих веществ (или их произведение в уравнениях скорости) равны единице.
Общее выражение для скорости химической реакции получено для данной, фиксированной температуры. В общем же случае, поскольку скорость реакции зависит от температуры, закон действующих масс записывается как
v ( T ) = k ( T ) *[ A ] m *[ B ] n
где v и k являются функциями температуры.
Константа скорости химической реакции, ее зависимость от температуры
Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается, причем для реакций в гомогенных системах при нагревании на каждые десять градусов скорость реакции возрастает в 2—4 раза (правило Вант-Гоффа).
Это правило связано с понятием температурного коэффициента скорости реакции γ и определяется соотношением
γ = kТ+10 / kТ
Значение температурного коэффициента γ дает возможность рассчитать изменение скорости реакции при увеличении температуры на некоторое число градусов от Т1 до Т2 по формуле
v(Т1)/v(Т2) = γ(Т2-Т1)/10
Очевидно, что при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической.
Энергия активации
С. Аррениус впервые показал, что влияние температуры сводится к увеличению числа активных молекул, т. е. таких молекул, которые в момент столкновения обладают энергией, не меньше определенной для данной реакции величины, называемой энергией активации химической реакции.
Энергия активации — это некоторое избыточное количество энергии (по сравнению со средней), необходимое для вступления молекул в реакцию.
Согласно Аррениусу, константа скорости химической реакции зависит от температуры экспоненциально:
k = A * e - E /( RT )
Здесь Е — энергия активации (Дж/моль), R — универсальная газовая постоянная, T — температура в К,
А — константа.
Явление катализа
Одно из наиболее сильных средств воздействия на скорость химических реакций — использование катализаторов.
Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Влияние катализаторов на скорость реакции называется катализом. Когда взаимодействующие вещества и катализатор находятся в одном агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных агрегатных состояниях: обычно катализатор — в твердом, а реагирующие вещества — в жидком или газообразном (пример: в случае окисления SO2 в SO3 в присутствии платины или оксида ванадия (V) происходит гетерогенный катализ).
Обратимые реакции
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении.
Например, если смешать пары иода с водородом при температуре 200°С, то произойдет реакция:
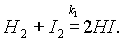
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:
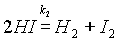
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях. называются обратимыми.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:
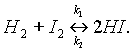
Реакцию, протекающую слева направо называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
Химическое равновесие
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реация в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Дата: 2019-07-30, просмотров: 369.