Константа равновесия, степень превращения
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как
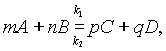
согласно закону действующих масс, скорости прямой реакции v1 и обратной v2 соответственно запишутся следующим образом:
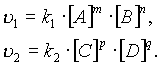
В момент достижения состояния химического равновесия скорости прямой и обратной реакций равны:
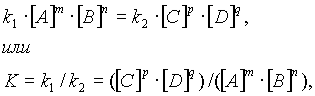
где К — константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций.
В правой части первого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, — равновесные концентрации.
Второе уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии.
Этот закон является одним из наиболее важных в химии. Исходя из кинетического уравнения любой химической реакции, можно сразу же записать отношение, связывающее равновесные концентрации реагирующих веществ и продуктов реакции. Если определить константу К экспериментально, измеряя равновесные концентрации всех веществ при данной температуре, то полученное значение можно использовать в расчетах для других случаев равновесия при той же температуре.
Численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик, так как при этом
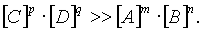
Понятно, что при К << 1 выход реакции мал.
Принцип Ле Шателье
Состояние химического равновесия при неизменных внешних условиях может сохраняться сколь угодно долго. В действительности же реальные системы обычно испытывают различные воздействия (изменение температуры, давления или концентрации реагентов), выводящие систему из состояния равновесия. Как только в системе нарушается равновесие, скорости прямой и обратной становятся неодинаковыми и в системе преимущественно протекает процесс, который приводит ее к состоянию равновесия, но уже отвечающему новым условиям. Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия — принципом Ле Шателье.
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Внешнее воздействие на систему изменяет соотношение между скоростями прямого и обратного процесса, благоприятствуя тому из них, который противодействует внешнему влиянию.
Принцип Ле Шателье универсален, так как применим не только к чисто химическим процессам, но и к физико-химическим явлениям, таким, как кристаллизация, растворение, кипение, фазовые превращения в твердых телах.
Дата: 2019-07-30, просмотров: 353.