Содержание
1. Введение
1.1. Общие сведения
1.2. Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1. Из карбоновых кислот (реакция этерификации)
3.2. Из хлорангидридов кислот
3.3. Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5. Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6. Из нитрилов
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
3.8. Из лактонов и спиртов (реакция переэтерификации)
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
3.10. Из солей при взаимодействии с алкилгалогенидами
3.11. Из солей и кислот и других алкилирующих агентов
3.12. Из медных солей
3.13. Из тетраалкиламмоиевых солей
3.14. Из амидов
3.15. Из тригалогензамещенных
3.16. Из дигалогензамещенных простых эфиров
3.17. Из карбоновых кислот и дивинилртути
3.18. Механизм реакции этерификации
4.Выводы
Список литературы
Введение
Общие сведения
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Практическое применение
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии H2SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
Синтезы изобутилацетата
Способ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Из хлорангидридов кислот

Этот метод синтеза находит широкое применение, поскольку эта реакция необратима в отличие от реакции этерификации. Выделяющийся при реакции хлористый водород можно уводить из сферы реакции или поглощать его каким-нибудь основанием, например едким натром, диметиланилином или пиридином, или магнием. Иногда желательно применение алкоголята натрия. Диметиланилин и магний применяют для. получения эфиров третичных спиртов, имеющих тенденцию в отсутствие вещества, способного поглощать выделяющийся хлористый водород, образовывать галогенпроизводные. При этерификации фенолов часто применяют магний; эта реакция исследована количественно. Наиболее высокие выходы фениловых эфиров получают из таллиевых солей фенолов и хлорангидрида соответствующей кислоты.
Простейший метод — метод Шоттена — Баумана, состоящий во встряхивании хлорангидрида кислоты с водным раствором едкого натра, содержащим соответствующий спирт. Самые высокие выходы получаются тогда, когда хлорангидрид кислоты (и образующийся эфир) нерастворимы в воде, так что реакция протекает на границе раздела между органическим и водным слоем. Нерастворимость образующегося сложного эфира в водной фазе препятствует его омылению. По окончании реакции эфир получается свободным от хлорангидрида кислоты и хлористого водорода и его можно сразу экстрагировать и сушить. В довольно старом и незаслуженно забытом
Исследовании реакции Шоттена — Баумана было установлено, что (выходы сложных эфиров возрастают при понижении температуры Макции, при увеличении концентрации спирта (что можно осуществлять, добавляя щелочь постепенно) и при применении едкого кали, а не едкого натра. Кроме того, ангидрид уксусной кислоты дает более высокий выход эфира, чем хлорангидрид. Наиболее общим методом служит метод, в котором используют пиридин; если бы не неудобства, связанные с необходимостью избавляться от следов пиридина, который обычно отмывают разбавленной кислотой, вероятно, применяли бы только этот метод.
Эффективность реакции галогенангидридов кислот со спиртами может быть повышена проведением предварительной реакции галогенангидрида с кислотой Льюиса с целью получения соли ацилия. Простейшей такой солью является, по-видимому, метилоксокарбонийгексафторантимонат, который сам по себе или в нитрометане быстро реагирует со спиртами, образуя ацетаты с выходами от 62 до 87%.
Эта реакция, вероятно, происходит в результате нуклеофильной атаки спирта на атом углерода карбонила хлорангидрида кислоты.
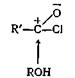
Образующийся при этом комплекс быстро теряет хлористый водород, давая сложный эфир R'COOR.
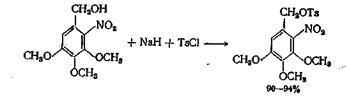
В случае образования реакционноспособных и нестабильных бензилтозилатов желательно сначала получить соответствующий алкоголят с гидридом натрия, а затем обрабатывать его хлор ангидридом кислоты. Аналогичный метод, но без выделения алкоголята натрия, применялся для получения тозилата 2-нитро-3,4,5-триметок-сибензилового спирта, в котором гидроксил спирта прочно связан с нитрогруппой.]
Многие функциональные группы при этом методе синтеза не затрагиваются. В хлорангидридах кислот, содержащих двойные связи, ацетокси- , алкиламино- и 2-фуранакрилогруппы, эти группы не изменяются. Оксиэфиры можно получать из двухатомных спиртов и хлорангидридов кислот; аналогичным образом хлорзамещенные сложные эфиры можно получать из галогендоинов. При этом часто получают высокие выходы
Из ангидридов кислот
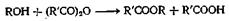
Или
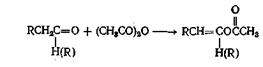
Как и хлорангидриды кислот, ангидриды кислот широко применяют для получения сложных эфиров из соединений, содержащих оксигруппу. Эту реакцию проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, хлористый цинк, хлорсульфокислота, хлористый ацетил, ацетат натрия. борная кислота, сульфат железа(Ш), метилат натрия и моногидрат я-толуолсульфокислоты. Ацетилирование многих фенолов можно осуществить в водном растворе щелочи, а циклические ангидриды можно полностью или частично этерифицировать. Механизм этой реакции такой же, как и при реакции с хлорангидридом кислоты, только при этом происходит отрыв аниона карбоксилата, а не галоген-аниона. Поскольку анион карбоксилата в растворе менее термодинамически стабилен, чём анион галогена, можно ожидать, что реакция ангидрида кислоты со спиртом будет несколько менее экзотермической, чем реакция соответствующего хлорангидрида. Вопреки тому, что написано в некоторых учебниках, третичные спирты можно этерифицировать ангидридами кислот при применении кислых катализаторов или трифенилметилнатрия.
Способные енолизоваться альдегиды можно превратить в енол-ацетаты нагреванием с уксусным ангидридом и ацетатом калия. Для трех ангидридов, для которых была проведена эта реакция, выходы составляли от 35 до 61%. Способные к енолизации кетоны реагируют не с такой легкостью, но, применяя уксусный ангидрид и л-толуолсульфокислоту, можно добиться успеха. Выходы для трех изученных кетонов составляли от 32 до 68%. Интересно отметить, что в условиях, применявшихся при реакции с кетонами, в реакцию вовлекались только метиленовые водородные атомы. При получении а-бром альдегидов и кетонов в качестве промежуточных соединений используют енолацетаты, как показано ниже:
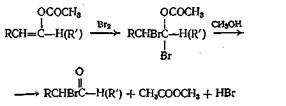
Смешанные ангидриды, получающиеся из алкиловых эфиров хлормуравьиной кислоты, разлагаются при нагревании, образуя сложные эфиры по следующим схемам:
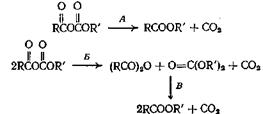
Ряд смешанных ангидридов из алифатических кислот разлагается с образованием сложных эфиров по пути А, а смешанные ангидриды ароматических кислот разлагаются по пути либо А, либо Б. При 250 °С происходит также реакция В. Трифторуксусная кислота и фениловый эфир хлормуравьиной кислоты при смешивании образуют фениловый эфир трифторуксусной кислоты с выходом 75—80%. Рассмотренные реакции декарбоксилирования, по-видимому, протекают через промежуточное циклическое состояние, причем происходит сдвиг электронов в цикле.
Из медных солей
Эта реакция дает возможность осуществить весьма необычный синтез эфиров арилбензойных кислот. При пиролизе медной соли ароматической кислоты образуется с хорошим выходом сложный эфир. Необычным является то, что арильная группа становится в орто-положение по отношению к присутствующей вначале карбоксильной группе, выделяющейся в процессе реакции, как показано ниже:
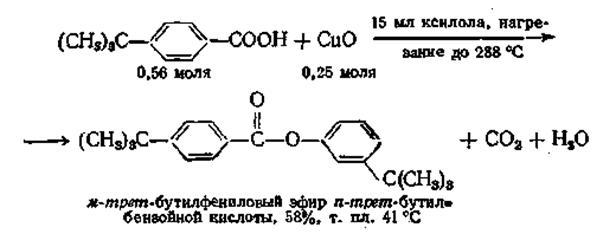
Механизм этой реакции, возможно, представляет собой циклозамещение, но он еще не установлен окончательно. Окись меди частично может быть заменена воздухом.
Из амидов
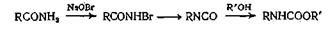
Превращение амидов в сложные эфиры — термодинамически невыгодная реакция и поэтому требует специальных условий. И действительно, реакция легко осуществляется лишь в необычных условиях. В качестве одного из примеров приведем гладкое превращение о- или п-нитроацетанилидов в сложные эфиры при взаимодействии со спиртами в присутствии алкоголята натрия. При этом очевидно, происходит алкоголиз через анион нитроацетанилида.
Амиды можно превратить в изоцианаты реакцией Гофмана с гипобромитом, а изоцианаты затем превратить в карбаматы действием спирта. Поскольку мочевина при нагревании превращается в изоциановую кислоту HN=C=O, она может реагировать со спиртами, образуя в качестве производных сначала изоциановую кислоту, а затем алкилкарбаматы (уретаны). Так, например, бензилкарбамат легко получается при кипячении мочевины и бензилового спирта до прекращения выделения аммиака

Любое соединение, приводящее к образованию изоцианата, является потенциальным источником карбамата, если проводить реакцию каком-нибудь спирте в качестве растворителя. Так, например, : облучении азида кислоты в этиловом спирте образуется уретан
- 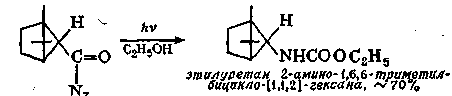 о
о
Из изоциановой кислоты, которая, вероятно, в кислых растворax сначала димеризуется, можно получить эфиры аллофановой кислоты
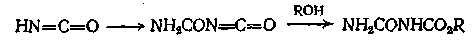
Многие эфиры аллофановой кислоты и целлосольва представляют собой кристаллические соединения и удобны для получения про водных.
Наиболее удобным, хотя и имеющим ограниченное применен методом превращения амида в сложный эфир является перегруппировка р-оксиэтиламида под влиянием концентрированной соляной кислоты
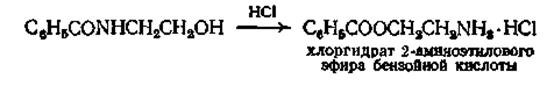
Из тригалогензамещенных
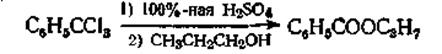
Эта реакция проводилась с различными замещенными бензотрифторидами и бензотрихлоридами, причем выходы составляли от 42 до 90%. Для более лабильных тригалогензамещенных, таких, как 3,3,3-трихлор-1,1-ди-(п-хлорфенил)пропен-1, при кипячении его с метиловым спиртом выход сложного эфира составляет 95%.
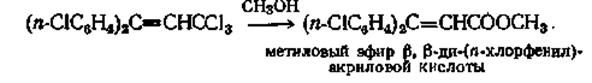
Список литературы
1. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
2. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
3. Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4. Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6. Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7. Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8. Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9. Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
11. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
12. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13. Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
Содержание
1. Введение
1.1. Общие сведения
1.2. Практическое применение
2. Синтезы изобутилацетата
Способ 1. Реакция этерификации
Способ 2. Получение на катионитовых катализаторах
Способ 3. На ионообменных катализаторах
3. Литературный поиск. Сольволиз
3.1. Из карбоновых кислот (реакция этерификации)
3.2. Из хлорангидридов кислот
3.3. Из ангидридов кислот
3.4.Из кетенов, ацетатов кетонов и изотианалей
3.5. Диэфиры или α-замещенные эфиры из карбонильных соединений
3.6. Из нитрилов
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)
3.8. Из лактонов и спиртов (реакция переэтерификации)
3.9. Из сложных эфиров и кислот (реакция переэтерификации)
3.10. Из солей при взаимодействии с алкилгалогенидами
3.11. Из солей и кислот и других алкилирующих агентов
3.12. Из медных солей
3.13. Из тетраалкиламмоиевых солей
3.14. Из амидов
3.15. Из тригалогензамещенных
3.16. Из дигалогензамещенных простых эфиров
3.17. Из карбоновых кислот и дивинилртути
3.18. Механизм реакции этерификации
4.Выводы
Список литературы
Введение
Общие сведения
Изобутилацетат (изобутиловый эфир уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо растворим в органических растворителях, ограниченно растворим в воде. Легко гидролизуется в присутствии кислот и щелочей. Молекулярная масса 116.16; температура кипения 116.5°C; температура плавления -98.9°C; nd20 1.3901.
Практическое применение
Изобутилацетат широко применяется в качестве растворителя перхлорвиниловых, полиакриловых и других лакокрасочных материалов; растворителя нитро-, этил- и ацетилцеллюлозы, хлоркаучука, натуральных и синтетических смол, растительных масел, жиров; экстрагента душистых веществ; компонента фруктовых эссенций и парфюмерных композиций;
В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. Потребление в парфюмерии и косметике синтетических веществ в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Изобутилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт).
В промышленности изобутилацетат синтезируют прямой этерификацией уксусной кислоты изобутиловым спиртом при 100-110°C в присутствии H2SO4 по непрерывной схеме. Изобутилацетат отгоняют в виде тройного азеотропа с водой и спиртом.
Синтезы изобутилацетата
Способ 1. Реакция этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин., охлаждают льдом, приливают эфирный раствор 35 г уксусного ангидрида и снова кипятят несколько минут. Через 12 ч реакционную массу выливают в лед, смесь слабо подкисляют и извлекают эфиром. Вытяжку промывают раствором соды, сушат, отгоняют эфир и остаток перегоняют. В технике реакцию ведут в автоклавах, а вместо бромистого этила применяют хлористый метил, хлористый этил или хлористый бензил.
Дата: 2019-07-30, просмотров: 345.