Статистический метод – В основу лежат фундаментальные законы с начала термодинамики, полученные из обобщения опытных фактов
Термодинамическая система – совокупность макроскопических тел для рассмотрения.
Параметры состояния: T, V, P
Равновесное состояние – это состояние, в котором параметры состояния имеют определенно одинаковые во всех частях системы значения
Равновесный процесс – это процесс, который происходит бесконечно медленно
Идеальный газ – это газ, подчиняющийся 3 элементарным газовым законам
Уравнение состояния идеального газа – это уравнение связывающее любой параметр термодинамической системы с признаками термодинамической системы. t(P,V,T)=ẟ
PV = Ꝩ RT
ВОПРОС 21
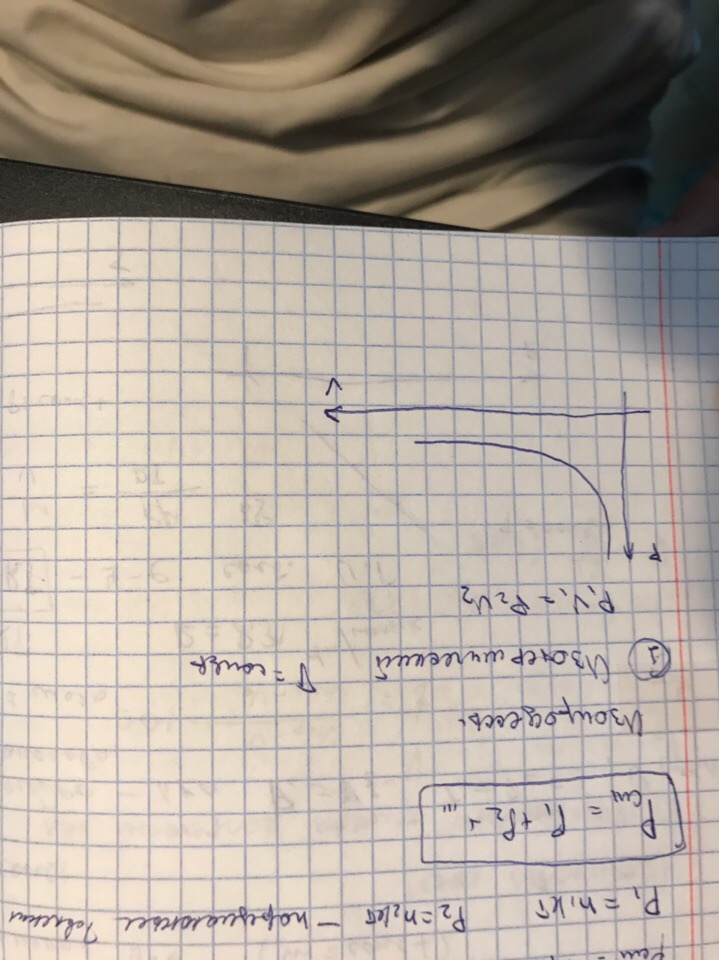
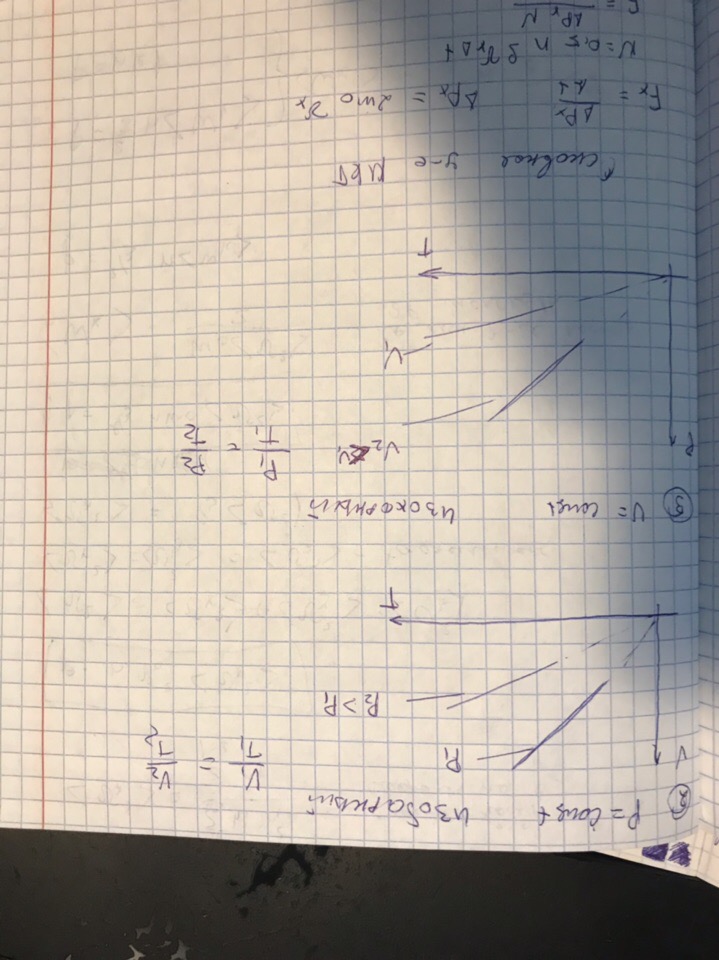
Изотермический, изохорический и изобарический процессы идеального газа. Плотность идеального газа. Связь между давлением, концентрацией и температурой.
PV = Ꝩ RT P = nkT n = N / V - Связь между давлением, концентрацией и температурой.
Ꝭ=m/V=pµ/RT – плотность газа

Изопроцессы:
ВОПРОС 22
Основное уравнение молекулярно – кинетической теории идеальных газов.

ВОПОС 23 Связь между средней кинетической энергией поступательного движения молекул и температурой. Физический смысл температуры. Понятие числа степеней свободы молекулы. Теорема Больцмана о равнораспределении энергии по степеням свободы.
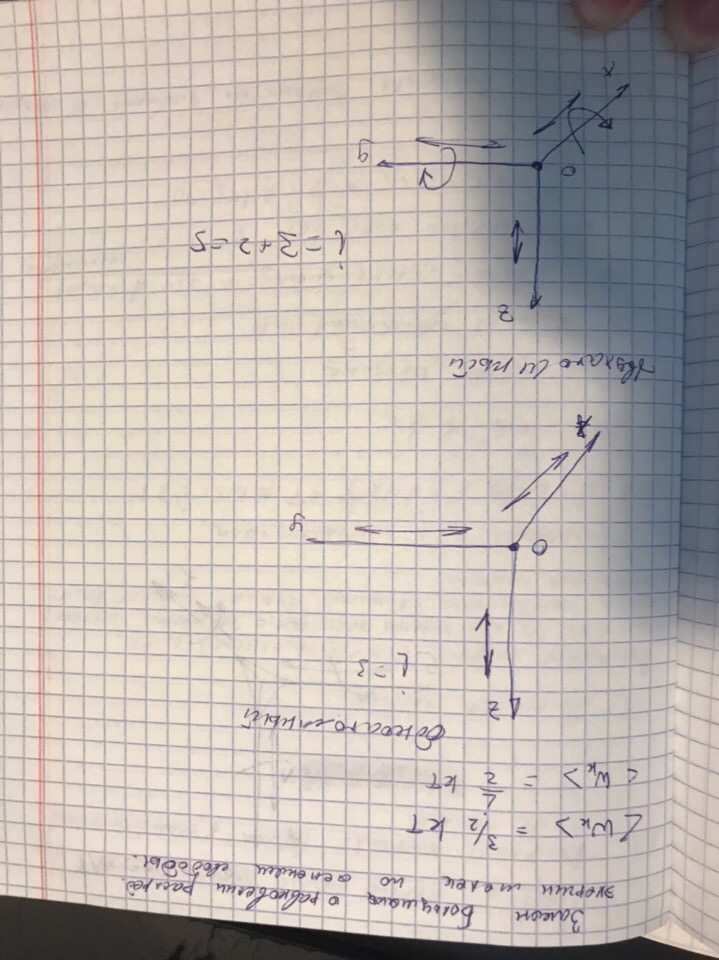
Числом степеней свободы механической системы называется число независимых координат, полностью определяющих положение системы в пространстве.
Температура — физическая величина, которая характеризует состояние термодинамического равновесия макроскопической системы
24. Макросистемы. Статистический метод исследования. Распределение молекул газа по модулям скоростей (распределение Максвелла).



Функции распределения Максвелла молекул газа по модулям скоростей. Наиболее вероятная, средняя и средняя квадратичная скорости молекул. Зависимость функции распределения молекул газа по модулям скоростей от температуры.
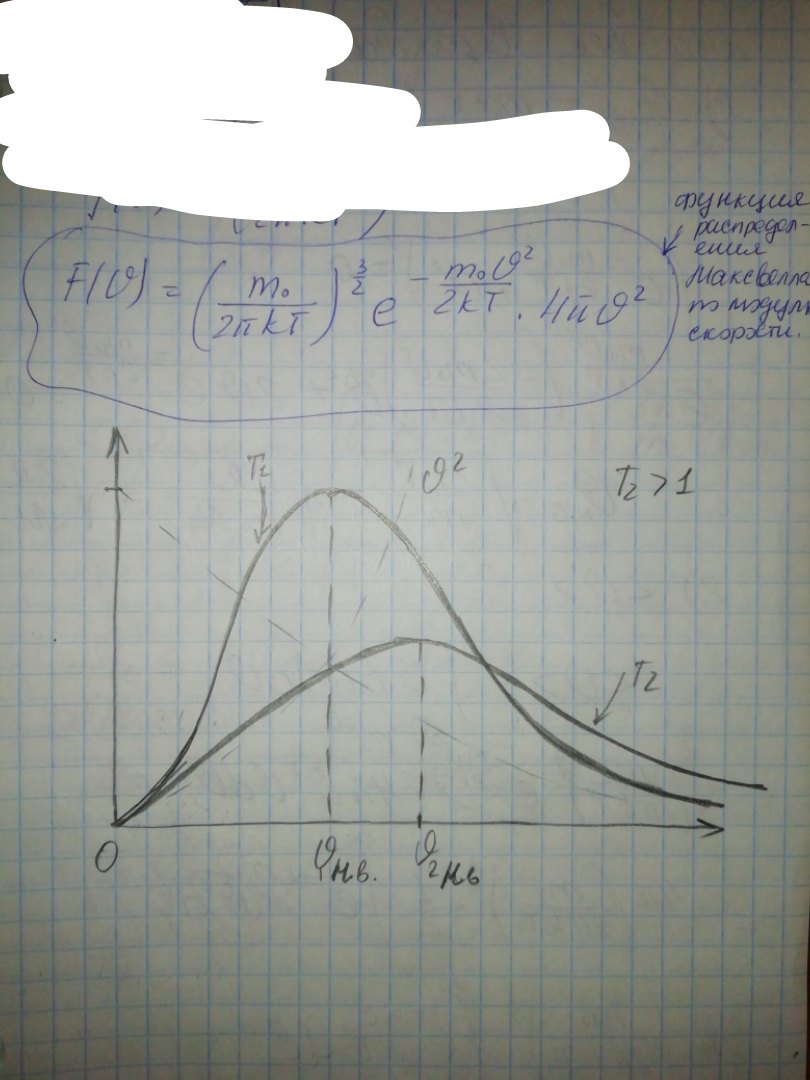
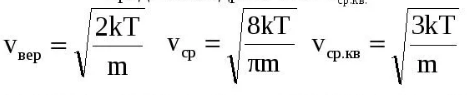
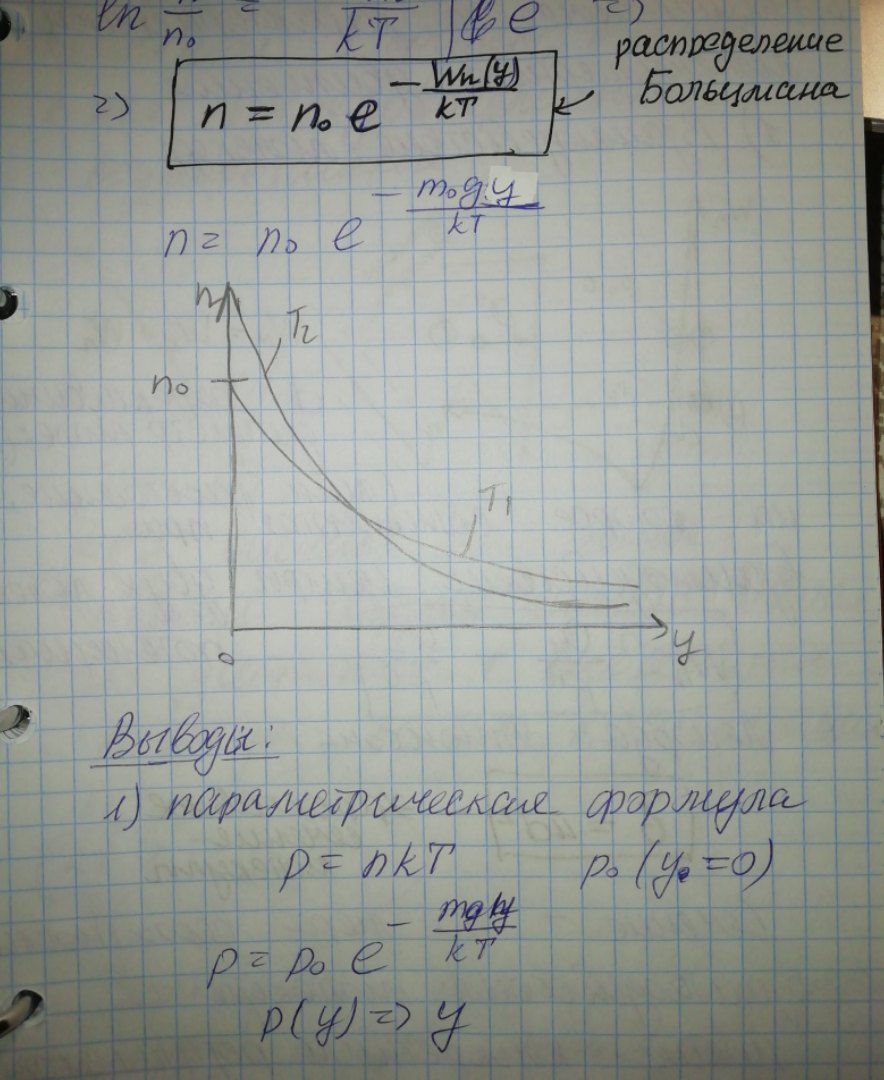
26. Распределение Больцмана (барометрическая формула).
Внутренняя энергия идеального газа. Количество теплоты и работа. Первое начало термодинамики. Применение первого начала термодинамики к изобарическому и изотермическому процессам.
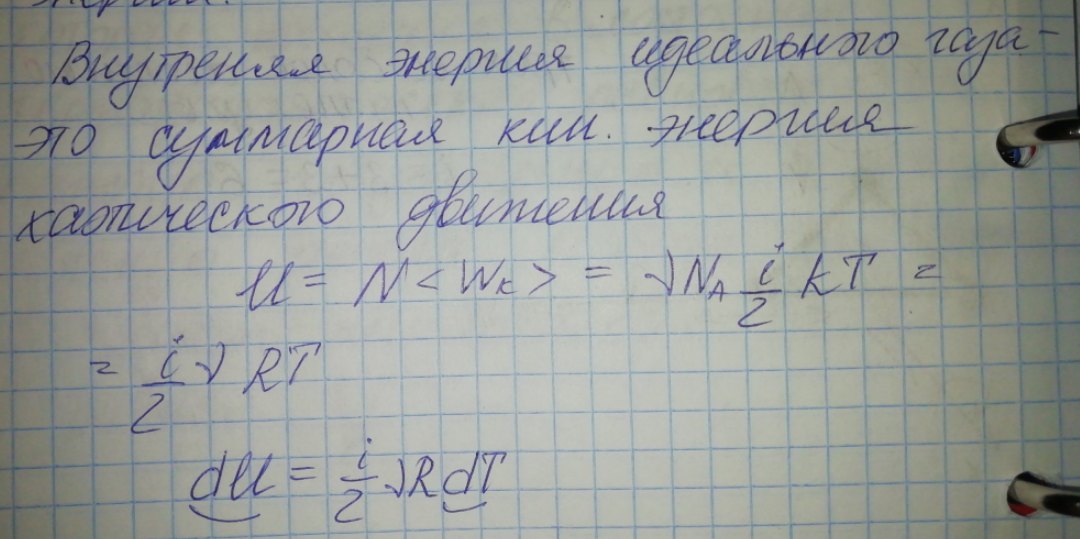



Адиабатический процесс. Применение первого начала термодинамики к изохорическому и адиабатическому процессам.

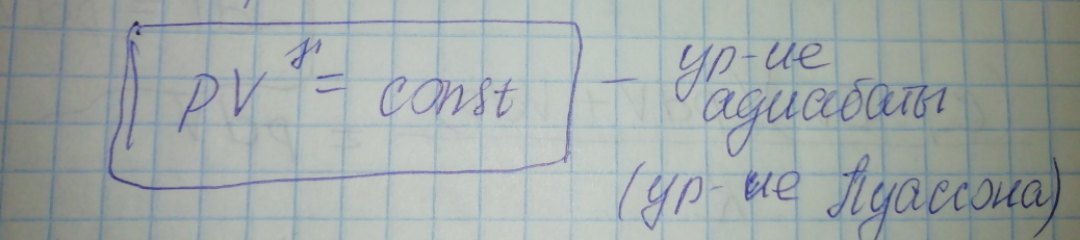

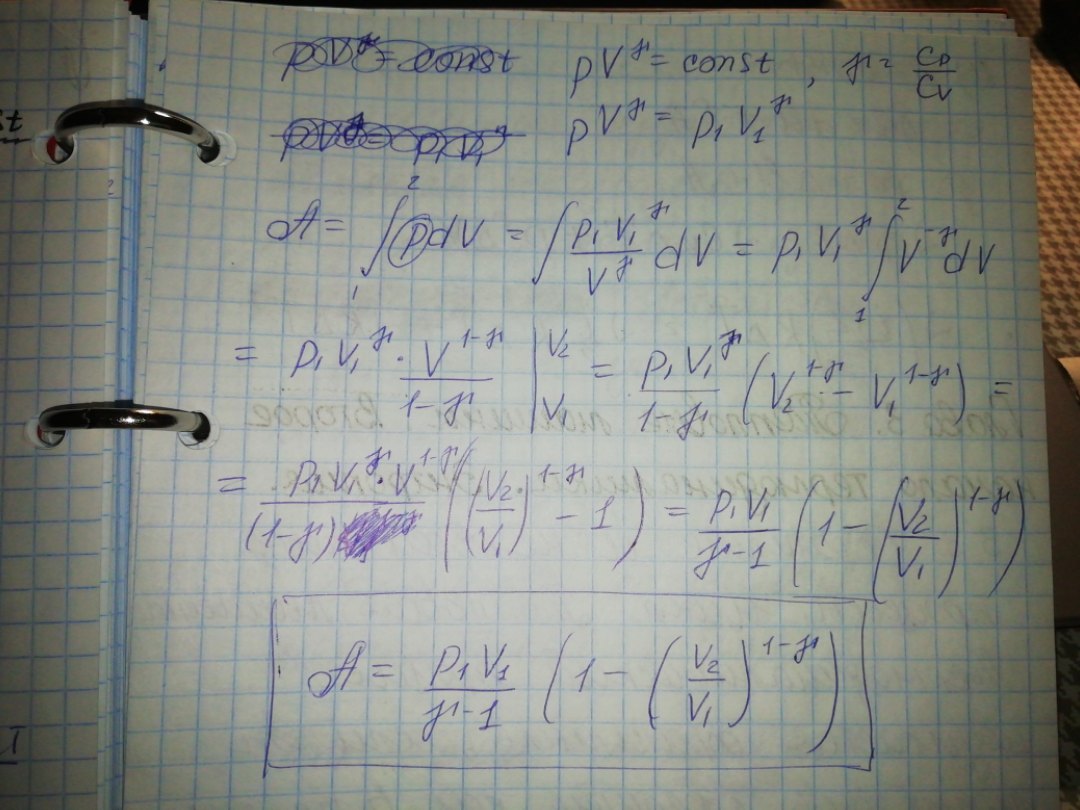

Дата: 2019-07-30, просмотров: 400.