Биологическое окисление.
Исполнители: студентки
педиатрического
факультета 223 группы
Заруба Н.С., Чащина Е.Е.
Руководитель: доцент,
к.м.н. Трубачев С.Д.
Рецензент:
Екатеринбург 2002.
Содержание.
I. Введение………………………………………………………………...3
II. Общие представления о биологическом окислении.
Окислительно-восстановительные системы и потенциалы……..3
III. Пути использования кислорода в клетке……………………………...5
§ Оксидазный путь использования кислорода. Митохондрии.
Ферменты, их локализация и значение в процессах окисления…….5
IV. Этапы утилизации энергии питательных веществ…………………...6
V. Окислительное фосфорилирование……………………………………9
§ Хемиосмотическая теория Митчелла……..……….………………..9
§ Редокс – цепь окислительного фосфорилирования………………10
VI. Цикл Кребса…………………………………………………………21
§ Открытие ЦТК……………………………………………………..22
§ Реакции, ферменты. Регуляция…………………………………...23
VII. Макроэргические соединения и связи……………………………...29
VIII. Витамин РР. Участие в процессах окисления…………………….30
IX. Микросомальное окисление…………………………………………31
§ Монооксигеназные реакции………………………………………31
§ Диоксигеназные реакции………………………………………….32
§ Цитохромы…………………………………………………………32
X. Пероксидазный путь использования кислорода…………………..33
XI. Ферментативная антиоксидантная защита…………………………34
§ Супероксиддисмутаза, каталазы, пероксидазы………………….34
XII. Неферментативная антиоксидантная защита………………………35
§ Витамины С, Е и Р…………………………………………….…...35
XIII. Заключение…………………………………………………………..38
XIV. Список литературы…………………………………………………..39
Введение.
В химии окисление определяется как удаление электронов, а восстановление - как присоединение электронов; это можно проиллюстрировать на примере окисления ферро-иона в ферри-ион:
Fe2+-e → Fe3+
Отсюда следует, что окисление всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов в равной мере применим к биохимическим системам и характеризует природу процессов биологического окисления.
Хотя некоторые бактерии (анаэробы) живут в отсутствие кислорода, жизнь высших животных полностью зависит от снабжения кислородом. Кислород, главным образом, используется в процессе дыхания – последнее можно определить как процесс улавливания клеточной энергии в виде АТФ при протекании контролируемого присоединения кислорода с водородом с образованием воды. Кроме того, молекулярный кислород включается в различные субстраты при участии ферментов, называемых оксигеназами. Многие лекарства, посторонние для организма вещества, канцерогены (ксенобиотики) атакуются ферментами этого класса, которые в совокупности получили название цитохрома Р450.
Гипоксические нарушения метаболизма клетки занимают ведущее место в патогенезе критических состояний. Главную роль в формировании необратимости патологических процессов приписывают крайним проявлениям расстройства клеточного метаболизма. Адекватное обеспечение клетки кислородом является основным условием сохранения ее жизнеспособности.[12,1992]
Введением кислорода можно спасти жизнь больных, у которых нарушено дыхание или кровообращение. В ряде случаев успешно применяется терапия кислородом под высоким давлением; следует однако отметить, что интенсивная или продолжительная терапия кислородом под высоким давлением может вызвать кислородное отравление.[2,1994]
При написании данной работы перед нами стояла цель: изучить биологическое окисление и его значение в жизнедеятельности клетки и организма в целом. Для этого мы рассмотрели:
§ использование кислорода клеткой;
§ источники энергии клетки – цикл лимонной кислоты (цикл Кребса), окислительное фосфорилирование;
§ микросомальное окисление;
§ антиоксидантную защиту
Общие представления о биологическом окислении.
Реакции ЦТК.
Начальная реакция - конденсация ацетил-СоА и оксалоацетата, катализируется конденсирующим ферментом, цитратсинтетазой, при этом происходит образование связи углерод-углерод между метальным углеродом ацетил-СоА и карбонильным углеродом оксалоацетата. За реакцией конденсации, приводящей к образованию цитрил-СоА, следует гидролиз тиоэфирной связи, сопровождающийся потерей большого количества свободной энергии в форме теплоты; это определяет протекание реакции слева на право до ее завершения:
Ацетил-СоА + Оксалоацетат + Н2О → Цитрат + CoA-SH
Превращение цитрата в изоцитрат катализируется аконитазой, содержащей железо в двухвалентном состоянии. Эта реакция осуществляется в две стадии: сначала происходит дегидратация с образованием цис-аконитата (часть его остается в комплексе с ферментом), а затем - гидратация и образование изоцитрата:
Цитрат ↔ цис -Аконитат ↔ Изоцитрат – Н2О
Реакция ингибируется фторацетатом, который сначала превращается во фторацетил-СоА; последний конденсируется с оксалоацетатом, образуя фторцитрат. Непосредственным ингибитором аконитазы является фторцитрат, при ингибировании накапливается цитрат.
Эксперименты с использованием промежуточных соединений показывают, что аконитаза взаимодействует с цитратом ассиметрично: она всегда действует на ту часть молекулы цитрата, которая образовалась из оксалоацетата. Возможно, что цис-аконитат не является обязательным интермедиатом между цитратом и изоцитратом и образуется на боковой ветви основного пути.
Далее изоцитратдегидрогеназа катализирует дегидрогенирование с образованием оксалосукцината. Описаны три различных формы изоцитратдегидрогеназы. Одна из них, НАД-зависимая, найдена только в митохондриях. Две другие формы являются НАДФ-зависимыми, причем одна из них также находится в митохондриях, а другая в цитозоле. Окисление изоцитрата, связанное с работой дыхательной цепи, осуществляется почти исключительно НАД-зависимым ферментом:
Изоцитрат + НАД+ ↔ Оксалосукцинат (в комплексе с ферментом) ↔ альфакетоглутарат + СО2+ НАДН2
Рисунок 5. Реакции цикла Кребса.[10,1993]
Далее следует декарбоксилирование с образованием альфакетоглутарата, которое также катализируется изоцитратдегидрогеназой. Важным компонентом реакции декарбоксилирования являются ионы Mg2+ (или Мn2+). Судя по имеющимся данным, оксалосукцинат, образующийся на промежуточной стадии реакции, остается в комплексе с ферментом.
Альфакетоглутарат, в свою очередь, подвергается окислительному декарбоксилированию, сходному с окислительным декарбоксилированием пирувата: в обоих случаях субстратом является альфакетокислота. Реакция катализируется альфакетоглутаратдегидрогеназным комплексом и требует участия того же набора кофакторов - тиаминдифосфата, липоата, НАД+, ФАД и СоА; в результате образуется сукцинил-СоА - тиоэфир, содержащий высокоэнергетическую связь.
α-кетоглуторат + НАД+ + CoA-SH → Сукцинил-СоА + СО2 + НАДН+Н+
Равновесие реакции настолько сильно сдвинуто в сторону образования сукцинил-СоА, что ее можно считать физиологически однонаправленной. Как и при окислении пирувата, реакция ингибируется арсенатом, что приводит к накоплению субстрата (альфакетоглутарат).
Продолжением цикла является превращение сукцинил-СоА в сукцинат, катализируемое сукцинаттиокиназой (сукцинил-СоА-синтетазой):
Сукцинил-СоА + ФН + ГДФ↔ Сукцинат + ГТФ + CoA-SH
Одним из субстратов реакций является ГДФ (или ИДФ), из которого в присутствии неорганического фосфата образуется ГТФ (ИТФ). Это - единственная стадия цикла лимонной кислоты, в ходе которой генерируется высокоэнергетическая фосфатная связь на субстратном уровне; при окислительном декарбоксилировании α-кетоглутарата потенциальное количество свободной энергии достаточно для образования НАДН и высокоэнергетической фосфатной связи. В реакции, катализируемой фосфокиназой, АТФ может образовываться как из ГТФ, так и из ИТФ. Например:
ГТФ+АДФ «ГДФ+АТФ.
В альтернативной реакции, протекающей во внепеченочных тканях и катализируемой сукцинил-СоА-ацетоацетат-СоА-трансферазой, сукцинил-СоА превращается в сукцинат сопряженно с превращением ацетоацетата в ацетоацетил-СоА. Впечени имеется диацилазная активность, обеспечивающая гидролиз части сукцинил-СоА с образованием сукцината и СоА.
Далее сукцинат дегидрогенируется, затем присоединяется молекула воды, и следует еще одна стадия дегидрогенирования, приводящая к регенерации оксалоацетата:
Сукцинат + ФАД « Фумарат + ФАДН2
Первое дегидрогенирование катализируется сукцинатдегидрогеназой, связанной с внутренней поверхностью внутренней митохондриальной мембраны. Это единственная дегидрогеназная реакция ЦТК, в ходе которой осуществляется прямой перенос с субстрата на флавопротеин без участия НАД+. Фермент содержит ФАД и железо-серный белок. В результате дегидрогенирования образуется фумарат. Как показали эксперименты с использованием изотопов, фермент стереоспецифичен к транс-атомам водорода метиленовых групп сукцината. Добавление малоната или оксалоацетата ингибирует сукцинатдегидрогеназу, что приводит к накоплению сукцината.
Фумараза (фумаратгидротаза) катализирует присоединение воды к фумарату с образованием малата:
Фумарат +Н2О « L-малат
Фумараза специфична к L-изомеру малата, она катализирует присоединение компонентов молекулы воды по двойной связи фумарата в транс-конфигурации. Малатдегидрогеназа катализирует превращение малата в оксалоацетат, реакция идет с участием НАД+:
L-малат + НАД+ « 0ксалоацетат + НАДН2
Хотя равновесие этой реакции сильно сдвинуто в направлении малата, реально она протекает в направлении оксалоацетата, поскольку он вместе с НАДН постоянно потребляется в других реакциях.
Ферменты цикла лимонной кислоты, за исключением альфакетоглутарат- и сукцинатдегидрогеназы, обнаруживаются и вне митохондрий. Однако некоторые из этих ферментов (например, малатдегидрогеназа) отличаются от соответствующих митохондриальных ферментов.
Энергетика цикла лимонной кислоты.
В результате окисления, катализируемого дегидрогеназами ЦТК, на каждую катаболизируемую за период одного цикла молекулу ацетил-СоА образуются три молекулы НАДН и одна молекула ФАДН2. Эти восстановительные эквиваленты передаются в дыхательную цепь, локализованную в митохондриальной мембране. При прохождении по цепи восстановительные эквиваленты НАДН генерируют три высокоэнергетические фосфатные связи посредством образования АТФ из АДФ в процессе окислительного фосфорилирования. За счет ФАДН2 генерируется только две высокоэнергетические фосфатные связи, поскольку ФАДН2 переносит восстановительные эквиваленты на кофермент Q и, следовательно, в обход первого участка цепи окислительного фосфорилирования в дыхательной цепи. Еще один высокоэнергетический фосфат генерируется на одном из участков цикла лимонной кислоты, то есть на субстратном уровне, при превращении сукцинил-СоА в сукцинат. Таким образом, за период каждого цикла образуется 12 новых высокоэнергетических фосфатных связей.
Витамин PP .
Витамин РР (никотиновая кислота, никотинамид, ниацин) называют антипеллагрическим витамином (от итал. Preventive pellagra – «предотвращающий пеллагру»), поскольку его отсутствие является причиной заболевания, называемого пеллагрой.
Никотиновая кислота известна давно, однако только в 1937 году она была выделена К. Эльвегеймом из экстракта печени и было показано, что введение никотиновой кислоты (или ее амида - никотинамида) или препаратов печени предохраняет от развития или излечивает от пеллагры.
Никотиновая кислота представляет собой соединение пиридинового ряда, содержащее карбоксильную группу (никотинамид отличается наличием амидной группы).
Витамин РР мало растворим в воде (порядка 1%), но хорошо растворим в водных растворах щелочей. Никотиновая кислота кристаллизуется в виде белых игл.
Наиболее характерными признаками пеллагры (от итал. pelle agra -шершавая кожа), являются поражения кожи (дерматиты), желудочно-кишечного тракта (диарея) и нарушения нервной деятельности (деменция).
Дерматиты чаще всего симметричны и поражают те участки кожи, которые подвержены влиянию прямых солнечных лучей: тыльную поверхность кистей рук, шею, лицо; кожа становится красной, затем коричневой и шершавой. Поражения кишечника выражаются в развитии анарексии, тошноты и болей в области живота, поноса. Диарея приводит к обезвоживанию организма. Слизистая оболочка толстого кишечника сначала воспаляется, затем изъязвляется. Специфичными для пеллагры являются стоматиты, гингивиты, поражения языка со вздутием и трещинами. Поражения мозга выражаются в головных болях, головокружениях, повышенной раздражимости, депрессии и других симптомах, включая психозы, психоневрозы, галлюцинации и другие. Симптомы пеллагры особенно резко выражены у больных с недостаточным белковым питанием. Установлено, что это объясняется недостатком триптофана, который является предшественником никотинамида, частично синтезируемого в тканях человека и животных, а также недостатком ряда других витаминов.
Витамин РР играет роль кофермента в НАД-зависимых дегидрогеназах (участниках тканевого дыхания), метаболизме углеводов и аминокислот, НАДФ-зависимых ферментах (пентозного шунта и синтеза липидов), НМН-зависимых энзимах (алкогольдегидрогеназа и маликфермент). Не менее важна роль его, как субстрата поли-АДФ-рибозилирования. Данный процесс участвует в сшивке хромосомных разрывов и в работе репаразной системы, а также имеет (при нехватке НАД) ключевое значение в механизме некробиоза и апоптоза клеток, особенно – высокоаэробных.[6,2000]
Показано, что ряд дегидрогеназ используют только НАД или НАДФ, другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них. В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами.
Основными источниками никотиновой кислоты и ее амида являются рис, хлеб, картофель, мясо, печень, почки, морковь и другие продукты.[18,1989]
Микросомальное окисление.
Монооксигеназные реакции.
Живые организмы содержат группу многочисленных и разнообразных ферментов, получивших название монооксигеназ. В типичном случае один атом кислородной молекулы обнаруживается в новой гидроксидной группе субстрата, другой – восстанавливается до воды в процессе реакции. В соответствии с этим реакция должна протекать при участии фермента, субстрата, кислородаи какого-либо восстанавливающего агента.
Допамин-b-монооксигеназа, присутствующая в мозге и в хромаффинной ткани, катализирует гидроксилирование 3,4-диоксифенилэтиламина до норадреналина.
Фенолмонооксигеназы имеются у бактерий, растений, насекомых, а также в печени и коже млекопитающих. Полимеризация о-хинона, образовавшегося в результате цепочки реакции, катализируемых этими ферментами, лежит в основе образования меланина.[7,2000]
Диоксигеназные реакции.
Ферменты, катализирующие реакции, в которых оба атома молекулярного кислорода встраиваются в продукты реакции, называются диоксигеназами. Известные в настоящее время ферменты этой группы могут содержать в качестве активной группы гем или негемовое железо, а для действия некоторых необходим a-кетоглутарат.
Железо-a-кетоглутаратдиоксигеназы – железозависимые ферменты, катализирующие гидроксилирование субстрата в ходе процесса, в котором a-кетоглутарат подвергается окислительному декарбоксилированию до сукцината: М + О2 + a-кетоглутарат 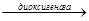 М-ОН + сукцинат + СО2 [5,2000]
М-ОН + сукцинат + СО2 [5,2000]
Цитохромы – ферменты редокс-цепи.
Дальнейший перенос электронов от КоQН2 на О2 осуществляет система цитохромов. Данная система состоит из ряда гемсодержащих белков (гемпротеинов), открытых в 1886 году К. Мак-Мунном. Все они имеют простетическую геминовую группу, близкую к гему гемоглобина. Цитохромы отличаются друг от друга не только простетической группой, но и белковыми компонентами. Все цитохромы, особенно в восстановленной форме, имеют характерные спектры поглощения, величины окислительно-восстановительных потенциалов также неодинаковы.
В имеющем широкое распространение механизме гидроксилирования путем введения одного атома кислорода функциональный атом железа находится в гемовой группе цитохрома – цитохрома Р450. Эти цитохромы обнаруживаются в мембранах печеночной ЭПС, в митохондриях коры надпочечников, в почечной щеточной кайме и в плазматических мембранах различных бактерий. Катализируемая реакция такая же, как у всех других монооксигеназ.
МН + О2 + 2е + 2Н+ ®МОН + Н2О
Цитохромы Р450 из печени относятся к числу индуцируемых ферментов; это означает, что количество присутствующего фермента может увеличиваться в 25 раз при введении одного из многочисленных чужеродных соединений, например фенобарбитала или метилхолантрена. Цитохромы обезвреживают ксенобиотики, а также лимитируют время, в течение которого могут сохранять свою активность некоторые наркотики. Лечение некоторых форм острой интоксикации может быть облегчено введением индуктора, который в этом случае вообще безвреден.
Цитохромы Р450 коры надпочечников находятся в митохондриальной мембране, где два отдельных фермента катализируют соответственно расщепление боковых цепей холестерина до прегненолона и реакции гидроксилирования различных стероидов.[2,1994]
Цитохром Р450 катализирует образование гидроксильных групп при синтезе желчных кислот, стероидных гормонов, при катаболизме ряда веществ и обмене чужеродных соединений.
Первая, обнаруженная в микросомах электронпереносящая система – это система восстановления цитохрома b5 за счет NADH; цитохром b5 восстанавливается NADH-цитохром b5-редуктазой, содержащей на молекуле один FAD, который совершает циклические переходы между полностью восстановленной и окисленной формами. Цитохром b5 прочно связан с ЭПС своей обширной гидрофобной областью. Хотя наружная поверхность области цитохрома, где находится гем, гидрофильна, она лежит в глубокой гидрофобной щели, причем карбоксильные группы пропионовой кислоты ориентированы наружу. Восстановленный цитохром b5 медленно самоокисляется с образованием супероксидного аниона. Этот механизм может быть основным генератором супероксида в клетках печени.[11,1989]
Заключение.
Проблема, освещенная в данной работе, на сегодняшний день является очень важным разделом в биохимии, где, несмотря на достигнутые успехи, остается множество вопросов и пробелов.
Знание вопросов биоорганической химии является нужным и важным в практике каждого врача, так как активное развитие фармакологии и появление множества новых препаратов позволяет, зная биохимию процессов, протекающих в организме, воздействовать на них и лечить многие заболевания на клеточном уровне, стимулируя энергетические процессы на уровне митохондрий.
Любая внезапная смерть связана с гипоксией, которая сопровождается накоплением в организме большого количества молочной кислоты за счет подавления функции челночных механизмов, и как следствие - возникает ацидоз. При гипоксии неограниченно образуются свободные радикалы и интенсивно протекает перикисное окисление липидов с последующим необратимым повреждением клеток. Изучение нарушений механизмов биологического окисления и способов коррекции является важным при лечении патологий сердечно-сосудистой и дыхательной систем, возрастных патологиях, воспалениях. Особо важное значение имеют эти знания в реанимации, при наркозах, так как уровень молочной кислоты значительно возрастает во время операций под наркозом, например кетамином или этраном, под влиянием наркотических веществ происходит разобщение процессов окисления и фосфорилирования. Вот почему так важно иметь в распоряжении наиболее полные знания и информативные данные, оценка которых может обеспечить максимальные возможности прогноза течения заболевания.
Список литературы:
1. Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки: В 3-х т.,2-е изд., пер.и доп. Т.1. Пер. с англ. – М.: Мир, 1994 – 517 с., ил.
2. Бышевский А.Ш., Терсенов О.А. Биохимия для врача. Екатеринбург: Издательско-полиграфическое предприятие «Уральский рабочий». - 1994 – 384 с.
3. Виноградов А.Д. Митохондриальная АТФ-синтезирующая машина: пятнадцать лет спустя.//Биохимия. – 1999 – Т.64. Вып.11 – с.1443-1456
4. Галкин М.А., Сыроешкин А.В. Кинетический механизм реакции синтеза АТФ, катализируемый митохондриальной F0-F1-АТФазой.//Биохимия. – 1999 – Т.64.Вып 10 – с.1393-1403
5. Гринстейн Б., Гринстейн А. Наглядная биохимия. – М.: «Медицина» 2000 – с.68-69, 84-85
6. Зайчик А.Ш., Чурилов Л.П. Основы общей патологии. Часть 2. Основы патохимии. – СПб. – 2000 – 384 с.
7. Козинец Г.И. Физиологические системы человека. – М.: «Триада-Х» - 2000 – с.156-164
8. Коровина Н.А., Захарова И.Н., Заплатников А.Л. Профилактика дефицита витаминов и микроэлементов у детей (справочное пособие для врачей). – Москва, 2000
9. Ленинджер А. Основы биохимии. – М.: Мир – 1991 – 384 с.
10. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В2-х т. Т.1.Пер с англ.: - М.: Мир – 1993 – 384 с.
11. Николаев А.Я. Биологическая химия. Учеб. для мед. спец. Вузов – М.: Высшая школа. – 1989 – 495с.
12. Рябов Г.А. Гипоксия критических состояний. – М.: Медицина. – 1992 – 288 с.
13. Самарцев В.Н. Жирные кислоты как разобщители окислительного фосфорилирования.// Биохимия. – 2000 – Т.65.Вып.9 – с.1173-1189
14. Скулачев В.П. Кислород в живой клетке: добро и зло.// Соросовский образовательный журнал. – 1996 - №3 – с.4-10
15. Скулачев В.П. Эволюция биологических механизмов запасания энергии.// Соросовский образовательный журнал. – 1997 - №5 – с.11-19
16. Скулачев В.П. Стратегии эволюции и кислород.// Природа. – 1998 - №12 – с.11-20
17. Тутельян В.А., Алексеева И.А. Витамины антиоксидантного ряда: обеспеченность населения и значение в профилактике хронических заболеваний.// Клиническая фармакология и терапия. – 1995 - №4 (1) – с.90-95
18. Шилов П.И., Яковлев Т.Н. Основы клинической витаминологии. – Л.: Медицина – 1989 – 343 с.
Биологическое окисление.
Исполнители: студентки
педиатрического
факультета 223 группы
Заруба Н.С., Чащина Е.Е.
Руководитель: доцент,
к.м.н. Трубачев С.Д.
Рецензент:
Екатеринбург 2002.
Содержание.
I. Введение………………………………………………………………...3
II. Общие представления о биологическом окислении.
Окислительно-восстановительные системы и потенциалы……..3
III. Пути использования кислорода в клетке……………………………...5
§ Оксидазный путь использования кислорода. Митохондрии.
Ферменты, их локализация и значение в процессах окисления…….5
IV. Этапы утилизации энергии питательных веществ…………………...6
V. Окислительное фосфорилирование……………………………………9
§ Хемиосмотическая теория Митчелла……..……….………………..9
§ Редокс – цепь окислительного фосфорилирования………………10
VI. Цикл Кребса…………………………………………………………21
§ Открытие ЦТК……………………………………………………..22
§ Реакции, ферменты. Регуляция…………………………………...23
VII. Макроэргические соединения и связи……………………………...29
VIII. Витамин РР. Участие в процессах окисления…………………….30
IX. Микросомальное окисление…………………………………………31
§ Монооксигеназные реакции………………………………………31
§ Диоксигеназные реакции………………………………………….32
§ Цитохромы…………………………………………………………32
X. Пероксидазный путь использования кислорода…………………..33
XI. Ферментативная антиоксидантная защита…………………………34
§ Супероксиддисмутаза, каталазы, пероксидазы………………….34
XII. Неферментативная антиоксидантная защита………………………35
§ Витамины С, Е и Р…………………………………………….…...35
XIII. Заключение…………………………………………………………..38
XIV. Список литературы…………………………………………………..39
Введение.
В химии окисление определяется как удаление электронов, а восстановление - как присоединение электронов; это можно проиллюстрировать на примере окисления ферро-иона в ферри-ион:
Fe2+-e → Fe3+
Отсюда следует, что окисление всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов в равной мере применим к биохимическим системам и характеризует природу процессов биологического окисления.
Хотя некоторые бактерии (анаэробы) живут в отсутствие кислорода, жизнь высших животных полностью зависит от снабжения кислородом. Кислород, главным образом, используется в процессе дыхания – последнее можно определить как процесс улавливания клеточной энергии в виде АТФ при протекании контролируемого присоединения кислорода с водородом с образованием воды. Кроме того, молекулярный кислород включается в различные субстраты при участии ферментов, называемых оксигеназами. Многие лекарства, посторонние для организма вещества, канцерогены (ксенобиотики) атакуются ферментами этого класса, которые в совокупности получили название цитохрома Р450.
Гипоксические нарушения метаболизма клетки занимают ведущее место в патогенезе критических состояний. Главную роль в формировании необратимости патологических процессов приписывают крайним проявлениям расстройства клеточного метаболизма. Адекватное обеспечение клетки кислородом является основным условием сохранения ее жизнеспособности.[12,1992]
Введением кислорода можно спасти жизнь больных, у которых нарушено дыхание или кровообращение. В ряде случаев успешно применяется терапия кислородом под высоким давлением; следует однако отметить, что интенсивная или продолжительная терапия кислородом под высоким давлением может вызвать кислородное отравление.[2,1994]
При написании данной работы перед нами стояла цель: изучить биологическое окисление и его значение в жизнедеятельности клетки и организма в целом. Для этого мы рассмотрели:
§ использование кислорода клеткой;
§ источники энергии клетки – цикл лимонной кислоты (цикл Кребса), окислительное фосфорилирование;
§ микросомальное окисление;
§ антиоксидантную защиту
Общие представления о биологическом окислении.
Дата: 2019-07-24, просмотров: 282.