Следующим этапом настоящего исследования было изучение связи исследуемых полиморфных вариантов генов с изменчивостью значимых для заболеваний количественных признаков, характеризующей адаптационные способности организма. Возможно, что изучаемые полиморфизмы цитохрома Р450 и глутатионовых S-трансфераз имеют значение в развитии БА и ТБ в целом, а также в выраженности отдельных клинических проявлений. Поэтому представлялось важным оценить наличие связи исследуемых генов с количественными лабораторными показателями, характеризующими особенности течения анализируемых заболеваний.
Известно, что ключевой особенностью БА является состояние бронхиальной гиперреактивности, свидетельствующее о повышенном бронхоконстрикторном ответе на различные физико-химические факторы, когда бронхоспазм развивается в ответ на воздействие, не вызывающее такой реакции у большинства здоровых лиц. На этом основан клинический тест с метахолином, показывающий изменения чувствительности и реактивности бронхов.
Предположив, что индивидуальная способность к детоксикации веществ, способствующих развитию БА и бронхиальной гиперреактивности, детерминирована полиморфизмом генов системы метаболизма ксенобиотиков, были проанализированы значения дозы метахолина (по результатам теста на бронхиальную гиперреактивность) с изученными полиморфными вариантами исследуемых генов. Признак не показал корреляции с возрастом обследуемых (r=-0,359, p=0,066). Учитывая значимые отклонения уровня метахолина от закона Гаусса (по данным теста Шапиро-Уилки, W=0,782, p=0,001), сравнение было проведено с помощью непараметрического медианного теста. В результате была показано близкое к статистически значимому различие «количественного фенотипа» БА у мужчин с полиморфизмом 313A>G гена GSTP1: для гомозиготных носителей GG генотипа характерна более низкая доза метахолина, по сравнению с мужчинами-носителями АА и AG генотипов (рис. 5, табл. 15). Следует отметить, что в доступных нам литературных источниках отмечается связь аллеля 313А гена GSTP1 с бронхиальной гиперреактивностью для европеоидной популяции [Cristina et al ., 2002].
Известно, что основными соединениями, вызывающими бронхиальную гиперреактивность, являются реактивные окислители – ключевые компоненты воспалительной реакции. Бронхиальная гиперреактивность может быть модулирована уровнем реактивных окислителей, возможно, с помощью их способности регулировать продукцию эйкозаноидов через стимуляцию освобождения арахидоновой кислоты.
Таблица 15
Взаимосвязь изменчивости уровня метахолина с распределением генотипов полиморфизма гена GSTP1 313A>G
| Генотип |
|
| 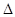
| |||
| Мужчины (n=25) | ||||||
| AA | 4,000 | 6,261 | -2,261 | |||
| AG | 11,000 | 8,348 | 2,652 | |||
| GG | 1,000 | 1,391 | -0,391 | |||
| p=0,054* | ||||||
| Женщины (n=16) | ||||||
| AA | 5,000 | 5,625 | -0,625 | |||
| AG | 2,000 | 1,875 | 0,125 | |||
| GG | 3,000 | 2,500 | 0,500 | |||
| p=0,789* | ||||||
Примечание. 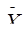 obs – наблюдаемые средние значения,
obs – наблюдаемые средние значения, 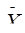 exp – ожидаемые средние значения,
exp – ожидаемые средние значения, 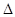 =
= 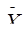 obs-
obs- 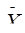 exp, * – достигнутый уровень значимости медианным тестом.
exp, * – достигнутый уровень значимости медианным тестом.
Гены глутатионовых S-трансфераз являются генами-кандидатами для одного из клинических проявлений астмы – бронхиальной гиперреактивности, а, следовательно, и для БА, поскольку кодируемые ими ферменты понижают уровень реактивных окислителей [Hayes, McLellan, 1999]. Эта точка зрения подтверждается исследованиями, показавшими, что индивиды с пониженной антиоксидантной способностью имеют повышенный риск атопической БА и уменьшение потока антиоксидантов ассоциировано с экспрессией связанных с астмой фенотипов.
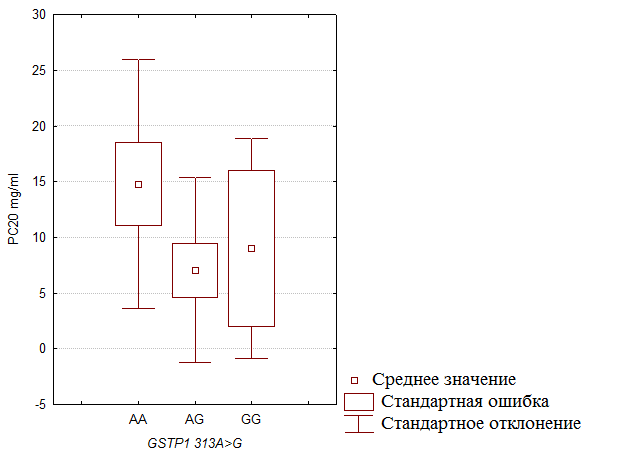
Рис. 5. Уровни метахолина у носителей различных генотипов полиморфизма 313A>G гена GSTP1 у лиц мужского пола.
Полиморфизм в генах GSTT1 и GSTM1 не показал связи с бронхиальной гиперреактивностью, что может отражать различия в генной экспресии, также как изменчивости в метаболизме субстратов, имеющих отношение для развития БА. Действительно, несмотря на то, что в эпителиальных клетках легких человека экспрессируются различные генные продукты GST, глутатионовые S-трансферазы p класса составляют более чем 90% от общей GST-активности [Frayer et al., 1986].
Известно, что для БА аллергического характера характерно значительное повышение уровня общего IgE. Через IgE-опосредованный механизм целый ряд клеточных элементов: тучные клетки, макрофаги, лимфоциты, эпителиальные и эндотелиальные клетки независимо друг от друга или совместно принимают участие в воспалении дыхательных путей, тем самым, осуществляя иммунный ответ организма на внедрение антигена. В этом контексте была рассмотрена гипотеза, предполагающая зависимость изменчивости уровня общего IgE от генетического полиморфизма ферментов метаболизма ксенобиотиков. Было показано значимое повышение уровня IgЕ у женщин с генотипом *1/*1 гена CYP2C19 по сравнению с носителями остальных генотипов (табл. 16).
Таблица 16
Распределение уровня IgE у носителей различных генотипов гена CYP2C19 (полиморфизма 681G>A) среди женщин
| Генотип | n | Средние значения IgE±S.E. | p | |
| *1/*1 | 20 | 408,0±73,4 | 0,044 | |
| *1/*2+*2/*2 | 4 | 67,5±26,7 |
Примечание. n – абсолютное значение человек в группе; р – достигнутый уровень значимости для теста Манна-Уитни.
Анализ изменчивости уровня общего IgE у больных БА с другими, изученными в данной работе полиморфными вариантами генов метаболизма ксенобиотиков, не показал ассоциаций ни у мужчин, ни у женщин (р>0,05).
Таблица 17
Значение показателей спирометрии ± S.E. в зависимости от генотипа по полиморфизмам генов глутатионовых S-трансфераз GSTT1 и GSTM1 у больных бронхиальной астмой
| Группа сравнения | Генотип | Форсированная жизненная емкость легких | Объем форсированного выдоха за 1 секунду | Пиковая скорость выдоха |
| GSTT1 | ||||
| Мужчины | GSTT1 + (n=19) | 2,32±0,41 | 1,97±0,45 | 4,31±1,11 |
| GSTT1 0/0 (n=12) | 2,58±0,50 | 2,29±0,42 | 4,82±0,84 | |
| р* | 0,122 | 0,059 | 0,187 | |
| Женщины | GSTT1 + (n=18) | 2,46±0,73 | 2,02±0,67 | 3,86±1,33 |
| GSTT1 0/0 (n=5) | 2,42±0,34 | 2,09±0,70 | 4,26±1,18 | |
| р* | 0,911 | 0,831 | 0,550 | |
| GSTM1 | ||||
| Мужчины | GSTM1 + (n=8) | 2,31±0,42 | 1,92±0,31 | 4,31±1,08 |
| GSTM1 0/0 (n=23) | 2,46±0,47 | 2,15±0,50 | 4,58±1,08 | |
| р* | 0,415 | 0,236 | 0,538 | |
| Женщины | GSTM1 + (n=4) | 1,78±0,58 | 1,64±0,50 | 2,97±1,31 |
| GSTM1 0/0 (n=19) | 2,59±0,59 | 2,12±0,67 | 4,15±1,22 | |
| р* | 0,021 | 0,191 | 0,097 | |
Примечание. n – объемы выборок; * - уровень значимости для однофакторного дисперсионного анализа.
Учитывая важность показателей исследования функции внешнего дыхания у больных БА для оценки степени тяжести заболевания, проведен сравнительный анализ связи полиморфных вариантов генов метаболизма с основными спирометрическими показатели: форсированная жизненная емкость легких (FVC), объем форсированного выдоха за 1 секунду (FEV1) и пиковая скорость выдоха (PEF). Отмечена связь FVC с полиморфизмом гена GSTM1 среди женщин (F=6,263, p=0,021), у мужчин таких различий не наблюдается (табл. 17). Кроме того, показаны близкая к статистической значимости связь FEV1 с полиморфизмом гена GSTT1 у мужчин, а также PEF с полиморфизмом гена GSTM1 у женщин.
Учитывая, что патогенные свойства M. tuberculosis в условиях развивающегося специфического процесса в легких непосредственно сказываются на особенностях реагирования системы крови, для больных ТБ были проанализированы параметры общего анализа крови: уровень гемоглобина, количество эритроцитов, лейкоцитов, скорость оседания эритроцитов (СОЭ); а также параметры биохимического анализа крови: количество билирубина (прямой и обратный), аланинаминотрансферазы (АЛТ) до начала лечения и через два месяца после лечения.
Воздействие инфекционного агента вызывает развитие комплекса изменений как специального, так и стрессового характера. Последние оказывают непосредственное влияние на формирование основного патологического процесса, в то же время специфика развивающегося туберкулезного процесса определяет особенности реакций общего адаптационного синдрома.
Для полиморфных вариантов генов глутатионовых S-трансфераз не показано связи с изменчивостью количественных показателей периферической крови (табл. 18). Однако получена ассоциация полиморфизма 681G>A гена CYP2C19 фермента I-й фазы метаболизма ксенобиотиков у мужчин: аллель CYP2C19*2 связан с низким уровнем эритроцитов (р=0,027) (табл. 19), для них также отмечена тенденция к снижению уровня гемоглобина (р=0,065). Для женщин таких различий не показано (р>0,05). Известно, что при ТБ имеет место снижение количества эритроцитов как за счет их ускоренного разрушения в периферической крови под влиянием токсических фракций M. tuberculosis, так и вследствие нарушения эритропоэза в результате туберкулезной интоксикации [Глебович, 1951; Милосердова, 1958; Шмелев, 1959; Радзинский, 1961; Кан, 1972].
Таблица 18
Средние значения (±S.E.) количественных параметров крови больных туберкулезом носителей разных генотипов полиморфизмов генов глутатионовых S-трансфераз
| Группа сравнения | Генотип | Гемоглобин (г/л) | Эритроциты (х1012/л) | Лейкоциты (х109/л) | СОЭ (мм/ч) |
| 1 | 2 | 3 | 4 | 5 | 6 |
| GSTT1 | |||||
| Мужчины | GSTT1 + | 130,01±1,78 n=115 | 4,17±0,06 n=112 | 8,23±0,33 n=116 | 25,14±1,76 n=115 |
| GSTT1 0/0 | 135,35±2,43 n=26 | 4,29±0,10 n=25 | 8,01±0,50 n=28 | 25,59±3,36 n=28 | |
| p | 0,251* | 0,353* | 0,892* | 0,486* | |
| Женщины | GSTT1 + | 119,14±1,04 n=69 | 3,90±0,06 n=65 | 7,06±0,36 n=69 | 25,41±2,26 n=67 |
| GSTT1 0/0 | 121,82±1,99 n=13 | 3,72±0,14 n=12 | 7,04±0,51 n=13 | 23,94±6,96 n=12 | |
| p | 0,613** | 0,322* | 0,489* | 0,739* | |
| GSTM1 | |||||
|
Мужчины | GSTM1 + | 129,26±2,42 n=51 | 4,10±0,09 n=49 | 8,56±0,45 n=53 | 27,50±2,61 n=52 |
| GSTM1 0/0 | 131,98±1,96 n=90 | 4,25±0,06 n=88 | 7,96±0,36 n=91 | 23,00±1,92 n=91 | |
| p | 0,263* | 0,091* | 0,158* | 0,205* | |
| Женщины | GSTM1 + | 120,66±3,32 n=29 | 3,94±0,10 n=27 | 6,93±0,56 n=29 | 26,27±3,74 n=28 |
| GSTM1 0/0 | 118,97±2,36 n=53 | 3,83±0,06 n=50 | 7,12±0,39 n=53 | 24,58±2,69 n=51 | |
| p | 0,676** | 0,393* | 0,491* | 0,656* | |
| GSTP1 313A>G | |||||
| Мужчины | AA | 132,72±2,07 n=76 | 4,23±0,07 n=76 | 8,48±0,39 n=79 | 24,51±1,92 n=79 |
| AG+GG | 128,85±2,33 n=62 | 4,14±0,07 n=62 | 7,91±0,42 n=62 | 24,56±2,66 n=61 | |
| p | 0,201* | 0,309* | 0,521* | 0,871* | |
| Женщины | AA | 119,88±2,81 n=34 | 3,97±0,07 n=31 | 7,35±0,56 n=34 | 24,39±3,89 n=33 |
| AG+GG | 119,69±2,65 n=47 | 3,80±0,08 n=45 | 6,85±0,38 n=47 | 25,94±3,00 n=47 | |
| р | 0,512* | 0,207* | 0,670* | 0,461* | |
Примечание. В скобках указаны единицы измерения; n – объемы выборок;
*- достигнутый уровень значимости теста Манна-Уитни; ** - уровень значимости для однофакторного дисперсионного анализа.
Таблица 19
Средние значения (±S.E.) количественных параметров крови у больных туберкулезом носителей разных генотипов полиморфных вариантов генов цитохромов Р450
| Группа сравнения | Генотип | Гемоглобин (г/л) | Эритроциты (х1012/л) | Лейкоциты (х109/л) | СОЭ (мм/ч) | |
| 1 | 2 | 3 | 4 | 5 | 6 | |
| CYP2E1 7632T>A | ||||||
| Мужчины | ТТ | 132,11±1,80 n=105 | 4,24±0,06 n=103 | 7,98±0,32 n=108 | 24,19±1,80 n=107 | |
| ТА+АА | 127,94±2,98 n=34 | 4,05±0,08 n=32 | 8,99±0,57 n=34 | 25,75±3,25 n=34 | ||
| p | 0,204* | 0,212* | 0,091* | 0,686* | ||
| Женщины | ТТ | 120,07±2,20 n=67 | 3,88±0,06 n=62 | 7,06±0,36 n=67 | 26,31±2,46 n=65 | |
| ТА+АА | 116,84±3,95 n=14 | 3,81±0,11 n=14 | 7,243±0,638 n=14 | 20,31±4,65 n=13 | ||
| p | 0,532** | 0,707* | 0,549* | 0,283* | ||
| CYP2E1 1293G>C | ||||||
| Мужчины | C1C1 | 131,29±1,62 n=122 | 4,21±0,05 n=119 | 7,93±0,28 n=125 | 25,28±1,68 n=124 | |
| C1C2 | 129,11±4,50 n=19 | 4,10±0,15 n=18 | 9,84±1,04 n=19 | 20,46±3,90 n=19 | ||
| p | 0,925 | 0,669 | 0,060 | 0,215 | ||
| Женщины | C1C1 | 119,42±1,96 n=80 | 3,87±0,05 n=75 | 7,04±0,32 n=80 | 25,92±2,20 n=77 | |
| C1C2 | 119,00±5,20 n=3 | 0,23±0,13 n=3 | 6,83±1,24 n=3 | 14,09±11,68 n=3 | ||
| p | 0,968** | 0,845* | 0,855* | 0,219* | ||
| CYP2C19 681G>A | ||||||
| Мужчины | *1/*1 | 133,09±1,68 n=102 | 4,27±0,06 n=99 | 8,45±0,34 n=104 | 23,85±1,75 n=104 | |
| *1/*2+ *2/*2 | 124,81±3,40 n=36 | 3,96±0,08 n=35 | 7,60±0,52 n=37 | 26,66±3,52 n=36 | ||
| p | 0,065* | 0,027* | 0,195* | 0,477* | ||
| Женщины | *1/*1 | 121,04±2,17 n=57 | 3,90±0,06 n=53 | 7,20±0,35 n=57 | 25,37±2,90 n=57 | |
| *1/*2+ *2/*2 | 115,89±3,98 n=24 | 3,78±0,10 n=23 | 6,83±0,69 n=24 | 25,57±4,04 n=23 | ||
| р | 0,469** | 0,469* | 0,341* | 0,795* | ||
Примечание. В скобках указаны единицы измерения; n – объемы выборок;
*- достигнутый уровень значимости теста Манна-Уитни; ** - уровень значимости для однофакторного дисперсионного анализа.
Данные об экспрессии гена CYP2C19 в костном мозге, позволяют предполагать, что наличие аллеля CYP2C19*2 приводит к снижению функции соответствующего фермента, поэтому у индивидов, носителей мутантного аллеля течение ТБ может сопровождаться разрушающим действием токсинов M. tuberculosis на клетки костного мозга, что приводит к неэффективному эритропоэзу. Подобное предположение о связи делеционного полиморфизма гена GSTT1, сопровождающимся отсутствием соответствующего фермента II-й фазы биотрансформации ксенобиотиков, с неспособностью метаболизировать токсичные для гемопоэтических клеток субстраты, нашло свое подтверждение в исследовании о развитии приобретенной апластической анемии у детей [Dirksen et al., 2004].
Анализ остальных параметров периферической крови: лейкоцитов и скорости оседания эритроцитов не показал влияния исследуемых в работе полиморфизмов генов ФМК на изменчивость вышеперечисленных показателей как для мужчин, так и для женщин. Однако отмечена тенденция к повышению уровня лейкоцитов у носителей гетерозиготных генотипов полиморфных вариантов генов CYP2E1 7632T>A и CYP2E1 1293G>C среди мужчин (р=0,091, р=0,060 соответственно). Учитывая низкую частоту аллелей этих полиморфных вариантов, можно предположить, что статистическая мощность исследованной выборки оказалась недостаточной, чтобы установить значимую связь в отношении изменения уровня лейкоцитов крови.
Метаболизм лекарственных препаратов и эффекты их дальнейшего пребывания в организме в большей степени зависят от генетического полиморфизма ферментов системы биотрансформации. На сегодня известно, что человек имеет 59 активных генов семейства цитохрома Р450, и 6 из них кодируют важные для лекарственного метаболизма ферменты [Ingelman-Sundberg, 2004]. Как отмечалось ранее, для ферментов биотрансформации характерна способность к метаболизму большого количества субстратов по причине того, что ферменты I-й и II-й фаз биотрансформации перекрываются в своей субстратной специфичности. Однако для многих форм Р450 выделены специфические лекарства, используемые для фармакокинетических оценок. Для исследуемых в настоящей работе цитохромов Р450 и глутатионовых S-трансфераз селективные субстраты представлены в табл. 20.
Основным органом, участвующим в метаболизме лекарств, является печень, где обозначены самые высокие концентрации ферментов метаболизма по сравнению с другими органами и наибольшее разнообразие экспрессируемых форм [Райс, Гуляева, 2000]. Полиморфизм генов метаболизма ксенобиотиков в настоящее время активно изучается в отношении индивидуальной чувствительности к лекарственной терапии и, особенно в проявлении многообразных побочных реакций, связанных с лечением.
Таблица 20
Специфичные субстраты для ферментов системы метаболизма
| Фермент | Специфичный субстрат | Литературный источник |
| CYP2E1 | Хлорзоксазон | Kharasch et al., 1993 |
| CYP2C19 | S-мефенитоин | De Morais et al., 1994 |
| GSTT1 | Трансстильбеноксид | Hallier et al., 1993 |
| GSTM1 | Хлористый метилен и хлористый метил | Seidegard et al., 1988 |
| GSTP1 | Этакриновая кислота и бензпирендиолэпоксид | Awasthi et al., 1993 |
Показано, что при биотрансформации новокаинамид превращается в метаболит, который может вызвать у медленных ацетиляторов картину болезни, похожую на красную волчанку, а сульфазалин у этих людей может вызвать лейкопению, гепатотоксичность и нейропатии. Эффективность терапии ТБ зависит как от индивидуальных способностей индивида в метаболизме лекарств, так и от взаимоотношения антимикобактериальных препаратов с системой цитохромов Р450 непосредственно самой микобактерии ТБ. Обнаружено, что геном M. tuberculosis содержит гены, кодирующие 20 различных цитохромов Р450, в том числе ферментов, являющихся мишенью действия для противогрибковых препаратов. Кроме того, опубликованные данные об угнетении метаболизирующей функции печени за счет снижения содержания цитохромов Р450 в этом органе при бактериальной и вирусной инфекции через цитокин-опосредованные механизмы, позволяют предполагать изменение фармакодинамики, а соответственно токсичности лекарственных препаратов [Prandota, 2002].
Во всех странах получило признание комбинированное применение химиопрепаратов, позволяющее добиться бактерицидного эффекта и предотвратить развитие лекарственной устойчивости в процессе лечения. Принцип комбинированного применения нескольких химиопрепаратов известен давно, еще в 1955 г. он был внедрен в практику химиотерапии как метод предупреждения лекарственной устойчивости M. tuberculosis. Актуальность лекарственных поражений печени во фтизиатрии обусловлена необходимостью полихимиотерапии туберкулеза, что создает высокую медикаментозную нагрузку на больного, и в большей степени ее испытывает печень, осуществляя метаболизм туберкулостатиков и патогенетических средств. Противотуберкулезные препараты изониазид, рифампицин, пиразинамид обладают значительной гепатотоксичностью (особенно этот эффект выражен при их комбинации), этамбутол, микобутин и другие – в меньшей степени. Лекарственные гепатиты у больных туберкулезом относят к категории преимущественно токсических побочных реакций химиотерапии.

Рис. 6. Взаимодействие между лекарственными препаратами и ферментативной системой метаболизма ксенобиотиков, приводящее к лекарственно-индуцированному гепатиту (по: Roy et al., 2001).
Частым осложнением при лечении ТБ легких производными гидразина изоникотиновой кислоты, например, изониазидом, являются гепатотоксические реакции. Известно, что чаще они возникают у лиц, быстро инактивирующих изониазид, поскольку у них высвобождается значительно больше гидразина, в частности, ацетилгидразина, который может вызывать дистрофические поражения печени (рис. 6).
Аланинаминотрансфераза (АЛТ) — фермент, катализирующий трансаминирование, присутствует во многих тканях организма, в частности, в печени. В гепатоцитах он локализуется главным образом в цитозольной фракции.
Высвобождение АЛТ в кровь происходит при нарушениях внутренней структуры гепатоцитов и повышении проницаемости клеточных мембран, что свойственно как острому вирусному гепатиту, так и рецидивам хронического гепатита. В этой связи АЛТ считается индикаторным ферментом, и к его определению прибегают постоянно при постановке диагноза гепатитов любой природы.
Установлено статистически значимое увеличение уровней АЛТ (р=0,001) и билирубина (р=0,05) после двух месяцев применения антимикобактериальных препаратов (табл. 21). Значение АЛТ не показало корреляции с возрастом и полом (r=-0,161 и r=-0,152, соответственно, р>0,05). Выявлена ассоциация полиморфного варианта 313A>G гена глутатионовой S-трансферазы p1 (GSTP1) с увеличением активности АЛТ после лечения противотуберкулезными препаратами в течение двух месяцев (р=0,021) (табл. 22).
Поскольку метаболизм изониазида и рифампицина приводит к образованию более токсичных метаболитов, то одной из возможных причин полученного различия может быть прямая связь между генотипом индивида и изменением уровня активности показателя печеночной функции. Такой факт закономерен, так как известно, что глутатионовые S-трансферазы играют значительную роль в метаболизме противотуберкулезных препаратов, таких как изониазид и рифампицин [Sodhi et al. 1996; Sodhi et al., 1997].
Таблица 21
Изменения уровней аланинаминотрансферазы и билирубина до и после двух месяцев лечения
| Значение уровня аланинаминотрансферазы (ммоль/(ч.л)) | Значение уровня билирубина (мкмоль/л) | ||
| До начала лечения | После 2-х месяцев лечения | До начала лечения | После 2-х месяцев лечения |
| 0,03-1,55 | 0,03-1,83 | 4,5-102,0 | 5,0-342,0 |
| 0,001 | 0,050 | ||
Примечание. В скобках указаны единицы измерения; р – достигнутый уровень значимости для теста Уилкоксона.
В доступных источниках литературы показано, что рифампицин индуцирует экспрессию глутатионовых S-трансфераз, а изониазид-индуцированные повреждения печеночных клеток у модельных животных показывают связь с истощением содержащегося в печени глутатиона, и соответственно, с пониженной активностью GST. Эти эффекты максимальны, когда применяются два препарата совместно [Steele et al., 1991].
Полученные результаты представляют интерес в связи с тем, что последнее время появляются данные о развитии гепатотоксичности во время применения антимикобактериальных препаратов у лиц с определенным генотипом по генам ФМК. Так, показана связь «нулевого» генотипа гена GSTM1 с лекарственно-индуцированной гепатотоксичностью в Индии [Roy et al., 2001]. Исследования у 318 пациентов при лечении ТБ в Тайвани показали ассоциации полиморфизма СYP2E1 (Rsa I) с токсическим поражением печени [Huang et al., 2003].
Таблица 22
Средние уровни аланинаминотрансферазы и билирубина после двух месяцев лечения у носителей разных генотипов по генам глутатионовых S-трансфераз и цитохромов Р450 больных туберкулезом
| Ген полиморфизм | Генотип (n) | АЛТ±S.E. | р | Билирубин±S.E. | р |
| GSTT1 del | GSTT1 + (92) | 0,27±0,03 | 0,383* | 15,53±3,91 | 0,682* |
| GSTT1 0/0 (27) | 0,22±0,04 | 9,40±0,99 | |||
| GSTM1 del | GSTM1 + (51) | 0,20±0,02 | 0,149* | 10,81±1,89 | 0,557* |
| GSTM1 0/0 (68) | 0,29±0,04 | 16,63±5,12 | |||
| GSTP1 313A>G | AA (61) | 0,29±0,04 | 0,021** | 16,87±5,66 | 0,604** |
| AG (49) | 0,20±0,03 | 10,98±1,95 | |||
| GG (8) | 0,32±0,05 | 13,69±6,39 | |||
| CYP2C19 681G>A | *1/*1 (86) | 0,26±0,03 | 0,580* | 15,37±4,16 | 0,543* |
| *1/*2+ *2/*2 (32) | 0,22±0,02 | 10,74±1,62 | |||
| CYP2E1 7632T>A | TT (90) | 0,27±0,03 | 0,706* | 15,52±4,01 | 0,198* |
| TA+AA (29) | 0,21±0,03 | 9,84±0,68 | |||
| CYP2E1 1293G>C | C1C1 (106) | 0,26±0,03 | 0,976* | 14,66±3,41 | 0,603* |
| C1C2+C2C2 (13) | 0,22±0,04 | 9,85±1,18 |
Примечание. АЛТ±S.E.– средние значения уровня аланинаминотрансферазы со стандартной ошибкой; билирубин±S.E. – средние значения уровня билирубина со стандартной ошибкой; n – объем выборки; * - достигнутый уровень значимости по тесту Манна-Уитни; ** - достигнутый уровень значимости по тесту Краскела-Уоллиса.
Отмечена ассоциация статуса медленного ацетилятора NAT2 и гепатита, вызванного применением антимикобактериальных препаратов [Huang et al., 2002]. Данные проведенного исследования у жителей г. Томска предполагают участие полиморфного варианта гена GSTP1 (313A>G) в изменчивости уровня показателя печеночной функции при лечении ТБ антимикобактериальными препаратами.
Таким образом, в большинстве случаев для исследуемых количественных признаков наблюдали статистически значимые отклонения распределения от нормального (по данным теста Шапиро-Уилки). С учетом этого сравнение проводили с помощью непараметрических критериев Манна-Уитни, Краскела-Уоллиса и медианного теста. При анализе «количественного фенотипа» больных БА с распределением полиморфных вариантов генов системы метаболизма отмечено: тенденция к снижению уровня метахолина, вызывающего бронхоспазм для гомозиготных носителей аллеля 313G гена GSTP1, значимое повышение уровня IgE у носителей генотипа *1/*1 гена CYP2C19, связь делеционного полимофизма гена GSTM1 с изменчивостью показателя FVC, а также близкая к статистической значимости значения FEV1 и PEF c полиморфизмом генов глутатионовых S-трансфераз GSTM1 и GSTT1.
Оценка «количественного фенотипа» ТБ показала связь гена фермента I-ой фазы метаболизма CYP2C19 (полиморфизм 681G>A) с изменчивостью уровня эритроцитов. Анализ изменчивости показателей печеночной функции показал значимые различия в уровне АЛТ и билирубина до и после двух месяцев лечения антимикобактериальными препаратами. В ходе анализа выявлена ассоциация полиморфного варианта 313A>G гена глутатионовой S-трансферазы p1 (GSTP1) c увеличением уровня АЛТ.
ЗАКЛЮЧЕНИЕ
Ферментативная система метаболизма ксенобиотиков является практически универсальным механизмом, поддерживающим внутренний баланс и способствующим сохранности здоровья организма человека. Существовавшая изначально для метаболизма эндогенных субстратов, система эволюционировала, адаптируясь к техногенному загрязнению окружающей среды. В её функционировании задействованы уникальные по своим свойствам ферменты: гемопротеид – цитохром Р450, низкомолекулярный трипептид - глутатион и др. С помощью целых семейств этих ферментов с одинаковой каталитической активностью и различной субстратной специфичностью метаболизируются сотни самых разных по химическому составу соединений. Одним из важнейших свойств системы метаболизма является индукция – активация транскрипции гена в присутствии субстрата. Тканеспецифичная экспрессия различных изоформ метаболизма определяет ее адаптацию к структурно-функциональной организации той или иной системы организма. Наибольшая экспрессия ферментов в печени обеспечивает наиболее активное участие этого органа в метаболизме ксенобиотиков. В совокупности все ферменты, участвующие в деградации молекул ксенобиотиков, функционируют как единый, четко скоординированный комплекс. Поэтому отклонение их функции неизменно приводит к вредным для организма человека последствиям. Это обстоятельство подтверждают многочисленные исследования о функционировании системы метаболизма при различных воздействиях окружающей среды и патологических состояниях [Lin et al., 1998; Иващенко и др., 2000; Ляхович и др., 2000, 2002; Delfino et al., 2000; Вавилин и др., 2002; Rollinson et al., 2003; Бикмаева и др., 2004].
Согласно современным представлениям БА и ТБ относятся к группе дистропных болезней. Однако многочисленные проведенные исследования поиска генетической компоненты подверженности к этим заболеваниям показали ряд «общих» генов, белковые продукты которых задействованы на всех этапах патогенеза. С этой точки зрения целесообразным и перспективным представлялся сравнительный анализ полиморфных вариантов генов системы метаболизма ксенобиотиков, поскольку кодируемые ими ферменты задействованы в деградации эндогенных субстратов, а именно многочисленных медиаторов воспаления (простагландинов, лейкотриенов и т. д.), что легло в основу настоящего исследования.
Ряд работ показал связь генов ферментов метаболизма ксенобиотиков с развитием БА и её клиническими проявлениями в различных популяциях [Luszawaka-Kutrzela, 1999; Ляхович и др., 2000, 2002; Fryer et al., 2000; Иващенко и др., 2001; Gawronska-Szklarz et al., 2001; Вавилин и др., 2002; Gilliand et al., 2002; Сафронова и др., 2003; Brasch-Andersen et al., 2004; Tamer et al., 2004; Carroll, 2005]. Однако, учитывая значительные этнические различия в полиморфизме генов этой системы, существует противоречивая информация об их значимости для развития заболевания.
При оценке роли полиморфизма генов метаболизма ксенобиотиков для развития БА у жителей г. Томска показана ассоциация полиморфизма генов ферментов как I-й – CYP2E1, так и II фазы – GSTM1 с заболеванием.
Для носителей делеции гена GSTM1, приводящей к утрате активности соответствующего фермента, существует возможность дисбаланса процессов детоксикации экзогенных и эндогенных веществ, что повышает для них в два раза риск развития заболевания БА по сравнению с индивидами, имеющими функциональный генотип. Следует отметить, что подобные данные были получены во многих исследованиях, как для европеоидных, так и для монголоидных популяций [Вавилин и др., 2002; Ляхович и др., 2000; Zhang et al., 2004]. Можно предполагать, что эта ассоциация является важным следствием множественности биологических функций глутатионовых S-трансфераз и обусловлена их участием в метаболизме эндогенных медиаторов воспаления (простагландинов Н2, E2, F2a, лейкотриена С4). Однако интересно, что в проявлении тяжести заболевания не отмечена значимость этого гена, а у пациентов с легкой степенью тяжести преобладал делеционный генотип гена GSTT1. Тяжесть БА определяется многими факторами (пол, возраст начала, отягощенная наследственность, предшествующее лечение, сопутствующие аллергические заболевания), и в настоящее время нет четких представлений о формировании клинического полиморфизма заболевания [Огородова и др., 2002]. В данном случае, можно лишь предполагать, что при наличии отчетливо неблагоприятного генотипа, развитие патологического процесса может сдерживаться присутствием в геноме индивида генов, контролирующих выработку белковых структур, которые препятствуют развитию более тяжелой степени течения БА.
В ходе исследования были получены данные о связи ТБ с другими генами системы метаболизма. Так, в отношении инфекционного заболевания показана протективная роль полиморфиза 313A>G гена GSTP1 фермента II-й фазы метаболизма. Эта ассоциация объясняется с позиции высокой экспрессии глутатионовой S-трансферазы π1 в легких, защищающих таким образом человека на пути воздействия на организм токсичных агентов окружающей среды (например, химических соединений, содержащихся в табачном дыме и выхлопных газах), которые можно отнести к факторам, провоцирующим развитие ТБ.
Анализ полиморфизма исследуемых генов в формировании и степени выраженности клинических проявлений ТБ показал, что последствия возможной активации CYP2C19 нарушают оксидантное равновесие при уже развившемся заболевании, а развитие окислительного стресса способствует усилению процессов деструкции в легочной ткани.
Несомненно, единственной причиной развития ТБ является инфицирование организма M. tuberculosis. Однако дальнейшая судьба возбудителя болезни зависит от многих факторов, которые в совокупности определяют полиморфизм клинических форм заболевания. Так, показаны различия между группами больных с ТБ внутригрудных лимфоузлов и инфильтративным ТБ для полиморфизма 313A>G гена GSTP1, играющего роль в подверженности к заболеванию.
В исследованиях дизайна «случай-контроль» особую важность приобретает использование для анализа ассоциаций генетических факторов с заболеванием семейного материала, позволяющего проследить наследование аллелей, связанных с болезнью. В ходе данного исследования показано предпочтительное наследование аллеля 313G гена GSTP1 больными БА потомками от гетерозиготных родителей.
Важная информация о взаимодействии ферментов системы метаболизма двух фаз для оценки их вклада в подверженность к заболеваниям была получена при анализе носителей определенных сочетаний генотипов. Отмечена комбинация генотипов генов ферментов II фазы метаболизма GSTM1 и GSTP1, оказывающая протективную роль как в отношении развития БА, так и ТБ. В большинстве случаев протективная роль комбинаций генотипов в отношении БА показана при сочетании аллелей генов, которые обеспечивают полноценное функционирование соответствующих ферментов системы метаболизма обеих фаз. Выявлена комбинация генотипов полиморфных вариантов генов GSTM1 и CYP2E1, предрасполагающая к развитию БА, но оказывающая протективную роль в отношении ТБ. Среди всех проанализированных комбинаций полиморфных вариантов генов не показано ни одного сочетания, имеющего патогенетическую значимость в развитии ТБ. Полученные данные свидетельствуют, что эффекты комбинаций определенных генотипов генов ФМК различны в развитии БА и ТБ.
Следующим этапом исследования было изучение связи исследуемых полиморфных вариантов генов с количественными лабораторными показателями, характеризующими особенности течения различных по этиологии и патогенезу заболеваний. Учитывая варьирование количественных признаков в зависимости от пола, оценка вклада полиморфизма генов системы биотрансформации ксенобиотиков была проведена отдельно для мужчин и женщин и показала участие генов ферментов как I-й так и II-й фаз метаболизма. Так отмечена связь гена CYP2C19 с изменчивостью IgE у женщин и GSTM1 – с показателем форсированной жизненной емкости легких, которые относятся к важным количественным характеристикам проявлений БА. Оценка гематологических показателей крови у мужчин, больных ТБ выявила связь полиморфизма гена CYP2C19 с изменчивостью уровня эритроцитов в периферической крови. Неодинаковый характер ассоциаций генов ферментов метаболизма с количественными признаками у мужчин и женщин позволяет предположить, что та часть структуры наследственной компоненты предрасположенности к заболеваниям, которая связана с полиморфизмом этих генов, неодинакова у представителей разного пола, что выражается в дифференциальной частоте многих болезней у мужчин и женщин в одной популяции.
Особую ценность для практического здравоохранения приобретают результаты настоящего исследования в свете участия генов ферментов метаболизма ксенобиотиков в формировании гепатотоксичных реакций на противотуберкулезную терапию. Выявленная ассоциация повышения активности аланинаминотрансферазы после лечения антимикобактериальными препаратами с полиморфным вариантом гена GSTP1 в дальнейшем может использоваться для разработки комплекса профилактических мер по предотвращению побочных реакций от химиотерапии ТБ.
В целом, полученные результаты свидетельствуют, что наличие определенных генотипов и их комбинаций генов ферментов метаболизма ксенобиотиков может оказывать существенное влияние на предрасположенность и формирование клинического фенотипа БА и ТБ. Сравнительный анализ участия генов ферментов биотрансформации ксенобиотиков в развитии БА и ТБ позволил раскрыть некоторые генетические аспекты этих дистропных заболеваний. В ходе исследования показана дифференциация генов, задействованных в формировании клинического фенотипа заболеваний: гены GSTM1 и CYP2E1 связаны с БА и ее клиническими проявлениями, а GSTP1 - с развитием ТБ. Из исследуемых полиморфных вариантов генов ферментативной системы биотрансформации отмечен «общий» ген – CYP2C19, ассоциированный с изменчивостью признаков, характеризующих некоторые особенности течения этих двух заболеваний. Одним из предполагаемых функциональных механизмов, лежащих в основе полученных ассоциаций, может быть участие белковых продуктов соответствующих генов в метаболизме эндогенных ксенобиотиков, в том числе многочисленных медиаторов воспалительных реакций. Актуальность продолжения исследований сравнительного характера клинически различных групп заболеваний не вызывает сомнения, поскольку полученные результаты позволяют не только приблизиться к пониманию молекулярно-генетических основ подверженности к ним, но и в дальнейшем открывают перспективы профилактики их развития.
ВЫВОДЫ:
1. Исследованная выборка русских жителей города Томска по частотам аллелей и генотипов полиморфных вариантов генов цитохромов Р450 - CYP2C19 (681G>A), CYP2E1 (7632T>A; 1293G>C) и глутатионовых S-трансфераз – GSTT1 (делеция), GSTM1 (делеция), GSTP1 (313A>G) соответствует таковым для европеоидных популяций.
2. Риск развития бронхиальной астмы увеличивают «нулевой» генотип гена GSTM1 и гетерозиготный генотип по полиморфизму 7632T>A гена CYP2E1. Генотип G/G полиморфизма 313A>G гена GSTP1 снижает риск развития туберкулеза (OR=0,43; 95%CI: 0,20-0,91; p=0,026).
3. «Нулевой» генотип гена GSTT1 (р=0,045) выступает в качестве фактора, определяющего легкое течение бронхиальной астмы. Для полиморфного варианта 313A>G гена GSTP1 установлена ассоциация с инфильтративной формой туберкулеза (р=0,026); гомозиготный генотип *1/*1 полиморфизма 681G>A гена CYP2C19 преобладал у больных с распространенным процессом в легочной ткани (р=0,040).
4. Аллельные варианты генов ферментов метаболизма ксенобиотиков ассоциированы с «количественными фенотипами» болезней: для больных бронхиальной астмой отмечены связь полиморфизма 681G>A гена CYP2C19 с изменчивостью уровня IgE (р=0,044), делеционного полимофизма гена GSTM1 с изменчивостью форсированной жизненной емкости легких (p=0,021) у женщин; у мужчин, больных туберкулезом полиморфизм гена CYP2C19 связан с некоторыми гематологическими показателями – в частности, с уровнем эритроцитов (р=0,027).
5. Протективное значение имеет комбинация генотипов GSTM1+ и GSTP1 G/G в развитии бронхиальной астмы (OR=0,10; 95% CI: 0,0-0,76; p=0,018) и туберкулеза (OR=0,37; 95% CI: 0,14-0,98; p=0,045). Подверженность к астме увеличивают комбинации генотипов GSTT1+ и GSTM1 0/0 (OR=1,89; 95% CI: 1,13-3,19; р=0,015) и GSTM1 0/0 и CYP2E1 T/A (OR=3,18; 95% CI: 1,31-7,87; р=0,008), генотипическая комбинация GSTM1 0/0 и CYP2E1 T/A обеспечивает резистентность к туберкулезу (OR=0,15; 95% CI: 0,06-0,42; р=0,000).
6. У больных туберкулезом легких показано статистически значимое увеличение уровня показателей печеночной функции при применении антимикобактериальных препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021).
7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и количественными признаками, а GSTP1 и CYP2C19 ассоциированы с туберкулезом и клиническими проявлениями инфекционной патологии.
ЛИТЕРАТУРА
1. Авербах М. М. Иммунология и иммунопатология туберкулеза. — М.: Медицина, 1976. - 311 с.
2. Аксенович Т.И Статистические методы генетического анализа признаков человека: Учеб. Пособие / Новосиб. гос. ун-т. Новосибирск, 2001. - 128 с.
3. Афанасьева И.С., Спицин В.А. Наследственный полиморфизм глутатион S-трансферазы печени человека в норме и при алкогольном гепатите // Генетика. – 1990. – Т. 26 (7). – С. 1309-1314.
4. Баранов В.С., Баранова Е.В., Иващенко Т.Э. и др. Геном человека и гены «предрасположенности». (Введение в предиктивную медицину).- СПб.: Интермедика, 2000.- 272 с.
5. Бикмаева А.Р., Сибиряк С.В., Хуснутдинова Э.К. Инсерционный полиморфизм гена CYP2E1 у больных инфильтративным туберкулезом легких в популяциях республики Башкортостан // Молекулярная биология. – 2004. – Т. 38. -№ 2. – С. 239-243.
6. Бикмаева А.Р., Сибиряк С.В., Хуснутдинова Э.К. Инсерционный полиморфизм гена CYP2E1 у больных инфильтративным туберкулезом легких и в популяциях республики Башкортостан // Молекулярная биология. – 2004. – Т. 38. - № 2. – С. 239-243.
7. Бочков Н.П., Захаров А.Ф., Иванов В.И. Медицинская гентика. – М.: Медицина, 1984. – 366 с.
8. Вейр Б. Анализ генетических данных: Пер. с англ. – М.: Мир, 1995. – 400 с.
9. Вавилин В. А., Макарова С. И., Ляхович В, В. и др. Ассоциация полиморфных ферментов биотрансформации ксенобиотиков с предрасположенностью к бронхиальной астме у детей с наследственной отягощенностью и без таковой // Генетика. – 2002. – Т. 38. - № 4. – С. 539-545.
10. Гинтер Е.К. Популяционная генетика и медицина // Вестник РАМН. – 2001. - № 10. – С. 25-31.
11. Гланц С. Медико-биологическая статистика. – М.: Практика, 1998. — 459 с.
12. Глебович О. В. Диагностическая ценность исследования пунктата грудины при туберкулезе легких. - Ленинград., 1951. – 132 с.
13. Гончарова И. А., Фрейдин М. Б., Дунаева Л. Е., Белобородова Е. В., Белобородова Э. И., Пузырев В. П. Анализ связи полиморфизма Ile50Val гена рецептора интерлейкина-4 (IL4RA) с хроническим вирусным гепатитом // Молеклярная биология. – 2005. – Т. 3. - № 3. – С. 379-384.
14. Гриппи М.А. Патофизиология легких. – М.: Восточная книжная компания, 1997. – 344 с.
15. Гусев В.А., Даниловская Е.В. Роль активных форм кислорода в патогенезе пневмокониозов // Вопр. мед. химии. – 1987. - № 5. – С. 9-15.
16. Животовский Л. А. Интеграция полигенных систем в популяциях. Проблемы анализа комплекса признаков. – М.: Наука, 1984. – 183 с.
17. Земскова З. С., Дорожкова И. Р. Скрыто протекающая туберкулезная инфекция. – М.: Медицина, 1984. – 224 с.
18. Иващенко Т. Э., Сиделева О. Г., Петрова М. А. и др. Генетические факторы предрасположенности к бронхиальной астме // Генетика. – 2001. – Т. 37., № 1. – С. 107-111.
19. Ильина Н.И. Эпидемия аллергии – в чем причины? // Консилиум-медикум. – 2001. – Приложение. – С. 3-5.
20. Кан Е. Л. Изменения в системе крови и их диагностическое значение // Руководство по туберкулезу органов дыхания. - 1972. — С. 116—128.
21. Крынецкий Е.Ю. Полиморфизм ферментов, участвующих в метаболизме лекарственных средств: структура генов и ферментативная активность // Молекулярная биология. – 1996. – Т.31 Выпуск 1. – 33-42.
22. Кулинский В.И. Обезвреживание ксенобиотиков // Cоросовский образовательный журнал. – 1999. - № 1. – С. 8-12.
23. Лакин Г. Ф. Биометрия: Учеб. Пособие для биол. Спец. ВУЗов – 4-е изд., перераб. И доп. – М.: Высш. шк., 1990. – 352 с.
24. Лильин Е. Т., Трубников В. И., Ванюков М. М. Введение в современную фармакогенетику. – М.: Медицина, 1984. – 160 с.
25. Литвинов В. И., Чуканова В. П., Маленко А. Ф. и др. Проблемы иммуногенетики болезней легких // Сборник трудов Центр. научн-исслед. ин-та туберкулеза. – 1983. – Т. 37. – С. 16-19.
26. Литвинов В. И., Чуканова В. П., Поспелов Л. Е. и др. Роль иммуногенетических факторов при легочной патологии // Всесоюзный съезд фтизиаторов, 10-й. – Харьков, 1986. – С. 71-71.
27. Ляхович В. В., Вавилин В. А., Макарова С. И. и др. Роль ферментов биотрансформации ксенобиотиков в предрасположенности к бронхиальной астме и формировании особенностей ее клинического фенотипа // Вестник РАМН. – 2000. - № 12. – С. 36-41.
28. Ляхович В. В., Гавалов С. М., Вавилин В.А. и др. Полиморфизм генов ферментов биотрансформации ксенобиотиков и особенности бронхиальной астмы у детей // Пульмонология. – 2002. – Т. 12. - № 2. – С. 31-38.
29. Ляхович В.В., Цырлов И.Б. Индукция ферментов метаболизма ксенобиотиков - Новосибирск: Наука, 1981. – 242 с.
30. Маниатис Т., Фрич Э., Сэмбук Дж. Методы генетической инженерии. Молекулярное клонирование. – М.: Мир, 1984. – 480 с.
31. Меньшиков В. В. Лабораторные методы исследования в клинике. - М.: Медицина, 1987. - 350 с.
32. Меньщикова Е.Б., Зенков Н.К. Метаболическая активность гранулоцитов при хронических неспецифических заболеваниях легких // Терапевт. арх. – 1991. - № 11. – С 85-85.
33. Милосердова А. И. Система крови при первичном туберкулезе и туберкулезном менингите у детей и ее изменение при химиотерапии: Автореф. дисс. … док-ра. мед. наук. - Кишенев, 1958. – 48 с.
34. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика»: - М., 1997 г. – 93 с.
35. Огородова Л.М., Петровская Ю.А., Камалтынова Е.М. с соавт. Тяжелая бронхиальная астма у детей: факторы риска, течение // 2002. – С. 68-71.
36. Поспелов Л. Е., Серова Л. Д., Маленко А. Ф. и др. Изучение связи распределения антигенов локуса HLA-DR и туберкулеза в различных популяциях // Пробл. туб. – 1987. - № 10. – С. 54-56.
37. Проблемы наследственности при болезнях легких / Под ред. А. Г. Хоменко. – М.: Медицина, 1990. – 240 с.
38. Пузырев В. П., Фрейдин М. Б., Рудко А. А., Стрелис А. К., Колоколова О. В. Анализ взаимосвязи полиморфных маркеров генов NRAMP1 и IL12p40 и туберкулеза // Медицинская генетика. – 2002. – Т. 1. - № 1. С. 44-46.
39. Пузырев В. П., Фрейдин М. Б., Огородова Л. М., Кобякова О. С. Взаимосвязь полиморфных вариантов генов интерлейкинов и их рецепторов с атопической бронхиальной астмой // Медицинская генетика. – 2002. – Т. 1. - № 2. – С. 86-92.
40. Пузырев В. П., Фрейдин М. Б., Рудко А. А., Стрелис А. К., Колоколова О. В. Полиморфизм генов-кандидатов подверженности к туберкулезу у славянского населения Сибири: пилотное исследование // Молекулярная биология. – 2002. – Т. 36. - № 5. – С. 788-791.
41. Пузырев В. П., Степанов В. А., Назаренко С. А. Геномные исследования наследственной патологии и генетическое разнообразие сибирских популяций // Молекулярная биология. – 2004. – Т. 38. - № 1. – С. 129-138.
42. Пузырев В.П. Генетика мультифакториальных заболеваний: между прошлым и будущим // Медицинская генетика. – 2003. – Т. 2. № 12. – С. 498-508.
43. Пузырев В. П. Вольности генома и медицинская патогенетика // Бюл. Сиб. Медицины. – 2002. - Т. 2. – С. 16-29.
44. Пузырев В. П. Феном и гены-синтропии // Генетика человека и патология: Сб. науч. трудов / Под ред. В. П. Пузырева. – Вып. 7. – Томск: Печатная мануфактура, 2004. – 296 с.
45. Пузырев В.П., Никитин Д.Ю., Напалкова О.В. Ген NRAMP1: структура, функция и инфекционные болезни человека // Молекулярная генетика, микробиология и вирусология. – 2002. – №3. – С.34-40.
46. Пузырев В.П., Степанов В.А. Патологическая анатомия генома // Новосибирск: «Наука». – 1997. – 224 с.
47. Рабухин А. Е. Туберкулез органов дыхания у взрослых. - М.: Медицина, 1976. - 328 с.
48. Радзинский А. Г. Гематологическая характеристика свежих неослажненных случаев туберкулеза легких при антибактериальной терапии // Врачебное дело. - 1961. - № 4.- С. 61-66.
49. Райс Р. Х., Гуляева Л. Ф. Биологические эффекты токсических соединений: курс лекций / Новосиб. Гос. Ун-т. – Новосибирск. – 2003. – 208 с.
50. Российская Научно-практическая программа «Бронхиальная астма у детей: диагностика, лечение и профилактика» Москва, 2004. – 46 с.
51. Рудко А.А., Ондар Э.А., Фрейдин М.Б., Пузырев В.П. Генетика подверженности к туберкулезу у тувинцев // Вестник этнической медицины. – 2004. - Т.1. - №1. – С. 17-21.
52. Сафронова О. Г., Вавилин В. А., Ляпунова А. А. Взаимосвязь между полиморфизмом гена GSTP1 и бронхиальной астмой и атопическим дерматитом // Бюл. Эксп. Биол. Мед. – 2003. – Т. 136. - № 1. – С. 73-75.
49. Сибиряк С. В. Цитокины как регуляторы цитохром Р-450 –зависимых монооксигеназ Теоретические и прикладные аспекты // Цитокины и воспаление. – 2003. - №2. – Р. 27-31.
53. Состояние противотуберкулезной помощи неселению Сибирского и Дальневосточного Федеральных округов по итогам работы в 2003 г. / Под общей редакцией Заслуженного врача Российской Федерации д.м.н., профессора В. А. Краснова. – Новосибирск. – 2004. – 44 с.
54. Тиунов Л.А., Головенко Н.Я., Галкин Б.Н., Баринов В.А. Биохимические механизмы токсичности окислов азота // Успехи соврем. биологии. – 1991. – Т. 111, вып. 5. – С. 738-750.
55. Фогель Ф., Мотульски А. Генетика человека. В 3-х т./ Пер. с англ. – М.: Мир, 1990.
56. Фрейдин М.Б., Кобякова О.С., Огородова Л.М. с соавт. Наследуемость уровня общего интерлейкина-5 и полиморфизм С-703Т гена IL5 у больных бронхиальной астмой // Бюлл. Эксп. Биол. Мед. – 2000. – Т. 129 (прил. 1). – С. 50-52.
57. Фрейдин М.Б., Огородова Л.М., Пузырев В.П. Вклад полиморфизма генов интерлейкинов в изменчивость количественных факторов риска атопической бронхиальной астмы // Медицинская генетика. – 2003. - Т.2. -№ 3. – С. 130-135.
58. Хоменко А. Г., Литвинов В. И., Чуканова В. П. и др. Антигены комплекса HLA у больных туберкулезом и здоровых лиц в различных популяциях // Иммунология. – 1985. - № 1. – С. 22-24.
59. Цинзерлинг А.В., Цинзерлинг В.А. Патологическая анатомия // Учебник для педиатрических факультетов медицинских вузов. – Сотис. Санкт-Петербург. – 1996. – 369 с.
60. Чучалин А.Г. Генетические аспекты бронхиальной астмы // Пульмунология. – 1999. - № 12. – Р. 6-10.
61. Шайхаев Г.О. Туберкулез проблема не только социальная… // Природа. – 1999. - № 10. – С. 8-12.
62. Шангареева З.А., Викторова Т.В., Насыров Х.М. и др. Анализ полиморфизма генов, участвующих в метаболизме этанола, у лиц с алкогольной болезнью печени // Медицинская генетики. – 2003. - Т. 2. – № 11. – С. 485-490.
63. Шарафисламова Э.Ф., Викторова Т.В., Хуснутдинова Э.К. Полиморфизм генов глутатион S-трансфераз М1 и Р1 у больных эндометриозом из Башкортостана // Медицинская генетика. – 2003. - Т. 2. – №. 3. – С. 136-140.
64. Шмелев Н. А. Цитологический анализ крови и его значение при туберкулезе. - М., 1959. – 140 с.
65. Adjers K., Pessi T., Karjalainen J. et al. Epistatic effect of IL1A and IL4RA genes on the risk of atopy // J. Allergy Clin. Immunol. – 2004. – V. 113. - № 3. – P. 445-7.
66. Al-Arif L., Affronti L. F., Goldstein R. Predposition a la tuberculose et antigenes HLA dans une population noire de Washington // Bull. Union int. contre Tuberc. – 1979. – V. 54. - № 2. – P. 151-159.
67. Alexandrie A.K., Ingelman-sundberg M., Seidegaard J. et al Genetic susceptibility to lung cancer: a study of host factors in relation to age of onset and histological cancer types // Carcinogenesis (Lond.). – 1994. – V. 15. – P. 1785-1790.
68. Anderson G. G., Cookson W. O. C. M. Recent advances in the genetics of allergy and asthma // Mol. Med. Today. - 1999. – V. 5. – P. 264-273.
69. Anttila S., Luostarinen L., Hirvonen A. et al. Pulmonary expression of glutathione S-transferase M3 in lung cancer patients: assotiation with GSTM1 polymorphism, smoking, and asbestos exposure // Cancer Res. – 1995. - V. 55.– P. 3305-3309.
70. Arai K.I., Lee F., Miyajima A. et al. Cytokines co-ordinators of immune and inflammatory responses // Ann. Rev. Biochem. – 1990. – V. 59. – P. 783-802.
71. Awasthi S. S., Srivastava F. K., Ahmad F. et al. Interaction of glutathione S-transferase-pi with ethacrynic acid and its glutathionic conjugate // Biochem. Biophys. Acta. – 1993. – V. 1164. – P. 173-178.
72. Baldini M., Lohman I.C., Halonen M et al. A Polymorphism in the 5’ flanking region of the CD14 levels and with total serum immunoglobulin E // Am. J. Respir. Cell Mol. Biol. – 1999. – V. 20. – P. 976 -983.
73. Bartsch H., Nair U., Risch A. et al. Genetic polymorphism of CYP genes, alone or in combination, as a risk modifier of tobacco-related cancers // Cancer Epidemiology, Biomarkers and Prevention. – 2000. – V. 9. – P. 3-28.
74. Beckett G.J., Hayes J.D. Glutathione S-transferases: biomedical applications // Adv. Clin. Chem. – 1993. – V. 30. – P. 281-380.
75. Bellamy R. Identifyng genetic susceptibility factors for tuberculosis in African: a combined approach using a candidate gene study and a genome-wide screen // Clinical Science. – 2000. – V. 98. – P. 245-250.
76. Bellamy R., Ruwende C., Corra T. et al. Variation in the NRAMP1 gene and susceptibility to tuberculosis in West Africans // The New England Journal of Medicine. – 1998. – V. 338. - № 10. – P. 640-644.
77. Bertz R. J., Granneman G. R. Use of in vitro and in vivo date to estimate the likelihood of metabolic pharmacokinetic interactions // Clin Pharmacokinet. – 1997. – V. 32. – P. 210-258.
78. Board P.G., Webb G.C., Coggan M. Isolation of cDNA clone and localization of the human glutathione S-transferase 3 on chromosome bands 11q13 and 12q13-14 // Ann. Hum. Genet. – 1989. – V. 53. – P. 205-213.
79. Bornman L., Campbell S. J., Fielding K. et al. Vitamin D receptor polymorphisms and susceptibility to tuberculosis in West Africa: a case-control and family study // J. Jnfect. Dis. – 2004. - V. 190. - № 9. – P. 1631-1641.
80. Brasch-Andersen C, Christiansen L, Tan Q. Possible gene dosage effect of glutathione-S-transferases on atopic asthma: using real-time PCR for quantification of GSTM1 and GSTT1 gene copy numbers // Hum Mutat. – 2004. – V.24. - № 3. – Р. 208-214.
81. Brockmoller J., Cascorbi I., Kerb R. Combined analysis of inherited polymorphisms in arylamine N-acetyltransferase 2, glutathione S-transferase M1 and T1, microsomal epoxide hydrolase, and cytochrome P450 enzymes as modulators of bladder cancer risk // Cancer Res. – 1996. – V. 56. – P. 3915-3925.
82. Burchard E. G., Silverman E. K., Rosenwasser L. J. et al. Assotiation between a sequence variant in the IL4 promoter and FEV(1) in asthma // Am. J. Respir. Crit. Care Med. – 1999. - № 160. – P. 919-922.
83. Cannone-Hergaux F., Gruendheid S. et al The NRAMP1 protein and its role resistence to infection and makrophage funktion // Proc. Amer. Physicians. – 1998. – V. 111. - № 4. – P. 283-289.
84. Carroll W.D., Lenney W., Child F. et al. Maternal glutathione S-transferase GSTP1 genotype is a specific predictor of phenotype in children with asthma // Pediatr Allergy Immunol.- 2005. - V.1. - № 16. – P. 32-39.
85. Carter C.O. Polygenic inheritance in man // Br. Med. Bull. – 1996. – V. 25. – P. 52-57.
86. Cervino A. C. L., Lakiss S., Sow O. et al. Allelic assotiation between the NRAMP1 gene and susceptibility to tuberculosis in Guinea-Conakry // Ann. Hum. Genet. – 2000. – V. 64. – P. 507-512.
87. Chen H., Sandler D.P., Taylor J.A. et al. Increased risk for myelodysplastic syndromes in individuals with glutathione transferase theta 1 (GSTT1) gene defect // The lancet. – V. 347. – 1996. – P. 295-297.
88. Chung K.F., Barnes P.J. Cytokines in asthma // Thorax. – 1999. – V. 54. – P. 825-857.
89. Cristina E. Mapp MD, Anthony A.et al. Glutathione S-transferase GSTP1 is a susceptibility gene for occupational asthma induced by isocyanates // Environmental and Occupational Disorders. – 2002.
90. Crump C., Chen C., Appelbaum F.R. et al. Glutathione S-transferase theta 1 gene deletion and risk of acute myeloid leukemia // Cancer Epidemiology, Biomarkers & Prevention. – V. 9. – 2000. – P. 457-460.
91. Cytochrome P450 [Электронный ресурс]. – Режим доступа: http://drnelson.utmem.edu/Cytochrome P450.html/
92. Daniels S.E., Bhattacharrya B., James A. et al. A genome-wide search for quantitative trait loci underlying asthma. // Nature. – 1996. – V. 383. – P. 247-250.
93. De Long J.L., Chang T.M., Whang-Peng J. et al. The human liver glutathione S-transferase gene superfamily: expression and chromosome mapping of an Hb subunit cDNA // Nucleic. Acid Res. – 1988. – V. 16. – P.8541-8554.
94. De Morais S. M. F, Wilkinson G. R., Blaisdell J. et al. The major genetic defect responsible for the polymorphism of S-mephenytoin metabolism in human // J. Biol. Chem.-1994.- V. 269.- №22. - P. 15419-15422.
95. Delfino R.J., Sinha R., Smith S. et al., Breast cancer, heterocyclic aromatic amines from meat and N-acetyltransferase 2 genotype // Carcinogenesis. – 2000. – V. 21. – P. 607-615.
96. Denison M.S. Whitlock J.P.Jr. Xenobiotic-inducible transcription of cytochrome P450 genes // J. Biol. Chem. - 1995. – V. 270. – P. 18175-18178.
97. Dickinson D.S., Bailey W.C., Hirschowihz B.I. et al. Risk factors for isiniazid induced liver dysfunction // J. Clin Gastroenterol. – 1981. – V. 3. – P. 271-279.
98. Directory of P450-containing systems [Электронный ресурс]. – Режим доступа: http://www.icgeb.trieste.it/~p450srv/
99. Dirksen U., Moghadam K. A., Mambetova C. et al. Glutathione S-transferase theta 1 gene (GSTT1) null genotype is associated with an increased risk for acquired aplastic anemia in children // Pediatric Research. – 2004. – V. 55. – P. 466-471.
100. Dizier M. H., Sandford A., Walley A. et al. Indication of linkage of serum IgE levels to the interleukin-4 gene and exclusion of the contribution of the (-590 C to T) interleukin-4 promoter polymorphism to IgE variation // Genet. Epidemiol. – 1999. - № 16. – P. 84-94.
101. Drysdale C. M., McGraw D. W., Stack C. B. et al. Complex promoter and coding region beta 2-adrenergic receptor haplotypes alter receptor expression and predict in vivo responsiveness // Proc. Nat. Acad. Sci. USA. – 2000. - № 97. – P. 10483-10488.
102. Duffy D. L., Martin N. G., Battistutta D. et al. Genetics of asthma and hay fever in Australian Twins // Am. Rev. Respir. Dis. – 1990. – V. 142. - № 6 (Pt. 1). – P. 1351-1358.
103. Eaton D.L., Bammler T.K. Concise review of the glutathione S-transferases and their significance to toxicology // Toxicol. Sci. – 1999. – V. 49. – P. 156-164.
104. Eder W, Klimecki W, Yu L et al. Toll-like receptor 2 as a major gene for asthma in children of European farmers // J. Allergy Clin. Immunol. - 2004. – V. 113. - № 3. – P. - 482-488.
105. Edfors-Lubs M. L. Allergy in 7000 twin pairs // Acta Allergol. – 1971. – V. 26. - № 4. – P. 249-285.
106. Engel G.,Hofman U., Heidemann H. et al. Antipyrine as a probe for human oxidative drug metabolism: identification of the cytochrome P450 enzymes catalyzing 4-hydroxyantipyrine, 3- hydroxymethylantipyrine, and norantipyrine formation // Clin. Pharmacol. Ther. – 1996. – V. 59. - № 6. – P. 613-623.
107. Evans W. E., Relling M. V. Pharmacogenomics: translating functional genomics into rational theurapeutics // Science. – 1999. – V. 286. – P. 487-491.
108. Fageras Bottcher M., Hmani-Aifa M., Lindstrom A. et al. A TLR4 polymorphism is associated with asthma and reduced lipopolysaccharide-induced interleukin-12(p70) responses in Swedish children // J. Allergy Clin. Immunol. – 2004. – V. 114. - № 3. – P. 561-567.
109. Farker K., Lehmann M. H., Oelschlagel B. et al. Impact of CYP2E1 genotype in renal cell and urothelial cancr patients // Exp. Toxicol. Pathol. – 1998. - V. 50. – P. 425-431.
110. Frayer A.A., Hume R., Strange R.C. The development of glutathione S-transferase and glutathione peroxidase activities in human lung // Biochim. Biophys. Acta. – 1986. - № 883. – P. 448-453.
111. Freidin M.B., Kobyakova O.S., Ogorodova L.M. et al. Association of polymorphisms in the human IL4 and IL5 genes with atopic bronchial asthma and severity of the disease // Comp. Funct. Genom. – 2003. - № 4. – P. 346-350.
112. Freimer N., Sabatti C. The human phenome project // Nat. Genet. – 2003. – V. 34. - № 1. – P. 15-21.
113. Frodsham A. J., Hill A. S. Genetics of infections diseases // Hum. Mol. Genet. – 2004. – V. 13. – Review Issue 2. – P. 187-194.
114. Fryer A. A., Bianco A., Hepple M. et al. Polymorphism at the glutathione S-transferase GSTP1 locus. A new marker for bronchial hyperresponsiveness and asthma // Am. J. Respir. Crit. Care Med. – 2000. – V. 161. – P. 1437-1442.
115. Fukai H., Ogasawara Y., Migita O. et al. Association between a polymorphism in cysteinyl leukotriene receptor 2 on chromosome 13q14 and atopic asthma // Pharmacogenetics. – 2004. – V. 14. - №10. – P. - 683-90.
116. Gao P. S., Mao X. Q., Baldini M. et al. Serum total IgE levels and CD14 on chromosome 5q31 // Clin. Genetic. – 1999. – V. 56. – P. 164-165.
117. Gao P.-S., Fujishima S., Mao X.-Q., et al. Genetic variants of NRAMP1 and active tuberculosis in Japanese populations // Clin. Genet. – 2000. – V. 58. – P. 74-76.
118. Gawronska-Sklarz B., Pawlik A., Czaja-Bulsa G. et al. Genotype of N-acetyltransferase 2 (NAT2) polymorphism in children with immunoglobulin E-mediated food allergy // Clin. Pharmacol. Ther. – 2001. – V. 69. - № 5. – P. 372-378.
119. Gilliand F. D., Li Y.-F., Dubeau L. et al. Effects of glutathione S-transferase M1, maternal smoking during pregnancy, and environmental tobacco smoke on asthma and wheezing in children // Am. J. Respir. Crit Care Med. – 2002. – V. 166. – P. 457-463.
120. Gonzalez F.J. Molecular biology and regulation of phase I enzymes // Abstr. of 5th European ISSX Meeting, Tours. September, 26-29. – 1993. – V. 3. – P. 139.
121. Graves P. E., Kabesch M., Halonen M. et al. A cluster of seven tightly linked polymorphisms in the IL-13 gene associated with total serum IgE levels in three populations of white children // J. Allergy Clin. Immunol. – 2000. - № 105. – P. 506-513.
122. Greenwod C.M.T., Fujiwara M.T. Linkage of tuberculosis to chromosome 2q35 loci, including NRAMP1, in a large aboriginal Canadian family // Am. J. Hum. Genet. – 2000. – V. 67. – P. 405-416.
123. Guengerich F.P. Cytochrome P450s, drugs and diseases // Molecular Interventions. – 2003. – V. 3. № 4. – P. 8-18.
124. Guengerich F.P. Role of cytochrome P450 enzymes in chemical carcinogenesis and cancer chemotherapy // Cancer Res. – 1988. – V. 48. – P. 2946-2954.
125. Haehner B.D, Gorski J.C., Vandenbranden M. et al. Bimodal distribution of renal cytochrome P450 3A activity in humans // Mol. Pharmacol. – 1996. – V. 50. – P. 52-59.
126. Hall I. P., Wheatley A., Christine G. et al. Assotiation of CCR5 delta32 with reduced risk of asthma // Lancet. – 1999. - № 354. – P. 1264-1265.
127. Hallier E., Langhof T., Dannappel D. et al. Polymorphism of glutathione conjugation of methyl bromide, ethylene oxide and dichloromethane in human blood: influence on the induction of sister chromatid exchanges (SCE) in lymphocytes // Arch. Toxicol. – 1993. – V. 67. - № 3. – P. 173-178.
128. Hasegawa K., Tamari M., Shao C. et al. Variations in the C3, C3a receptor, and C5 genes affect susceptibility to bronchial asthma // Hum Genet. – 2004. – V. 115. - № 4. – P. - 295-301.
129. Hayashi S., Watanabe J., Kawajiri K. Genetic polymorphisms in the 5’-flanking region change transcriptional regulation of the human cytochrome P450IIE1 gene // J. Biochem. – 1991. – V. 110. - P. 559-565.
130. Hayes J. D., McLellan L. I. Glutathione and glutathione-dependent enzymes represent a co-ordinately regulated defence against oxidative stress // Free Radic. Res. – 1999. – V. 31. – P. 273-300.
131. Hayes J. D., Strange R. C. Glutathione S-transferase polymorphisms and their biological consequences // Pharmacology. – 2000. – V. 61. – P. 154-166.
132. Heinzmann A., Mao X. Q., Akaiwa M. et al. Genetic variants of IL-13 signalling and human asthma and atopy // Hum. Mol. Genet. – 2000. - № 9. – P. 549-559.
133. Heinzmann A., Mao X. Q., Akaiwa M. et al. Genetic variants of IL-13 signalling and human asthma and atopy // Hum. Mol. Genet. – 2000. - № 9. – P. 549-559.
134. Heinzmann A., Plesnar C., Kuehr J. et al. Common polymorphisms in the CTLA-4 and CD28 genes at 2q33 are not associated with asthma or atopy // Eur J Immunogenet. – 2000. – V. 27. – P. 57-61.
135. Hershey G. K., Friedrich M. F., Esswein L. A. et al. The association of atopy with a gain-of-function mutation in the alpha subunit of the interleukin-4 receptor // N. Engl. J. Med. – 1997. - № 337. – P. 1720-1725.
136. Hill A. V. S. The immunogenetics of human infection diseases // Ann. Rev. Immunol. – 1998. - № 16. – P. 593-617.
137. Hill M. R. Cookson W. O. A new variant of the beta subunit of the high-affinity receptor for immunoglobulin E (Fc epsilon RI-beta E237G): associations with measures of atopy and bronchial hyper-responsiveness // Hum. Mol. Genet. – 1996. - № 5. – P. 959-962.
138. Hill M. R., James A. L., Faux J. A. et al. Fc epsilon RI-beta polymorhism and risk of atopy in general population sample // BMJ. – 1995. - № 311. – P. 776-779.
139. Hirota T., Obara K., Matsuda A. et al. Association between genetic variation in the gene for death-associated protein-3 (DAP3) and adult asthma // J. Hum. Genet. – 2004. – V. 49. - № 7. – P. - 370-375.
140. Hizawa N., Freidhoff L. R., Chiu Y. F. et al. Genetic regulation of Dermatophagoides pteronyssinus-specific IgE responsiveness: a genome-wide multipoint linkage analisis in families recruited through 2 asthmatic sibs. The Collaborative Study on the Genetics of Asthma (CSGA) // J. Allergy Clin Immunol. – 1998. - V. 102. – P. 436-442.
141. Hoffjan S, Ostrovnaja I, Nicolae D. et al. Genetic variation in immunoregulatory pathways and atopic phenotypes in infancy // J. Allergy Clin. Immunol. – 2004. – V. 113. - № 3. – P. - 511-518.
142. Holgate S.T., Cherch M.K., Howarth P.H. et al., Genetic and environmental influences on airway inflammation in asthma // Int. Arch. Allergy Immunol. - 1995. – V. 107. – P. 29-33.
143. Holla L.I., Schuller M., Buckova D. et al. Neuronal nitric oxide synthase gene polymorphism and IgE-mediated allergy in the Central European population // Allergy. – 2004. – V. 59. - № 5. – P. - 548-552.
144. Honkakoski P., Negishi M. Regulation of cytochrome P450 (CYP) genes by nuclear receptors // Biochem. J. – 2000. – V. 347. – P. 321-337.
145. Hu Y., Oscarson M., Johanson I. et al. Genetic polymorphism of human СYP2E1: a characterization of two variant alleles // Mol. Pharmacol. – 1997. – V. 51. – P. 370-376.
146. Huang S. K., Marsh D. G. Genetics of allergy // Ann. Allergy. – 1993. – V. 70. – P. 347-359.
147. Huang Y. S., Chern H. D., Su W. J. et al. Polymorphism of the N-acetyltransferase 2 gene as a susceptibility risk factor for antituberculosis drug-induced hepatits // Hepatology. – 2002. – V. 35. - № 4. – P. 883-889.
148. Huang Y.-S., Chern H.-D., Su W.-J. et al. Cytochrome P450 2E1 genotype and the susceptibility to antituberculosis drug-induced hepatitis // Hepatology. – 2003. – V. 37. - № 4. – P. 924-930.
149. Hytonen A. M, Lowhagen O., Arvidsson M. et al. Haplotypes of the interleukin-4 receptor alpha chain gene associate with susceptibility to and severity of atopic asthma // Clin Exp Allergy. – 2004. – V. 34. - № 10. - P. - 1570-1575.
150. Ibenau G.C., Blaisdell J., Chanayem B.I et al. An additional defective allele, CYP2C19*5, contributes to the S-maphenytoin poor metabolizer phenotype in Caucasians // Pharmacogenetics. – 1998. – V. 8. - № 2. – P. 129-135.
151. Ibenau G.C., Blaisdell J., Ferguson R. J. et al. A novel transversion in the intron 5 donor splice junction of CYP2C19 and a sequence polymorphism in exon 3 contribute to the poor metabolizer phenotype for the anticonvulsant drug S-mephenytoin // The J. Pharmacol. Exp. Ther. – 1999. – V. 290. - № 2. – P. 635-640.
152. Ingelman-Sundberg M. Human drug metabolizing cytochrome P450 enzymes: properties and polymorphisms // Arch Pharmacol. – 2004. – V. 369. – P. 89-104.
153. Ingelman-Sundberg M. Pharmacogenetics of cytochrome P450 and its applications in drug therapy: the past, present and future // Trends Pharmacol Sci. – 2004. – V. 25. - №. 4. – P. 193-200.
154. Ingelman-Sundberg M., Oscarson M., Persson I. et al. Genetic polymorphism of human drug metabolizing enzymes. Recent aspects on polymorphic forms of cytochromes P450 // European Commission. European cooperation in the field of scientific and technical research. COST B1 Conference on variability and specificity in drug metabolism. Edited by Alvan G. Brussels. – 1995. – P. 93-110.
155. Ioannides C., Lewis D. F. Cytochromes P450 in the bioactivation of chemicals // Curr. Top. Med. Chem. – 2004. – V. 4. - № 16. – P. 1767-1788.
156. Ishii T., Matsuse T., Teramoto S et al. Glutathione S-transferase P1 (GSTP1) polymorphism in patients with chronic obstructive pulmonary disease // Thorax. – 1999. – V.54. – P. 693-696.
157. Jang N., Stewart G., Jones G. et al. Polymorphisms within the PHF11 gene at chromosome 13q14 are associated with childhood atopic dermatitis // Genes Immun. – 2005. – V. 6. - № 3. – P. 262-264.
158. Ji X., Johnson W.W., Sesay M.A. et al. Structure and function of the xenobiotic substrate binding site of a glutathione S-transferase as revealed by X-ray crystallographic analysis of product complexes with the diasteriomers of 9-(S-glutathionyl)-10-hydroxy-9,10-dihydrophenantrene // Biochemistry. – 1994. – V. 33. – P. 1043-1052.
159. Jiang Z. F., Aw J. B., Sun Y. P. et al. Assotiation of HLA-Bw35 with tuberculosis in the Chinese // Tiss. Antigens. – 1983. – V. 22. - № 1. - P. 86-88.
160. Jourenkowa-Mironova N., Wikman H., Bouchardy C. et al. Role of glutathione S-transferase GSTM1, GSTM3, GSTP1 and GSTT1 genotypes in modulating susceptibility to smoking-related lung cancer // Pharmacogenetics. – 1998. – V. 8. – P. 495-502.
161. Kabesch M., Carr D., Weiland S. K. et al. Association between polymorphisms in serine protease inhibitor, kazal type 5 and asthma phenotypes in a large German population sample // Clin. Exp. Allergy. – 2004. – V. 34. - № 3. – P. 340-345.
162. Katoh T., Kaneko S., Jakasawa S. et al. Human glutathione S-transferase P1 polymorphism and susceptibility to smoking related epithelial cancer; oral, lung, gastric, colorectal and urothelial cancer // Pharmacogenetics. – 1999. -V. 9. – P. 165-169.
163. Kawashima T., Noguchi E., Arinami T. et al. Linkage and association of an interleukin 4 gene polymorphism with atopic dermatitis in Japanese families // J. Med. Genet. – 1998. - № 35. – P. 502-504.
164. Kedda M. A, Shi J., Duffy D. et al. Characterization of two polymorphisms in the leukotriene C4 synthase gene in an Australian population of subjects with mild, moderate, and severe asthma // J. Allergy Clin. Immunol. – 2004. – V. 113. - № 5. – P. - 889-95.
165. Kharasch E. D., Thummel K. E., Mhzyre J. et al. Single-dose disulfiram inhibition of chlorzoxazone metabolism // Clin Pharmacol Ther. – 1993. – V. 53. – P. 643-650.
166. Kihara M., Noda K. Lung cancer risk of the GSTM1 null genotype is enhanced in the presence of the GSTP1 mutated genotype in male Japanese smokers // Cancer Lett. – 1999. – V. 137. – P. 53-60.
167. Kolble K. Regional mapping of short tandem repeats on human chromosome 10: cytochrome P450 gene CYP2E1, D10S196, D10S220, and D10S225 // Genomics. -1993. - V. 18. – P. 702-704.
168. Koppelman G. H., Stine O. C., Xu J. et al. Genome-wide search for atopy susceptibility genes in Dutch families with asthma // J. Allergy Clin. Immunol. - 2002. - V. 109. - P. 498-506.
169. Kruse S., Japha T., Tender M. et al. The polymorphisms S503P and Q576R in the interleukin-4 receptor alpha gene are associated with atopy and influence the signal transduction // Immunology. – 1999. - № 96. – P. 365-371.
170. Kruse S., Mao X. Q., Heinzmann A. at al. The Ile198Thr and Ala379Val variants of plasmatic PAF-acethylhydrolase impair catalytical activities and are associated with atopy and asthma // Am. J. Hum. Genet. – 2000. – V. 66. – P. 1522-1530.
171. Lahiri D.K., Bye S., Nunberg J.I., et al. Anon-organic and non-enzymatic eztraction method gives higher yields of genomic DNA from whole-blood samples than do nine other methods used // J. of Biochemical and Biophysical Methods. – 1992. – V. 25. – P. 193-205.
172. Laing I. A., Goldblatt J., Eber E. et al. A polymorphism of the CC16 gene is associated with an increased risk of asthma // J. Med. Genet. – 1998. – V. 35. – P. 463-467.
173. Laitinen T., Rasanen M., Kaprio J. et al. Importance of Genetic factors in adolescent asthma. A population-based twin-family study // Am. J. Respir. Crit. Care Med. – 1998. – V. 157. – P. 1073-1078.
174. LeSouef P. Genetics of asthma: What do we need to know? // Pediatr. Pulmonol. – 1997. – Suppl. 15. – P. 3-8;
175. Lewis D. F., Lake B. G., Dickins M. Substrates of human cytochromes P450 from families CYP1 and CYP2: analysis of enzyme selectiveity and metabolism. – 2004. – V. 20. - № 3. – P. 111-142.
176. Lichtenstein P., Svartengren M. Genes, environments, and sex: factors of importance in atopic diseases in 7-9-Year-old Swedish twins // Allergy. – 1997. – V. 52. - № 11. – P. 1079-86.
177. Lin D.-X., Tang Y.-M., Peng Q. et al. Susceptibility to esophageal cancer and genetic polymorphisms in glutathione S-transferases T1, P1 and M1 and cytochrome P450 2E1 // Cancer Epidemiol. Biomarkers Prev. – 1998. – V. 7. – P. 1013-1018.
178. Liu X., Nickel R., Beyer K. et al. An IL-13 coding region variant is associated with a high total serum IgE level and atopic dermatitis in the German multicenter atopy study (MAS-90). // J. Allergy Clin. Immunol. – 2000. - № 106. – P. 167-170.
179. Lomas D. A., Silverman E. K. The genetics of chronic obstructive pulmonary disease // Respir. Res. – 2001. – V. 2. - № 1. – P. 20-26.
180. Luszawaka-Kutrzela T. NAT2 genotype in children with bronchial asthma and other atopic diseases // Ann. Acad. Med. Stein. – 1999. – V. 45. – P. 109-21.
181. Mace K., Bowman E.D., Vautravers P. et al. Characterisation of human xenobiotic-metabolizing enzymes expression in human bronchial mucosa and peripheral lung tissues // Europ. J. Cancer. – 1998. – V. 34. – P. 914-920.
182. MacLeod S., Sinha R., Kadlubar F.F. et al. Polymorphisms of CYP1A1 and GSTM1 influence the in vivo function of CYP1A2 // Mutat. Res. – 1997. - V. 376. – P. 135-142.
183. Mao X. Q., Shiracawa T., Yoschikawa K. et al. Association between genetic variants of mast-cell chymase and eczema // Lancet. – 1996. - № 348. – P. 581-583.
184. Matsushita I., Hasegawa K., Nakata K. et al. Genetics Variants of Human b-Defensin-1 and Chronic Obstructive Pulmonary Disease // Biochemical and Biophysical Research Communications. – 2002. – V. 291. – P. 17-22.
185. Melen E., Bruce S., Doekes G. et al. Haplotypes of G-protein-coupled Receptor 154 are Associated with Childhood Allergy and Asthma // Am. J. Respir. Crit. Care Med. – 2005. – V. 121. – P. 1089-1095.
186. Meyer C.G., May J., Stark K. Human Leukocyte antigens in tuberculosis and leprosy // Trends Microbiol. – 1998. - V. 6. - № 4. – P. 148-154.
187. Miller D.P., Liu G., De Vivo I. et al. Combinations of the variant genotypes of GSTP1, GSTM1 and p53 are associated with an increased lung cancer risk // Cancer Research. – 2002. - V. 62. – P. 2819-2823.
188. Mitsuyasu H., Izuhara K., Mao X.Q. et al. Ile50Val variant of IL4R alpha upregulates IgE synthesis and associates with atopic asthma // Nat. Genet. – 1998. - № 19. – P. 119-120.
189. Moffatt M. F., Cookson W. O. Tumor necrosis factor haplotypes and asthma // Human Molecular Genet. – 1997. – V. 6. – P. 551-554.
190. Moffatt M. F., Schou C., Faux J. A. et al. Germline TCR-A restriction of immunoglobulin E responses to allergen // Immunogenetics. – 1997. - № 46. – P. 226-230.
191. Morgenstern R., DePierre J. W. Microsomal glutathione S-transferase // Rev. Biochem. Toxicol. - 1985. – V. 7. – P. 67-103.
192. Morita S., Yano M., Shiozaki et al. CYP1A1, CYP2E1 and GSTM1 polymorphisms are not associated with susceptibility to squamouscell carcinoma of the esophagus // Int. J. Cancer. – 1997. – V. 71. – P. 192-195.
193. Munaka M., Kohshi K., Kawamoto T et al. Genetic polymorphisms of tobacco- and alcohol-related metabolizing enzymes and the risk of hapatocellular carcinoma // Journal of cancer research and clinical oncology. – 2003. - V. 129. – №. 6. - P. 355-360.
194. Mutmansky J.M. The war on black lung // Earth and Miner. Sci. – 1990. – V. 59. – P. 6-10.
195. Nanavaty U., Goldstein A.D., Levine S.J. Polymorphisms in candidate asthma genes // Am. J. Med. Sci. – 2001. – V. 321. – P. 11-16.
196. Nebert D. W., Jorge-Nebert L., Vesell E. S. Pharmacogenomics and “Individualized drug therapy” // Am. J. Pharmacogenomics. – 2003. – V. 3. - № 6. – P. 361-370.
197. Nebert D.W. Polymorphisms in drug-metabolizing enzymes: what is their clinical relevance and why do they exist? // Am. J. Hum. Genet. – 1997. - № 60. – P. 265-271.
198. Nelson D. R., Koymans L., Kamataki T. et al. P450 superfamily: update on new sequences, gene mapping, accession numbers and nomenclature // Pharmacogenetics. – 1996. – V. 6. – P. 1-42.
199. Nickel R. G., Casolaro V., Wahn U. et al. Atopic dermatitis is associated with a functional mutation in the promoter of the C-C chemokine RANTES // J. Immunol. – 2000. - № 164. – P. 1612-1616.
200. Nicolae D., Cox N.J., Lester L. et al. A fine mapping and positional candidate studies identify HLA-G as an asthma susceptibility gene on chromosome 6p21 // Am. J. Hum. Genet. – 2005. – V. 76. - № 2. – P. - 349-57.
201. Nieminen M. M., Kaprio J., Koskenvuo M. A population-based study of bronchial asthma in adult twin pairs // Chest. – 1991. – V. 100. – P. 70-75.
202. Noguchi E., Shibasaki M., Arinami T. et al. Assotiation of asthma and the interleukin-4 promoter gene in Japanese // Clin Exp Allergy. – 1998. – 28. – P. 449-453.
203. North R .J., Medina E. How important is Nramp1 in tuberculosis? // Trends in Microbiology. – 1998. – V. 6. - №11. – P. 441-443.
204. Obase Y., Shimoda T., Kawano T. et al. Polymorphisms in the CYP1A2 gene and theophylline metabolism in patients with asthma // Clin Pharmacol Ther. – 2003. – V. 73. - № 5. – P. 468-474.
205. Ober C., Cox N. J., Abney M. et al. Genome-wide search for asthma susceptibility loci in a founder population. The Collaborative Study on the Genetics of Asthma // Hum. Mol. Genet. – 1998. – V. 7. - P1393-1398.
206. Ober S., Leavitt S. A., Tsaienko A. et al., Variation in the interleukin 4-receptor alpha gene confers susceptibility to asthma and atopy in ethnically diverse populations // Am. J. Hum. Genet. – 2000. - № 66. – P. 517-526.
207. Organov R.G., Maslennikova G. Ya. // Eur. Respir. J. – 1999. – V. 13. - № 2. – P. 287- 289.
208. Paigen K.and Eppig J. T. A mouse phenome project / Mamm. Genome. – 2000. – V. 11. - № 9. – P. 715-717.
209. Park J.Y., Schantz S.P., Stern J.C. et al., Assotiation between glutathione S-transferase pi genetic polymorphism and oral cancer risk // Pharmacogenerics. – 2000. - V. 10. - № 4. – P. 374.
210. Pearce N. What does the odds ratio estimate in a case-control study? // Int. J. Epidemiol. – 1993. – V. 26 № 6. – P. 1189-1192.
211. Pelkonen O., Raunio H. Metabolic activation of toxins: tissue-specific expression and metabolism in target organs // Environ. Health Perspect. – 1997. – V. 105. – Suppl. 4. – P. 767-774.
212. Pemble S., Schroeder K.R., Spencer S.R. et al. Human glutathione S-transferase theta (GSTT1): cDNA cloning and the characterization of a genetic polymorphism // Biochem J. – 1994. – V. 300. – P. 271-276.
213. Pillai S. G, Cousens D. J, Barnes A. A. A coding polymorphism in the CYSLT2 receptor with reduced affinity to LTD4 is associated with asthma // Pharmacogenetics. – 2004. – V. 14. - № 9. – P. - 627-633.
214. Poland A., Glover E., Robinson J. R. et al. Genetic expression of aryl hydrocarbon hydroxylase activity, induction of monooxygenase activities and cytochrome P450 formation by 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin in mice genetically “non-resposive” to others aromatic hydrocarbons // J. Biol. Chem. – 1973. – V. 249. – P. 5599-5606.
215. Prandota J. Important role of prodromal viral infection responsible for inhibition of xenobiotic metabolizing enzymes in the pathomechanism of idiopathic Reye’s syndrome, Stevens-Johanson syndrome, autoimmune hepatits and hepatotoxicity of therapeutic doses of acetaminophen used in genetically predposed persos // Am. J. Ther. – 2002. – V. 9. – P. 149-156.
216. Pykalainen M, Kinos R, Valkonen S. et al. Association analysis of common variants of STAT6, GATA3, and STAT4 to asthma and high serum IgE phenotypes // J. Allergy Clin. Immunol. – 2005. – V. 115. - № 1. – P. - 80-87.
217. Quanjer P.H., Tammeling G.L., Cotes J.E. et al. Lung volumes and ventilatory flows // Eur. Respir. J. – 1993. – V. 6. – P. 4-40.
218. Ramsey C.D., Lazarus R., Camargo C.A. et al. Polymorphisms in the interleukin 17F gene (IL17F) and asthma // Genes Immun. – 2005. – V. 6. - № 3. – P. 236-241.
219. Raunio H., Husgafvel-Pursianen, Anttila S. et al. Diagnosis of polymorphisms in carcinogen-activating and inactivating enzymes and cancer susceptibility – a review // Gene. – 1995. – V. 159. – P. 113-121.
220. Ravindranath V. Metabolism of xenobiotics in the central nervous system: implications and challenges // Biochem. Pharmacol. – 1998. – V. 56. – P. 547-551.
221. Reihsaus E., Innis M., Macintyre N. et al. Mutations in the gene encoding for the beta 2-adrenergic receptor in normal and asthmatic subjects // Am. J. Respir. Cell Mol. Biol. – 1993. – V. 8. – P. 334 -339.
222. Renton K.W. Cytochrome P450 regulation and drug biotransformation during inflammation and infection // Curr Drug Metab. – 2004. - V. 5. № 3. – P. 235-243.
223. Richardson T.H., Jung F., Griffin K.J. et al. A universal approach to the expression of human and rabbit cytochrome P450s of the 2C subfamily in Escherichia coli // Arch. Biochem. Biophys. – 1995. – V. 323. - № 1. – P. 87-96.
224. Richter-Hintz D., Their R., Steinwachs S. et al. Allelic variants of drug metabolizing enzymes as risk factors in psoriasis // Journal of Investigative Dermatology. – 2003. - V. 120. – P. 765-770.
225. Rifkind A. B., Lee C., Chang T. K. and Waxman D. J. Arachidonic acid metabolism by human cytochrome P450s 2C8, 2C9, 2E1, and 1A2: regioselective oxygenation and evidence for a role for CYP2C enzymes in arachidonic acid epoxygenation in human liver microsomes // Arch Biochem Biophys. –1995. – V. 320. - № 3. – P. 380-389.
226. Rollinson S., Levene A. P., Mensah F. K., Roddam P. L. et al. Gastric marginal zone lymphoma is associated with polymorphisms in genes involved in inflammatory response and antioxidative capacity // Blood. – 2003. - V. 102. - № 3. – P. 1007-1011.
227. Romkes M., Faletto M.B., Blaisdell I.A. et al. Cloning and expression of the complementary DNAs for multiple members of the human cytochrome P450IIC subfamily // Biochemistry. – 1991. – V. 30. № 13. – P. 3247-55.
228. Rosenwasser L. J., Klemm D. J., Dresback J. K. et al. Promoter polymorphisms in the chromosome 5 gene cluster in asthma and atopy // Clin. Exp. Allergy. – 1995. - № 25 (suppl 2). – P. 74-78.
229. Roy B., Chowdhury A., Kundu S. et al. Increased risk of antituberculosis drug-induced hepatotoxicity in individuals with glutathione S-transferase M1 “null” mutation // Journal of Gastroenterology and Hepatology. – 2001. – V. 16. – P. 1033-1037.
230. Ryu S., Park Y.-K., Bai G. H. et al. 3’ UTR polymorphisms in the NRAMP1 gene are associated with susceptibility to tuberculosis in Koreans // Int. J. Tuberc. Lung. Dis. – 2000. – V. 4. - № 6. – P. 577-580.
231. Saito K. Shinoharaet A., Kamataki T. et al. N-hydroxylanine O-acetyltransferase in hamster liver: identity with arylhydroxamic acid N,O-acetyltransferase and arylamine N- acetyltransferase // J. Biochem. – 1986. – V. 99. - № 6. – P. 1689-1697.
232. Salama S. A., Sierra-Torres C. H., Oh H-Y. et al. A multiplex-PCR/RFLP procedure for simultaneous CYP2E1, mEH and GSTM1 genotyping // Cancer Lett. – 1999. – V. 143. – P. 51-56.
233. Sandford A. J., Silverman E. K. Chronic obstructive pulmonary disease. 1: Susceptibility factors for COPD the genotype-environment interaction // Thorax. – 2002. – V. 57. - № 8. - P. 736-741.
234. Sandford A.J., Weir T.D., Pare P.D. et al. State of the Art. The genetics of asthma // Am. J. Respir. Crit. Care Med. – 1996. – V. 13. – P. 1749-1765.
235. Schwab M., Schaeffeler E., Klotz U. et al. CYP2C19 polymorphism is a major predictor of treatment failure in white patients by use of lansoprazole-based quadruple therapy for eradication of Helicobacter pylori // Clin Pharmacol Ther. – 2004. – V. 76. – P.201-209.
236. Schwartz D.A., Freedman J.H. and Linney E.A. Environmental genomics; a key to understanding biology, pathophysiology and disease // Hum. Mol. Genet. – 2004. – V. 13. – P. 217-224.
237. Seidegard J., Vorachek W.R., Pero R.W. et al. Hereditary differences in the expression of human glutathione transferase activity on trans-stilbene oxide are due to a gene deletion // Proc. Nat. Acad. Sci. USA. – 1988. – V. 85. – P. 7293-7297.
238. Senak M., Pierzchalska M., Bazan-Socha S. et al. Enhanced expression of the leukotriene C(4) synthase due to overactive transcription of an allelic variant associated with aspirin-intolerant asthma // Am. J. Respir. Cell Mol. Biol. – 2000. - № 23. – P. 290-296.
239. Sengler C. Lau S., Wan U. et al. Interactions between genes and environmental factors in asthma and atopy: new developments // Respir. Res. – 2002. – V. 3. № 7. – P. 7.
240. Shields P.G., Caporaso N.E., Falk R.T. et al. Lung cancer, race and CYP1A1 genetic polymorphism // Cancer Epidemiol. Biomarkers and Prev. – 1993. - № 2 – P. 481-485.
241. Shirakawa T., Enomoto T., Shimazu S. et al. The inverse assotiation between tuberculin responses and atopic disorder // Science. – 1997. – V. 275. – P. 77-79.
242. Shirakawa T., Li A., Dubowitz M. Association between atopy and variants of the beta subunit of the high-affinity immunoglobulin E receptor // Nat. Genet. – 1994. - № 7. – P. 125-129.
243. Shirakawa T., Mao X.Q., Sasaki S. et al. Association between atopic asthma and a coding variant of Fc epsilon RI beta in a Japanese population [letter] // Hum. Molecular Genet. – 1996. - № 5. – P. 2068.
244. Sipes I.G., Gandolfi A.J. Biotransformation of toxicants // Casarett and Doull’s toxicology. – N. Y.: Macmillan Publishing Company. -1986. – P. 99-173.
245. Skadhauge L. R., Christens K., Kyvik K. O. et al. Genetic and environmental influence on asthma: a population-based study of 11,688 Danish twin pairs // Eur. Respir. J. – 1999. – V. 13. – P. 8-14.
246. Sodhi C.P., Rana S.V., Mehta S. Study of oxidative stress in rifampicin induced hepatic injury in growing rats with and without protein energy malnutrition // Hum. Exp. Toxicol. – 1997. - № 20. – P. 315-321.
247. Sodhi C.P., Rana S.V., Mehta S.K. et al. Study of oxidative stress in izoniazid induced hepatic injury in young rats with and without protein energy malnutrition // J. Biochem. Toxicol. – 1996. - № 11. – P. 139-146.
248. Spielman R.S., McGunis R.E., Ewens W.J. Transmission test for linkage disequilibrium: The insulin gene region and insulin-dependent diabetes-mellitus (IDDM) // Am. J. Hum. Genet. – 1993. – V. 52. – P. 506-516.
249. Spitx M.R., Duphrone C.M., Detry M.A. et al. Dietary intake of isothiocyanates: evidence of a joint effect with glutathione S-transferase polymorphisms in lung cancer risk // Cancer Epidemiology, Biomarkers & Prevention. – 2000. - V. 9. – P. 1017-1020.
250. Spurdle A.B., Chen X., Abbazadegan M. et al. CYP17 promoter polymorphism and ovarian cancer risk // Int. J. Cancer. – 2000. - V. 86. – P. 436-439.
251. Stead W.W. Genetics and resistance to tuberculosis: could resistance be enhanced by genetics engineering? // Ann. Int. Med. – 1992. – V. 116. – P. 937-941.
252. Steele M.A., Burk R.F., Desprez R.M. et al. Toxic hepatitis with isoniazid and rifampicin – a meta analysis // Chest. – 1991. - № 99. – P. 465-471.
253. Sterk P.J., Fabbri L.M., Quanjer P.H. et al. Airway responsiveness // Eur. Respir. J. – 1993. – V. 6. Suppl. – P. 55-64.
254. Strachan D.P. Hayfever, hygiene, and household size // Biol.Med.J. – 1989. - V. 299. - P. 1259-1260.
255. Sugimura H., Suzuki I., Hamada G.S. et al. Cytochrome P450 IAI genotype in lung cancer patients and controls in Rio de Janeiro, Brazil // Cancer Epidemiol. Biomarkers and Prev. – 1994. - № 3. – P. 145-148.
256. Summerhill E., Levitt S. A., Gidley H. et al. Beta(2)-adrenergic receptor Arg16/Arg16 genotype is associated with reduced lung function, but not with asthma, in the Hutterites // Am. J. Respir. Crit Care Med. – 2000. – V. 162. – P. 599-602.
257. Surry D.D., Neneses-Lorente G., Heavens R. et al. Rapid determination of rat hepatocyte mRNA induction potential using oligonucleotide probes for CYP1A1, 1A2, 3A, and 4A1 // Xenobiotica. - 2000. – V. 30. - № 5. – P. 441-456.
258. Tamer L., Calikoglu M., Ates N. A. et al. Glutathione S-transferase gene polymorphisms (GSTT1, GSTM1, GSTP1) as increased risk factors for asthma // Respirology. – 2004. – V. 9. - № 4. – P. 493-498.
259. Tanaka K., Sugiura H., Uehara M. et al. Association between mast cell chymase genotype and atopic eczema: alone and those with atopic eczema and atopic respiratory disease // Clin. Exp. Allergy. – 1999. – V. 29. – P. 800-803.
260. The Collaborative Study in the Genetics of Asthma. A genome-wide search for allergic response (atopy) genes in three ethnic groups // Hum. Genet. – 2004. - V. 114. - P. 157-164.
261. The Collaborative Study on the Genetics of Asthma. A genome-wide search for asthma susceptibility loci in ethnically diverse populations. // Nat. Genet. – 1997. – V. 15. – P. 389-392.
262. Thomas N.S., Wilkinson J., Holgate S.T. The candidate region approach to the genetics of asthma and allergy. // Am. J. Respir. Crit Care Med. – 1997. – V. 156. – P. 144-151
263. To-Figueras J., Gene M., Gomez-Catalan J. Glutathione-S-transferase M1 and codon 72 p53 polymorphisms in a northwestern Mediterranean population and their relation to lang cancer susceptibility // Cancer Epidemiol. Biomark. Prev. – 1996. - V. 5. – P. 337-342.
264. Urs A. Molecular mechanisms of genetic polymorphisms of drug metabolism // Annu. Rev. Pharmacol. Toxicol. – 1997. – V. 37. – P. 169-196.
265. Van der Pouw Kraan T.C., Van Veen A., Boeije L.C. et al. An IL13 promoter polymorphism associated with increased risk of allergic asthma // Gene Immun. – 1999. - № 1. – P. 61-65.
266. Von Hertzen L., Klaukka T., Mattila H. et al. Mycobacterium tuberculosis infection and the subsequent development of asthma and allergic conditions // J. Allergy Clin. Immunol. – 1999. – V. 104. - № 6. – P. 1211-1214.
267. Von Mutius E., Martinez F. D., Fritzsch C. et al. Prevalence of asthma and atopy in two areas of West and East Germany // Am. J. Respir. Crit. Care Med. – 1994. – V. 149. - № 2. – P. 358-364.
268. Watanabe J., Hayashi S., Kawajiri K. Different regulation and expression of the human CYP2E1 gene due to the RsaI polymorphism in the 5’-flanking region // J. Biochem. – 1994. – V. 116. – P. 321-326.
269. Watson M. A., Stewart R. K., Smith G. B. J. et al. Human glutathione S-transferase P1 polymorphism: relationship to lung tissue enzyme activity and population freguency distribution // Carcinogenesis. – 1998. – V. 19. – P. 275-280.
270. Waxman D.J. and Azaroff L. Phenobarbital induction of cytochrome P-450 gene expression. Biochem .J. – 1992. - V. 281. – P. 577-592.
271. Wen X., Wang J.S., Neuvonen J. et al. Isoniazid is a mechanism-based inhibitor of cytochrome P450 1A2, 2A6, 2C19 and 3A4 isoforms in human liver microsomes // Eur. J. Clin. Pharmacol. – 2002. – V. 57. № 11. – Р. 799 – 804.
272. Wheeler C., Guenthner T.M. Cytochrome P450-dependet metabolism of xenobiotic in human lung // J. Biochem. Toxicol. – 1991. – V. 6. – P. 163-169.
273. Whitlock J.P., Gelboin H.V. Aryl hydrocarbon (benzo[α]pyrene hydroxilase in rat liver cells in culture // J. Biol. Chem. - 1974. – V. 249. – P. 2616-2623.
274. Wilson M. H., Grant P.J., Hardine L.J. et al. Glutathione S-transferase M1 null genotype is associated with a decreased risk of myocardial infarction // The FASEB Journal. – 2000. - Vol. 14. – P. 791-796.
275. Wjst M., Fischer G., Immervoll T. et al. A genome-wide search for linkage to asthma. German Asthma Genetics Group // Genomics. – 1999. – V. 58. – P. 1-8.
276. Wright D.T., Cohn L.A., Li H. et al. Interactions of oxygen radicals with airway epithelium // Environ. Health Perspect. – 1994. – V. 102 (Suppl.10). – P. 85-90.
277. Xie H. G., Kim R. B., Stein C. M. et al. Genetic polymorphism of (S)-mephenytoin 4’-hydroxylation in populations of African descent // Br. J. Clin. Pharmacol. - 1999. – V. 48. - № 3. – P. 402-406.
278. Xu X., Kelsey K.T., Wiencke J.K. et al. Cytochrome P450 CYP1A1 MspI polymorphism and lung cancer susceptibility // Cancer Epidemiology, Biomarkers & Prevention. – 1996. - V. 5. – P. 687-692.
279. Yan L., Galinsky R. E., Bemstein J. A. et al. Histamine N-methyltransferase pharmacogenetics: assotiation of a common functional polymorphism with asthma // Pharmacogenetics. – 2000. - № 10. – P. 261-266.
280. Yang Y. S., Wong L. P., Lee T. C. et al. Genetic polymorphism of cytochrome P450 2C19 in healthy Malaysian subjects // Br. J. Clin. Pharmacol. – 2004. – V. 58. - № 3. – P. 332-335.
281. Yokouchi Y., Nukaga Y., Shibasaki M. et al. Significant evidence for linkage of mite-sensetive childhood asthma to chromosome 5q31-q33 near the interleukin 12 B locus by a genome-wide search in Japanese families // Genomics. – 2000. – V. 66. – P. 152-160.
282. Zhang YQ, Sun BY, Dai J.J. Studies on the genetic diathesis of asthma bronchial // Yi Chuan. – 2004. - № 26. – V. 2. – P. 147-150.
283. Zhou W., Liu G., Thurston S.W. et al. Genetic polymorphisms in N-acetyltransferase-2 and microsomal epoxide hydrolase, cumulative cigarette smoking, and lung cancer // Cancer Epidemiology, Biomarkers & Prevention. – 2002. - V. 11. – P. 15-21.
БЛАГОДАРНОСТИ
Автор считает приятным долгом выразить огромную признательность своему руководителю – академику РАМН, профессору Пузыреву Валерию Павловичу за поддержку, чуткое отношение и неоценимую помощь в планировании, выполнении и обсуждении работы. Выражаю искреннюю благодарность сотрудникам лаборатории популяционной генетики ГУ НИИ МГ ТНЦ СО РАМН за предоставление материала и сопутствующей информации, а также за помощь в обсуждении полученных результатов.
Отдельную благодарность за предоставление клинического материала сотрудникам кафедры фтизиатрии Сибирского государственного медицинского университета (заведующий – член-корр. РАМН, профессор Стрелис А.К.) и сотрудникам кафедры факультетской педиатрии с курсом детских болезней лечебного факультета (заведующий – д.м.н., профессор Огородова Л.М.) Сибирского государственного медицинского университета, а также областного детского центра клинической иммунологии и аллергологии (Областная детская больница, г. Томск, главный врач – Сальников В.А.).
Дата: 2019-07-24, просмотров: 307.