Воздух и его свойства
Состав воздуха
Давление воздуха
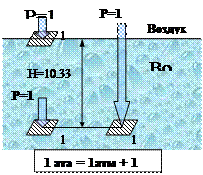
Масса воздуха, составляющая атмосферу Земли, оказывает своим весом на ее поверхность определенное давление, которое называется атмосферным. Измеренное на уровне моря при температуре 0°С атмосферное давление уравновешивается в трубке сечением 1 см2 барометра столбом ртути высотой 760 мм или столбом воды высотой 10,33 м, что соответствует давлению на 1 см2 поверхности с силой 1,033 кгс (или 10,1325Н). Эта величина носит название физической атмосферы (атм).
1 атм = 760 мм рт.ст. = 10,33 м вод.ст. = 1,033 кгс/см2 = 101325 Н/м2
Атмосферное давление (барометрическое), равное 1 атм, называется нормальным.
В технике для удобства расчетов за единицу давления принимается техническая атмосфера (ат), что соответствует давлению на 1 см2 поверхности силы в 1 кгс, или 1 Н на 1 м2 (в системе СИ):
1 ат = 1 кгс/см2 = 10 s Н/м2 = 10 м вод.ст.,
 т.е. одна техническая атмосфера соответствует давлению 10 м водяного столба (в честь французского ученого 17 века Б.Паскаля единица давления 1 Н/м2 называется паскалем - обозначается Па).
т.е. одна техническая атмосфера соответствует давлению 10 м водяного столба (в честь французского ученого 17 века Б.Паскаля единица давления 1 Н/м2 называется паскалем - обозначается Па).
Давление сверх атмосферного называется избыточным давлением. Избыточное давление измеряется манометрами, и поэтому часто оно называется манометрическим давлением.Сумма избыточного и атмосферного давлений называется абсолютным давлением.
| Рабс = Ризб + Ратм где: |
| (1) |
|
Рабс - абсолютное давление (измеряется в технических атмосферах и обозначается ата - атмосфера техническая абсолютная).Для упрощенных расчетов атмосферное давление рассчитается постоянным и равным 1 атм, тогда
Рабс = Ризб+1атм (2)
Таким образом, на каждые 10 метров глубины погружения избыточное давление увеличивается на 1 атм (1кгс/см2).
Состояние любого газа или газовой смеси определяется четырьмя основными параметрами, объемом V, давлением р, температурой Т, массой М, которые находятся во взаимозависимости, определяемой рассмотренными ниже газовыми законами.
Законы газовой динамики
Закон Бойля-Мариотта. (Изотермический процесс). Для данной массы газа М при постоянной температуре Т его объем обратно пропорционален давлению р:
pV = const (3)
Иными словами, справедливы равенства
p1 V1= p2 V2 или
p1/ p2= V2/ V1 (4) 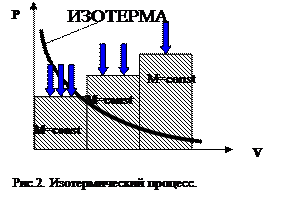
где:
р1,р2. - соответственно начальное и конечное давление газа;
V1, V2- - соответственно начальный и конечный объем газа.
Проще говоря, во сколько раз увеличивается давление, во столько раз уменьшается объём. Пользуясь этим законом, можно понять, почему с ростом глубины погружения возрастает расход воздуха для дыхания подводного пловца, а также рассчитать время пребывания под водой.
Закон Шарля (Изохорный процесс). Для данной массы газа М при постоянном объёме V обеление р прямо пропорционально изменению абсолютной температуры Т:
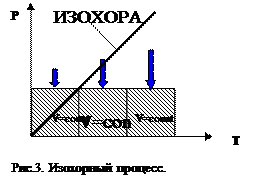 pt = p0 apT (5)
pt = p0 apT (5)
где:
pt - давление газа при абсолютной температуре Т;
р0 - давление газа при температуре 0°С;
ap - температурный коэффициент давления газов, равный 1/273 К-1;
Т - абсолютная температура газа, К (по шкале Кельвина).
Закон Гей-Люссака (Изобарный процесс). Для данной массы газа М при постоянном давлении р объем газа V прямо пропорционален изменению его абсолютной температуры Т:
VT= V0 aVT (6)
где:
VT - объем газа при абсолютной температуре Т;
V0 - объем газа при температуре 0 0С;
Т - абсолютная температура газа, К;
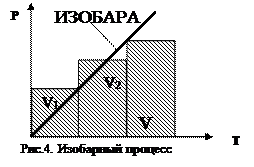 aV - температурный коэффициент объемного расширения газов, равный 1/273 К-1.
aV - температурный коэффициент объемного расширения газов, равный 1/273 К-1.
Часто для решения практических задач удобнее зависимости (5) и (6) выражать в виде:
p1/р2 = Т1/T2 (7)
V1/V2= Т1/T2 (8)
где:
p1 И р2 - начальное и конечное давление газов при постоянном объеме;
V1 и V2 - начальный и конечный объем газов при постоянном давлении;
Т1 и T2 - начальная и конечная абсолютные температуры газов. Абсолютная температура Т по шкале Кельвина (К) и температура t по шкале Цельсия (°С) связаны между собой соотношением:
Т = t + 273 (9)
Приведенные зависимости, выражающие законы Шарля и Гей-Люссака, позволяют решать важные практические задачи при подготовке и планировании подводных погружений, такие, например, как определение давления воздуха в баллонах при изменении температуры, соответствующие ему изменение запасов воздуха и времени пребывания на данной глубине и т. п.
Закон Дальтона. Давление смеси газов равно сумме парциальных (частичных) давлений отдельных газов, составляющих смесь, т.е. тех давлений, которые производил бы каждый газ в отдельности, если бы он был взят при той же температуре в объеме смеси.
Парциальное давление газа рг, пропорционально процентному содержанию n данного газа и величине абсолютного давления рабс газовой смеси и определяется по формуле:
рг = рабс n/100 (10)
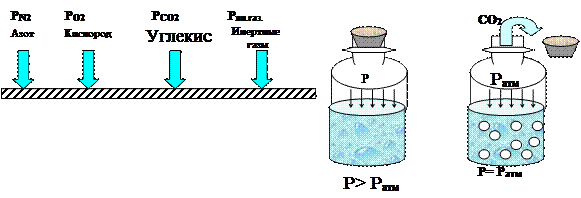 |
Рис. 5 Парциальное давление газов. Рис б. Иллюстрация закона Генри
Проиллюстрировать данный закон можно, сравнив смесь газов в замкнутом объеме с набором гирь различного веса, положенных на весы. Очевидно, что каждая из гирь будет оказывать давление на чашу весов независимо от наличия на ней других гирь.
Закон Генри. Количество газа, растворенного в жидкости, прямо пропорционально его парциальному давлению.
Поскольку парциальное давление отражает фактическое количество газа, поступающего в организм, знание парциальных давлений газов в смеси позволяет правильно оценить действие этих газов, сильно изменяющееся в зависимости от величины абсолютного давления рабс.
Дата: 2019-07-24, просмотров: 366.