Хотя субстраты для синтеза эйкозаноидов имеют довольно простую структуру (полистовые жирные кислоты), из них образуется большая и разнообразная группа веществ. Наиболее распространены в организме человека простагландины, которые впервые были выделены из предстательной железы, откуда и получили свое название. Позже было показано, что и другие ткани организма синтезируют простагландины и другие эйкозаноиды.
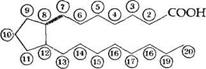
Простагландины PG можно рассматривать как производные гипотетической С2о-кислоты, получившей тривиальное название простаноевой:
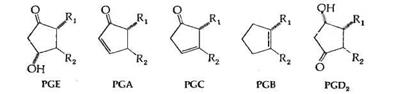
Простагландины обозначают символами, например PG А, где PG обозначает слово "простагландин", а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида.
Обнаружено шесть первичных природных простагландинов, три из них серии Е (PGE1, PGE2, PGE3) и три - серии F (PGF1a, PGF2a, PGF3a). Простагландины серии Е содержат в положении 9 кетогруппу, а простагландины серии F - гидроксигруппу. (Рис.2)
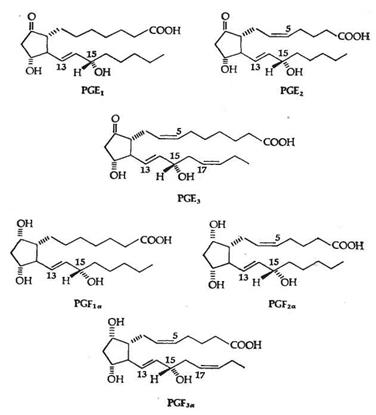
Рис.2 Шесть главных природных простагландинов
В дополнение к вышеприведенным шести первичным простагландинам имеются несколько вторичных простагландинов, большинство из которых являются продуктами ферментативного или химического превращения PGE. Характерным свойством простагландинов серии Е является их способность к дегидратации в PGA в кислой среде; образовавшиеся PGA затем в присутствии оснований изомеризуются в PGB, имеющие максимум поглощения при длине волны 237 нм. Эта последовательность реакций превращения PGE в PGB часто используется для идентификации PGE.
Простагландины серии F не претерпевают подобного превращения в кислой среде.
В зависимости от исходной жирной кислоты все эйкозаноиды делят на три группы:
1) Первая группа образуется из эйкозотриеновой кислоты. Хотя в пищевых продуктах этой кислоты нет, она способна образовываться в клетках при удлинении линолевой кислоты (С18: 3), которой много в растительных маслах. Для этой группы в соответствии с числом двойных связей простагландинам и тромбоксанам присваивается индекс 1: например, PgE1, PgI1
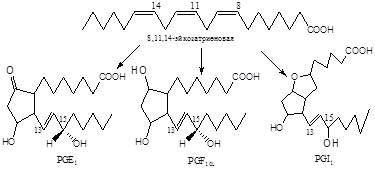
Вторая группа синтезируется из арахидоновой кислоты (С20: 4), по тому же правилу эйкозаноидам этой группы присваивается индекс 2. PgE2, PgI2.

Третья группа эйкозаноидов происходит из тимнодоновой кислоты (С20: 5). Эйкозаноидам этой группы присваивается индекс 3. Например, PgE3, PgI3
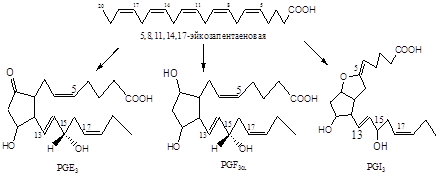
PG I - простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое - с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (PG I2, PG I3).
Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба.
Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода. Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях и отличающиеся по активности. ТХ В2 - продукт катаболизма ТХ А2 и активностью не обладает.
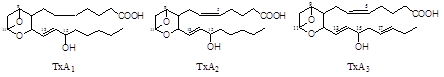
Рис.3. Структура тромбоксанов.
Биосинтез
После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и липоксигеназный, заканчивающийся образованием лейкотриенов. (Рис.4)
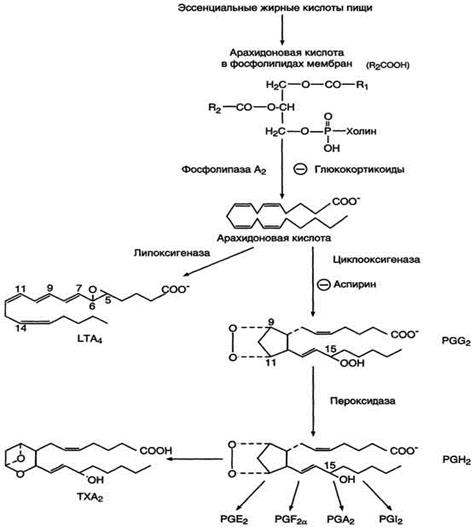
Рис.4 Синтез эйкозаноидов из арахидоновои кислоты.
Циклооксигеназный путь: синтез простагландинов и тромбоксанов
С20-три-, тетра - и пентаеновая жирные кислоты, служащие предшественниками простагландинов, входят в состав внутриклеточных фосфоглицеридов, из которых они высвобождаются под действием фосфолипазы А2. Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: гормонов, гистамина, цитокинов, механического воздействия. Этот процесс высвобождения предшественника, вероятно, играет роль регулирующей стадии в биосинтезе простагландинов, с помощью которой варьирует количество субстрата, подвергающегося последующему действию простагландинсинтазы. Последняя представляет собой связанный в мембране мультиферментный комплекс, содержащийся в микросомальной фракции тканевых гомогенатов. Необходимо отметить, что ингибиторное действие кортикостероидов на биосинтез простагландинов, связанное с торможением активности фосфолипазы А2, может служить объяснением антивоспалительного действия этих стероидных гормонов.
Фермент, катализирующий первый этап синтеза простагландинов, называется PG Н2 синтазой и имеет 2 каталитических центра. Один из них называют циклооксигеназой, другой - пероксидазой. Этот фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. Фермент имеет гидрофобный домен, погружённый в липидный слой мембран ЭР, и каталитический домен, обращённый в полость ЭР. В активном центре циклооксигеназы находится тирозин (385), в активном центре пероксидазы - простетическая группа - гем. В организме имеются 2 типа циклооксигеназ (PGН2 синтаз). Циклооксигеназа 1 - конститутивный фермент, синтезирующийся с постоянной скоростью. Синтез циклооксигеназы 2 увеличивается при воспалении и индуцируется соответствующими медиаторами - цитокинами. Оба типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое PG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием PG Н2. До образования PG Н2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения PG Н2 специфичны для каждого типа клеток.
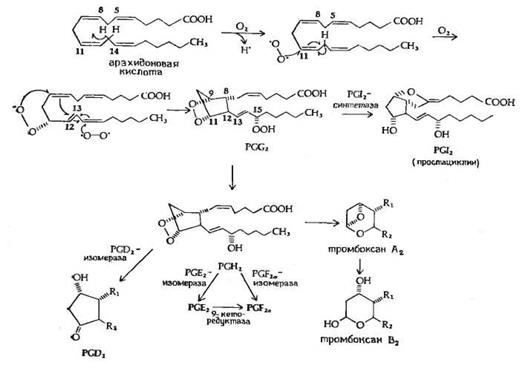
Рис.5. Предполагаемый механизм биосинтеза PGE2 и PGF2a из арахидоновой кислоты.
Биосинтез PGE2 и PGF2a, представленный на рис.5, начинается с арахидоновой кислоты и катализируется циклооксигеназой (М 70 000) жирных кислот, при этом образуется 15-оксиперокси-9-11-эндопероксид PGG2. Первая стадия в этой последовательности реакций приводит к потере атома водорода у С-13 с образованием свободного радикала. Эта стадия лимитирует скорость всего процесса. Затем происходят присоединение пероксидного радикала в положения 9 и 11 и образование 8,12 углерод-углеродной связи, которому предшествует изомеризация 11,12-двойной связи в 12,13-двойную связь и присоединение другого пероксидного радикала в положение 15, приводящее к изомеризации 12,13-двойной связи в 13,14-двойную связь. Все эти превращения рассматриваются как процесс одноэлектронного переноса, обозначенный на рисунке изогнутыми стрелками. Первый продукт этой последовательности реакций - это 15-оксиперокси-9,11-эндопероксид PGG2, существование которого было постулировано за несколько лет до его выделения и идентификации. PGG2 затем превращается в PGI2 или PGH2, вероятно, с помощью реакции пероксидазного типа. PGH2 является предшественником PGE2 и PGF2a в семенных пузырьках и других органах, а также тромбоксана А2 в тромбоцитах и легких.
Превращение арахидоновой кислоты в PGG2 блокируется ингибиторами циклооксигеназы жирных кислот. Наиболее известным среди этих ингибиторов являются аспирин (ацетилсалициловая кислота) и ряд других противовоспалительных лекарств (Рис.6). Торможение аспирином обусловлено переносом ацетильного остатка от молекулы аспирина к активному центру фермента с инактивацией последнего; такого рода механизм был предложен в качестве объяснения некоторых известных фармакологических эффектов аспирина.
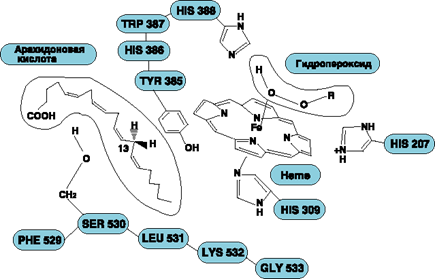
Рис.6. Молекулярный механизм ингибирования циклооксигеназы ацетилсалициловой кислотой.
Аспирин - препарат, подавляющий основные признаки воспаления. Механизм противовоспалительного действия аспирина стал понятен, когда обнаружили, что он ингибирует циклооксигеназу. Следовательно, он уменьшает синтез медиаторов воспаления и, таким образом, уменьшает воспалительную реакцию. Циклооксигеназа необратимо ингибируется путём ацетилирования серина в положении 530 в активном центре (Рис.6). Однако эффект действия аспирина не очень продолжителен, так как экспрессия гена этого фермента не нарушается и продуцируются новые молекулы фермента. Другие нестероидные противовоспалительные препараты (например, ибупрофен и ацетаминофен) действуют по конкурентному механизму, связываясь в активном центре фермента, и также снижают синтез простагландинов.
Стероидные препараты обладают гораздо более сильным противовоспалительным действием, чем препараты нестероидного ряда. Механизм их действия заключается в индукции синтеза белков - липокортинов (или макрокортинов), которые ингибируют активность фосфолипазы А2 и уменьшают синтез всех типов эйкозаноидов, так
как препятствуют освобождению субстрата для синтеза эйкозаноидов - арахидоновой кислоты (или её аналога).
Использование стероидных противовоспалительных препаратов особенно важно для больных, страдающих бронхиальной астмой. Развитие симптомов этого заболевания (бронхоспазм и экссудация слизи в просвет бронхов) обусловлено, в частности, избыточной продукцией лейкотриенов тучными клетками, лейкоцитами и клетками эпителия бронхов. Приём аспирина у больных, имеющих изоформу липоксигеназы с высокой активностью, может вызвать приступ бронхиальной астмы. Причина "аспириновой" бронхиальной астмы заключается в том, что аспирин и другие нестероидные противовоспалительные препараты ингибируют только циклооксигеназный путь превращений арахидоновой кислоты и, таким образом, увеличивают доступность субстрата для действия липоксигеназы и, соответственно, синтеза лейкотриенов. Стероидные препараты ингибируют использование арахидоновой кислоты и по липоксигеназному и по циклооксигеназному пути, поэтому они не могут вызывать бронхоспазма.
Структура и синтез лейкотриенов
Наличие 3 сопряжённых двойных связей обусловливает название "лейкотриен". Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше (рис.7). Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицилцистеина или цистеина, соответственно.
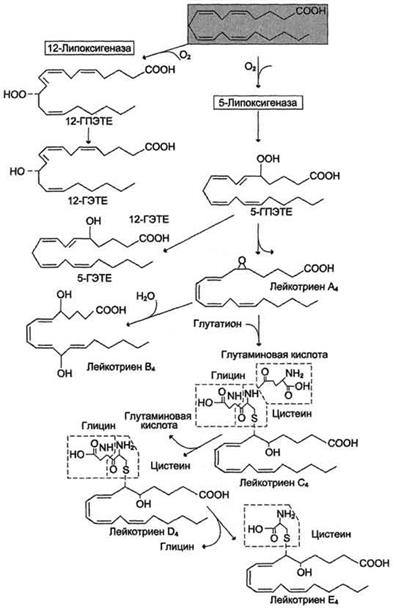
Рис.7. Липоксигеназный путь синтеза эикозаноидов.
Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов - гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены. ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например: 5-ГЭТЕ, 12-ГЭТЕ.
Липоксигеназы действуют в 5-й, 12-й или 15-й позиции арахидоновой кислоты в зависимости от типа ткани. Например, в тромбоцитах - 12-липоксигеназа, в эозинофилах - 15-липоксигеназа.
Глюкокортикоиды ингибируют синтез всех типов эйкозаноидов, так как ингибируют фосфолипазу А2, и таким образом уменьшают количество субстрата для их синтеза. Аспирин и другие противовоспалительные препараты нестероидного действия ингибируют только циклооксигеназный путь.
Другие типы лейкотриенов образуются из LTА4, LTВ4 образуется под действием эпоксидгидролазы в лейкоцитах и клетках эпителия сосудов. Другой путь приводит к образованию группы лейкотриенов: LTC4, LTD4, LTE4. Их синтез начинается с присоединения трипептида глутатиона к 6-му атому углерода с образованием LTС4 в реакции, катализируемой глутатион-8-трансферазой. В следующей реакции удаляется глутамат, и LTD4 содержит дипептид глицилцистеин. На последней стадии отщепляется глицин, и LTЕ4 содержит только цистеин.
Дата: 2019-05-29, просмотров: 316.