Оценка качества лекарственных средств
Качество ЛС оценивается в соответствии с Инструкцией по оценке качества лекарственных средств, изготовляемых в аптеках (приказ Минздрава России от 16.10.97 № 305 «О нормах отклонений, допустимых при изготовлении лекарственных средств и фасовке промышленной продукции в аптеках»). Данный приказ распространяется на все аптеки, аптечные пункты (с правом изготовления ЛС) и территориальные контрольно-аналитические лаборатории, осуществляющие контроль качества ЛС, изготовляемых в аптеках.
Качество ЛС (в том числе гомеопатических), изготовляемых в аптеках, устанавливается по комплексу показателей. Уровень качества ЛС оценивается в соответствии с требованиями, регламентированными действующими ГФ, приказами и инструкциями Минздрава России.
Для оценки качества применяются термины «Удовлетворяет» («Годная продукция») и «Не удовлетворяет» («Брак»). Уровень качества изготовленных ЛС определяется органолептическим и измерительными методами.
Неудовлетворительность изготовленных ЛС устанавливается по следующим показателям:
· несоответствие по описанию (внешний вид, цвет, запах);
· несоответствие по прозрачности или цветности;
· несоответствие по распадаемости;
· неоднородность по измельченности или смешиванию порошков, мазей, суппозиториев, гомеопатических тритураций;
· наличие видимых механических включений;
· несоответствие прописи по подлинности;
· ошибочная замена одного Л В другим, отсутствие прописанного или наличие непрописанного вещества;
· замена ЛС на аналогичные по фармакологическому действию без обозначения этой замены на требовании, рецепте (копии рецепта, этикетке);
· отклонения от прописи по массе или объему;
· отклонения по обшей массе (объему);
· отклонения по массе отдельных доз и их количеству;
· отклонения по массе навески (или по концентрации) отдельных Л В;
· несоответствие по величине рН;
· несоответствие по величине плотности;
· несоответствие по стерильности;
· несоответствие по микробиологической чистоте;
· нарушение фиксированности укупорки (для стерильных ЛФ);
· нарушение правил оформления ЛС, предназначенных к отпуску.
Изменения в составе ЛФ (если необходимо) должны производиться только с согласия врача и должны отмечаться на требовании, рецепте (копии рецепта, этикетке). При отсутствии указанной отметки на требовании, рецепте (копии рецепта, этикетке), качество изготовления ЛФ оценивается «Неудовлетворительно».
Изменения в количестве отпущенного ЛС или отпуск таблеток вместо порошков должны также отмечаться на требовании, рецепте и пр.
При определении отклонений в проверяемых ЛФ следует использовать измерительные средства того же типа (с одинаковыми метрологическими характеристиками), что и при их изготовлении в аптеках.
Установлены нормы отклонений, допустимые при изготовлении ЛФ (в том числе гомеопатических) в аптеках (приказ Минздрава России от 16.10.97 № 305).
При определении допустимых отклонений в проверяемых ЛС, изготовленных в виде серий внутриаптечных заготовок, следует пользоваться вышеуказанными нормами отклонений, а так же действующей нормативной документацией, регламентирующей изготовление и контроль качества различных лекарственных форм в аптеках.
Производство
Производство до сих пор остается "черным ящиком" для многих финансовых риэлтеров. Однако некоторые компании не боятся становиться стратегическими инвесторами, поскольку уверены, что знают секрет создания успешного российского фармацевтического производства. А.А.Парканский, генеральный директор компании "Верофарм", считает, что успешное развитие российских дженериковых компаний возможно через слияние. В Европе подобные компании тоже укрупняются, иначе, по словам Парканского, "можно остаться за бортом". Кроме того, необходимо создание сильных индивидуальных брэндов. Компании должны создавать технологические барьеры, делать то, что не могут сделать другие, тогда они смогут работать на "более или менее огороженных территориях".
В.С.Якунин считает, что "начинать следует с улучшения имиджа всего производственного сектора, а затем создать для него ряд привилегий. Тогда и западные, и отечественные производители, а также инвесторы будут заинтересованы в том, чтобы стимулировать и развивать фармацевтическое производство в стране. Будут совершенствоваться уже имеющиеся мощности, будут строиться новые заводы при помощи западных партнеров. Но производство уже будет сосредоточено внутри страны".
Глава российского представительства АО "Фармацевтический завод ЭГИС" Ласло Почайи полагает, что на рынке выиграют те компании, которые сильны своей маркетинговой политикой. Кроме того, исключительно важным моментом, по его мнению, является единая координированная работа всех звеньев рынка, так как любое "выпавшее" звено может разрушить крупные инвестиции.
Дистрибьюция
Дистрибьюторы в сложившейся сегодня ситуации "тянут на себе лямку обеспечения рынка". Какие бы производства ни создавались, все замыкается на дистрибьюторах. Им приходится преодолевать уже существующие преграды и бороться с новыми. Генеральный директор компании "Роста" О.Ю.Конев считает, что привлечь стратегического инвестора в дистрибьюторский сектор можно через объединение дистрибьюторских компаний.
Объединение позволит работать более эффективно, снижая цены, а ассортимент продуктовых портфелей компаний будет расширяться от 3 до 6 тыс. в каждом регионе.
Таким образом, в ближайшее время на рынке останутся 5-6 крупных дистрибьюторов.
В.С.Якунин называет задачей-минимум увеличение объемов рынка на 10-15% в год после того, как повысятся уровень жизни населения и потребительский спрос. А чтобы выйти на уровень цивилизованной страны, нужно, чтобы рынок возрастал на 40-50% в год. По мнению В.С.Якунина, это реально при выполнении определенных задач, способных дать толчок к развитию: "Первое - необходимо срочно создавать и развивать частную страховую медицину.
У нас практически не работает частный больничный сектор. А государственные клиники не заинтересованы в развитии фармрынка и качественном лекарственном обеспечении. Частная медицина может дать толчок к увеличению потребления лекарственных препаратов, дорогостоящих и качественных. У нас сейчас около 30 млн. граждан, которые пользуются мобильной связью и тратят на нее больше 100 долларов в год. Абсурд, когда люди на телефон тратят больше чем на свое здоровье.
Второе - повышение доверия к здравоохранению, и на себя это должно взять государство. Срочно должна быть принята государственная программа по повышению доверия населения к здравоохранению.
Третье - пропаганда и профилактика здорового образа жизни".
Кроме того, В.С.Якунин отмечает, что необходимо стимулировать развитие экспорта лекарственных средств.
В качестве экспортеров должны выступить страны СНГ. По его мнению, для стимулирования экспорта также необходимо принять государственную программу.
Розница
Директор аптеки "Фарма" считает, что сегодняшний покупатель лекарств беден и из ряда современных препаратов всегда выбирает тот, что дешевле. И как бы ни говорили об увеличении покупательской способности, количество покупок в аптеке не увеличивается - просто растут цены на лекарственные средства и медицинские изделия.
Тем не менее, М.А.Массалютина убеждена, что производители лекарственных средств могут конкурировать с производителями БАД, так как товарооборот аптеки на 98% состоит из лекарств, и лишь на 2% - из парафармацевтики и БАД.
Как же современной аптеке удержать товарооборот? По мнению М.А.Массалютиной - за счет расширения набора услуг в аптечном учреждении.
Например, если помимо привычной покупки лекарств и получения консультационных услуг, человек, придя в аптеку, сможет измерить артериальное давление, определить уровень сахара в крови, он поймет, что аптека старается сделать все, чтобы соответствовать его потребностям, и станет ее постоянным посетителем.
Такие услуги недостаточно распространены в аптеках, но, тем не менее, востребованы. Создать круг постоянных клиентов помогает и доставка медикаментов на дом, а также системы дисконтирования и т.д.
Что сегодня хотят аптеки от медицинского представителя? Неформального подхода к своим обязанностям. "За этот год у массы препаратов закончились сроки регистрации, некоторые лекарственные средства поменяли внешний вид и упаковку, произошли какие-то изменения в инструкциях.
Ни один медицинский представитель, придя в аптеку, не довел эту информацию до ее сотрудников", - говорит директор аптеки "Фарма". - Я считаю, что представители компаний-производителей должны доводить до сведения розничного звена эту информацию. А мы не должны оправдываться перед покупателем".
Что касается фальсифицированных лекарственных препаратов, то одним из способов борьбы с этим явлением М.А.Массалютина называет "Дни открытых дверей" в аптеке. Даже если это будут рекламные акции компаний-производителей, все равно люди смогут получить интересующую их информацию.
Заключение
Контроль качества и безопасности лекарственных средств, поступающих на рынок России, становится одной из основных забот государства. Россия имеет высокий потенциал для собственного производства лекарственных средств, есть мощные предприятия, производящие лекарства соответствующие мировому уровню качества.
В фармацевтической отрасли активно внедряется система обеспечения качества лекарственных средств, от их создания до реализации и применения их потребителем. Производство лекарственных средств в соответствии с европейскими стандартами – единственный путь предприятий к международному признанию. В перечне требований перехода на соответствие GMP 2/3 не являются затратными или требуют минимальных затрат, их выполнение под силу каждому отечественному производителю уже сейчас не ожидая начала 2009 года, при наличии соответствующей политической воли руководства предприятий.
Список используемой литературы
1. Славич-приступа А.С. Оптимизация маркетинга дистанционных аптечных продаж. / Славич-приступа А.С./ Российские аптеки.- 2007, №7.
2. Федотова О. О совершенствовании законодательства./ Федотова О./ Российские аптеки.-2007, №10.
3. Чубарев В.Н. Фармацевтическая информация: Учебное пособие.- М., 2000 г., 273с.
4. Аптека будущего – рецепты эффективности . Под ред. А.А.Синичкина.-М., 2002., 356 с.
5. Управление и экономика фармации: Учебник для ВУЗов в 4 т. Т1: Фармацевтическая деятельность. Организация и регулирование/И.В.Косова, Е.Е.Лоскутова, Т.П.Лагуткина и др.; Под редакцией Е.Е.Лоскутовой.- М., Издательский центр "Академия", 2003, 380 с.
6. http://www.nov-ap.ru/
7. http://www.unico94.ru/consult/all_docs/2007/
8. http://www.rbk.ru
Приложение 1
Проект национального стандарта «Производство лекарственных средств. Система и менеджмент качества. Основополагающие требования» как следствие потребности российских производителей ЛС в современном руководящем документе мирового уровня
«Разработка законодательных норм и национальных стандартов, принципиально отличающихся от соответствующих стандартов ЕС и ICH, нецелесообразна, поскольку не позволит странам СНГ стать полноправными членами ВТО». («Международное регулирование в сфере обращения ЛС и Федеральный закон «О техническом регулировании»» В.В. Береговых, А.П. Мешковский, Н.В. Пятигорская, В.Л. Багирова, Н.А. Ляпунов)
Необходимость такого документа связана с недостаточностью раскрытия раздела 1 национального стандарта ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств», определяющего требование наличия системы качества на предприятии – производителе лекарственных средств. Национальный стандарт ГОСТ Р 52249-2004 направлен в первую очередь на определение требований к условиям производства, а не к управлению процессом создания (производства) продукции.
Если должна быть система, обеспечивающая выпуск продукции стабильно надлежащего качества, то этой системой необходимо управлять. При этом система включает как части производственного процесса и надлежащей производственной практики, т.е. относящиеся к функционированию процессов, так и части, относящиеся к управлению организацией и взаимоотношениям с заинтересованными сторонами, необходимость наличия которой вызвана современным развитием методологии качества и общей теории управления (менеджмента).
«Обеспечение качества» (Quality Assurance), «Контроль качества» (Quality Control), «Надлежащая производственная практика» (Good Manufacturing Practice) являются составными частями системы качества. Данные разделы в известной степени пересекаются, но не противоречат, а дополняют друг друга с целью производства безопасного, эффективного, стабильно надлежащего качества лекарственного средства.
Задача настоящего стандарта – на основе общепризнанной модели управления качеством, изложенной в стандарте ИСО 9001-2000, установить структуру СМК организации-производителя ЛС, определить объекты СМК и дать их ключевые характеристики и требования к ним.
Настоящий стандарт предназначен для адекватной демонстрации организацией-производителем ЛС своих возможности и способности производить продукт стабильно надлежащего качества в управляемых условиях надлежащей производственной практики, а также для оценки этих способностей внешними сторонами.
Требования к СМК, устанавливаемые настоящим стандартом, являются дополнительными, а не альтернативными по отношению к техническим требованиям (спецификациям) на продукт и требованиям надлежащей производственной практики.
Краткое изложение изменений
Техническое содержание основы не изменилось. Были удалены положения и формулировки, не имеющие отношения к производству ЛС, а также введены дополнительные требования, отражающие специфику производства ЛС.
Ключевыми характеристиками нового стандарта является акцент на стабильность выпуска продукции надлежащего качества в управляемых условиях надлежащей производственной практики, ответственность руководства, взаимоотношения с регулирующими органами.
Требования стандарта соотносятся с требованиями к основным объектам надлежащей производственной практики, но изложены в более общем и концептуальном виде, чем это сделано в GMP и дополнены требованиями, которых нет в явном виде в GMP.
Это сделано для того, чтобы организация, имея в своем распоряжении максимально полную и современную модель системы качества, могла выбирать степень реализации и глубины тех или иных требований в зависимости от своего состояния, требований регулирующих органов или заинтересованных лиц и т.д.
Такой подход возможен в силу существующей мировой практики и принятого в РФ Закона «О техническом регулировании», согласно которому обязательный характер имеет Технический регламент (или директива в Европейском сообществе).
Остальные документы – национальные стандарты (РФ), GMP (EC) – несут в себе общепринятую модель, реализующую выполнение требований регламента и соответствие этим стандартам является общепризнаваемым выполнением требований регламента.
На рис. 1.1 показана структура основных частей системы качества фармацевтического предприятия – правил надлежащей производственной практики, контроля качества, обеспечения качества – относительно основного документа, имеющего обязательный характер – технического регламента.
Основной вопрос, на который отвечает данный стандарт: «Что должно быть в системе качества организации-производителя ЛС?».
При этом стандарт не является объединением требований к контролю качества, обеспечению качества, производству (GMP). Эти разделы достаточно объемны, особенно GMP, и требования к ним содержатся во многих национальных и международных документах.
Цель данного стандарта – в концентрированном виде представить состав объектов системы качества современного производителя ЛС и дать минимально необходимые требования к ним.
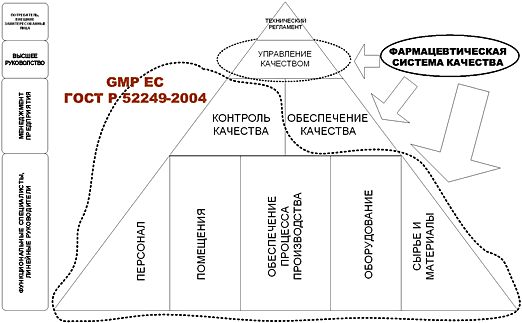
Рис. 1.1 Место стандарта в структуре нормативных требований к составным частям системы качества при производстве лекарственных средств и степень раскрытия составных частей в существующих нормативных документах.
Положения и требования настоящего стандарта следует рассматривать как дополнение, а не замену положений и требований нормативных документов по надлежащей производственной практике, контролю и обеспечению качества при производстве ЛС.
Однако положения данного стандарта представляют собой структурированную систему и не допускается их исключение при разработке и внедрении системы качества.
Стандарт – целостный документ, максимально полно на современном этапе развития методологии управления созданием качества отражающий структуру системы управления качеством.
Основные вопросы, возникающие при построении системы качества, можно разделить на две группы:
· Что должно быть в системе и Каким оно должно быть – относится к структуре системы качества
· Что делать и Как делать – относится к функционированию системы качества
Настоящий стандарт определяет первую часть, поскольку управление системой качества должно быть интегрирована в общую систему управления организацией в своей предметной и функциональной области.
Определяя, какие элементы должны содержаться в системе качества и какими основными характеристиками они должны обладать, стандарт не накладывает ограничения на способ реализации этих требований.
Таким образом, организация свободна в выборе способа реализации СМК в зависимости от собственных особенностей, функционирования внутренних процессов, стратегии и миссии пребывания на рынке, сложившейся деловой практики и т.д. при этом возможно создание семейства (пакета) документов, которые отвечают на вопросы части 2 – «Что делать» и «Как делать».
Это могут быть документы формата национальных стандартов, отраслевых стандартов и методических указаний, в которых содержатся способы и формы реализации того или иного требования, в том числе альтернативные.
Подобный подход позволит организации, имея четкие требования, сведенные в структурированную систему и основанные на лучших мировых образцах, реализовать их в наиболее удобной для себя форме.
Стандарт не является учебником или практическим пособием, а содержит основополагающие части системы качества для современного предприятия мирового уровня.
Ключевым отличием организации-производителя ЛС от других организаций в области менеджмента качества является неприменимость принципа «постоянные улучшения» к качеству конечного продукта. ЛС должно быть стабильно надлежащего качества соответственно спецификации (ФС). При этом принцип «постоянные улучшения» применим к процессам самой СМК и должен проходить в управляемых условиях, включающих в себя процедуры управления изменениями, документирования, анализа.
Еще одной из особенностей производства лекарственных средств является большое количество лиц, имеющих в этом процессе свои интересы, зачастую различные.
Существует как минимум девять групп заинтересованных лиц:
1. поставщик как юридическое лицо
2. производитель как юридическое лицо
3. персонал организации-производителя
4. менеджмент организации-производителя
5. владельцы (собственники) организации-производителя
6. врач
7. конечный потребитель
8. государство в лице регулирующих и контролирующих органов
9. общество в целом
Их взаимоотношения относительно жизненного цикла лекарственного препарата показаны на рис. 2.2
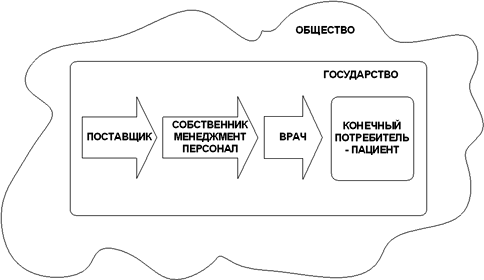
Рис. 2.2 Заинтересованные лица и жизненный цикл ЛС
Одна из задач настоящего стандарта – дать возможность всем заинтересованным лицам достижения своих целей.
Организация – производитель ЛС получает инструмент для выпуска продукции стабильно надлежащего качества, в результате врач может уверенно планировать процесс лечения, пациент получает безопасный и эффективный препарат, государственные органы – основу для объективной оценки предприятия, владелец – прозрачную структуру бизнес-процессов и гарантию выпуска продукции надлежащего качества, менеджмент – инструмент для эффективного управления, персонал – четкие инструкции и понимание своих действий. В результате выигрывает общество в целом.
Предлагаемый подход к построению и поддержанию в рабочем состоянии системы качества организации-производителя ЛС полностью находится в русле настоящих мировых тенденций в области систем качества и управления качеством, отражает практический опыт в разработке системы качества и позволяет организации разработать современную и эффективную систему качества.
Кроме этого, созданная модель позволяет регулирующим государственным органам иметь основу для адекватной оценки организации-производителя на предмет способности производить продукцию надлежащего качества в настоящий момент и в перспективе. Такой подход позволяет предприятию-производителю ЛС и контролирующему органу строить долговременные партнерские отношения, направленные на предоставление потребителю лекарственного средства стабильно надлежащего качества.
Проблема качества лекарственных средств на рынке России
Содержание
Введение
1. Товародвижение на фармацевтическом рынке
2. Управление системой качества при производстве лекарственных средств
3. Проверка качества лекарственных средств
4. Оценка качества лекарственных средств
5. Товаропроводящая система в России, ее особенности
5.1 Производство
5.2 Дистрибьюция
5.3 Розница
6. Региональная товаропроводящая система, ее особенности
7. Обеспечение качества лекарственных средств на каждом уровне товаропроводящей сети России
Заключение
Список используемой литературы
Приложение
Введение
Аптекарское дело началось в России в 1620 г. с утверждения аптекарского приказа и аптекарской палаты. До 1710 г. кроме военно-полевых аптек существовала только одна придворная или «верхняя» аптека в Москве.
Указом от 22 ноября 1701 г. Петр I разрешил открыть первые 8 «вольных» аптек в столице.
В настоящее время увеличение числа аптечных учреждений явилось одной из причин обострения конкуренции на фармацевтическом рынке. Кроме того, ассортимент продаваемых товаров значительно расширился. Появились нетрадиционные группы товаров, продаваемых в аптеке (БАД, гомеопатия, валеофармакологические препараты), а также стала более разнообразной традиционная для аптек товарная группа – медикаменты. Ассортимент лекарственных препаратов возрос почти в 3 раза, причем во многом за счет введения в ассортиментный перечень препаратов-синонимов различных фирм- производителей.
Всё это привело к тому, что предложение в настоящее время опережает спрос, т.е. рынок продавца преобразовался в рынок потребителя.
Аптекам теперь приходится прилагать значительные усилия по привлечению клиентов, чтобы поддерживать конкурентоспособность и достигать максимальной прибыли.
Поэтому тема обеспечения качества лекарственных средств весьма актуальна для сохранения жизнеспособности предприятия на рынке.
Целью данной курсовой работы является изучение теоретических основ принципов обеспечения качества лекарственных средств при движении от производителя к поставщику, а также рассмотрение товаропроводящих систем России и регионов.
Для достижения поставленной цели в данной курсовой работе необходимо решить следующие задачи:
1. Определить особенности товародвижения на фармацевтическом рынке;
2. Рассмотреть принципы обеспечения качества лекарственных средств при производстве;
3. Изучить принципы определения и оценки качества лекарственных средств;
4. Рассмотреть товаропроводящую систему России и регионов и определить принципы обеспечения качества лекарственных средств на каждом из ее уровней.
Для написания курсовой работы использовалась учебная литература по дисциплине, статьи из специализированных журналов, а также источники сети Интернет.
1. Товародвижение на фармацевтическом рынке
В сфере обращения ЛС можно выделить путь перемещения фармацевтических товаров, начиная от получения сырья, субстанции или культивирования лекарственных растений до покупки лекарственного препарата конечным потребителем. Часть пути от момента получения сырья до производства готовой продукции называется движением продукции производственно-технического назначения.
Вторая часть пути связана с продвижением готовой продукции от производителя до конечного потребителя или пользователя и называется товародвижением.
Товародвижение — процесс физического перемещения товара от производителя в места продажи или потребления. Не так давно эти два потока объединили в один, который и назвали сквозным материальным потоком. Новый объект, который появился в процессе движения продукции, стал предметом изучения науки логистики (от греч. logistics — искусство проведения расчетов).
Логистика в современном ее понимании достаточно новая дисциплина. Можно говорить о ее становлении как науки и области фактической деятельности в зарубежных странах с начала 70-х гг., 1 России — с 90-х гг. XX в., а точнее, с начала развития рыночных отношений. Как наука логистика разрабатывает новые эффективные методы управления сквозным материальным потоком, как тактическая деятельность — обеспечивает применение этих методов в деятельности организаций.
Ученые и практики утверждают, что использование логистики позволяет сократить материальные запасы на 30 — 70%, уменьшить время на хранение, ускорить прохождение продукции от производителя к потребителю и достигнуть экономического эффекта в системе товародвижения.
Особенностью логистики является то, что материальный поток сопровождают еще несколько потоков: финансовый, инфо  рмационный, сервисных услуг и транспортный. Задачами логистики являются планирование, организация и контроль всех видов деятельности по перемещению материальных, финансовых, информационных, сервисных и транспортных потоков от начал;) производства до конечного потребителя.
рмационный, сервисных услуг и транспортный. Задачами логистики являются планирование, организация и контроль всех видов деятельности по перемещению материальных, финансовых, информационных, сервисных и транспортных потоков от начал;) производства до конечного потребителя.
В зависимости от того, на каком участке изучается движение сквозного материального потока, различают закупочную логистику (обеспечение организаций материальными ресурсами), производственную логистику (управление материальными потоками внутри предприятий, создающих продукцию или оказывающих услуги по хранению, и др.), распределительную логистику (доведение готовой продукции до потребителя).
Бурное развитие оптового звена на фармацевтическом рынке и использование логистических подходов в фармации делают перспективным такое направление управления и экономики фармации, как фармацевтическая логистика, которой посвящен специальный раздел IV тома «Фармацевтический менеджмент, маркетинг и логистика».
Фармацевтическая логистика — наука и практическая деятельность по управлению И оптимизации потоков фармацевтических и других товаров, а также связанных с ними информационных финансовых и сервисных потоков, способствующих удовлетворению потребителей в фармацевтической помощи.
На рисунке 1 показана классическая логистическая схема движения товаров на фармацевтическом рынке. Полученное сырье (субстанция) поступает на склад производителя (или продукции производственно-технического назначения), с которого затем передается производителю.
На схеме видно, что весь путь, по которому проходит товар можно разбить на отдельные участки или звенья. Звенность товародвижения, т.е. количество складских звеньев, через которые приходит товар при его продвижении от производителя к потребителю как на основе перехода права собственности на товар, так и без него, создает каналы товародвижения.
Различаются транзитная форма товародвижения, когда товар перемешается от производителя в места продажи или потребления, минуя склады посредника, и складская форма товародвижения, при которой товар
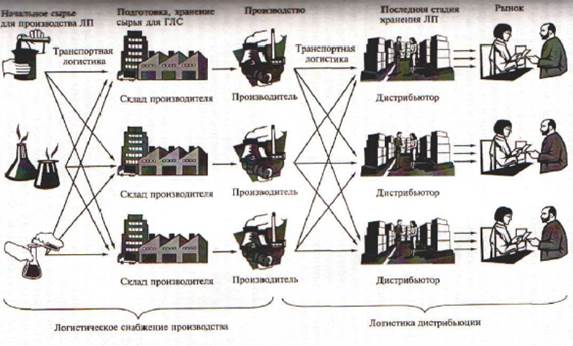
Рис.1 Классическая логистическая схема на фармацевтическом рынке
доставляется от производителя в места продажи или потребления через одно или несколько складских звеньев посредников.
Выбранные каналы товародвижения непосредственно влияю на скорость, время, сохранность и стоимость продукции при их доставке от производителя к конечному потребителю.
Несмотря на то, что порой цепочка может быть достаточно длинной, конечный потребитель, т.е. население определенного региона, должен быть уверен, что покупает по-настоящему качественный продукт. Поэтому контроль качества должен осуществляться на каждом из звеньев.
Дата: 2019-05-29, просмотров: 372.