Фармакокинетика
При попадании в циркуляцию эстрадиол прочно связывается с 2-глобулином и с меньшей аффинностью - с альбумином. Связанный эстроген относительно плохо диффундирует в клетку, поэтому физиологически активной является только свободная фракция гормона. В печени и других тканях эстрадиол превращается в эстрон и эстриол и их 2-гидроксилированные производные и конъюгированные метаболиты и экскретируется в желчь. Однако коньюгаты могут гидролизоваться в кишечнике с образованием активных реабсорбируемых соединений. Катехолэстрогены служат нейротрансмиттерами в центральной нервной системе. Они конкурируют за катехол-О-метилтрансферазу и в высокой концентрации подавляют инактивацию катехоламинов этим ферментом. В небольшом количестве эстрогены экскретируются в грудное молоко кормящих матерей.
Так как основное количество эстрогенов и их активных метаболитов экскретируется в желчь и реабсорбируется из кишечника, при пероральном приеме в результате энтеропеченочной циркуляции наблюдается значительное преобладание печеночных эффектов над периферическими. Если необходим периферический эффект эстрогенов, в частности у женщин после менопаузы, печеночные эффекты можно минимизировать, используя другие пути введения: вагинальный, трансдермальный или инъекционный. [3].
Физиологические эффекты
Эстрогены требуются для нормального полового созревания женщин. Они стимулируют развитие влагалища, матки и маточных труб, а также вторичных половых признаков. Эстрогены активируют развитие стромы и протоков молочных желез, влияют на рост подмышечных и лобковых волос и изменяют распределение жира на теле, что создает женский тип телосложения. Большие количествa эстрогенов стимулируют также развитие пигментации кожи, что более выражено в области сосков и половых органов.
Помимо действия на рост мускулатуры матки эстрогены также играют важную роль в развитии эндометрия. Постоянное и длительное воздействие эстрогенов приводит к аномальной гиперплазии эндометрия, которая обычно сопровождается аномальными кровотечениями.
Эстрогены дают ряд важных метаболических эффектов. Они частично отвечают за поддержание нормальной структуры кожи и кровеносных сосудов у женщин, подавляют резорбцию костей, существенно влияют на абсорбцию веществ в кишечнике, так как снижают его перистальтику.
Наряду со стимуляцией синтеза ферментов и факторов роста, приводящих к росту и дифференциации матки, эстрогены оказывают влияние на продукцию и активность многих белков организма. Особенно важны метаболические изменения в печени, так как в ней наиболее высока концентрация; таких белков, как транскортин, тироксин, глобулин, трансферрин, фибриноген. Эти изменения приводят к повышению концентрации циркулирующих тироксина, эстрогенов, тестостерона, железа, меди и других веществ. Эстрогены повышают свертываемость крови. Установлены многочисленные изменения факторов свертываемости при эстрогенной терапии, включая повышение содержания в плазме факторов II, VII, IX и X и снижение содержания антитромбина 3 частично в результате, печеночных эффектов.
Эстрогены изменяют состав лнпидов плазмы повышается содержание липопротеидов высокой плотности (ЛПВП), несколько стнижается содержание липопротеидов низкой плотности (ЛПНП) уменьшается концентрация холестерина. [2].
Клиническое использование
Первичный гипогонадизм
Лечение первичного гипогонадизма обычно начинают в возрасте 11-13 лет для стимуляции развития вторичных половых признаков и менструаций, оптимального роста и предотвращения психологических последствий задержки полового созревания. Терапия начинается с низких доз эстрогенов 3 мг конъюгированных эстрогенов или 5-10 мкг, которые назначают с первого по двадцать первый день каждого месяца. После завершения роста организма постоянная терапия в основном состоит из назначения эстрогенов и прогестинов.
Гормональная терапия в постменопаузном периоде
Кроме признаков и симптомов, следующий сразу же за прекращением нормальной функции яичников, таких как прекращение менструаций, возомоторные симптомы и атрофия половых органов, имеют место и истончение костей, изменение состава липидов, способствующее развитию сердечнососудистых заболеваний.
Когда прекращается нормальное функционирование яичников и концентрация эстрогенов падает в результате менопаузы, происходит резкий подъем концентрации в плазме холестерина и ЛПНП. Значительно изменяется содержание ЛПОНП и триглицеридов. Так как сердечнососудистые заболевания являются наиболее частой причиной смертности в данной возрастной группе, риск заболеваний составляет главную проблему при решении вопроса о целесообразности проведения гормональной терапии и влияет на выбор назначенного гормона. Благоприятное действие заместительной эстрогенной терапии на липиды и липопротеиды крови приводит к снижению частоты инфарктa миокарда па 50 % и инсультов на 40 %.
Развитие остеопороза зависит от количества костной ткани в начале этого процесса, от потребления кальция и от уровня физической активности. Риск остеопороза максимален у худых курильщиков, лиц кавказской расы, у малоактивных людей, при низком потреблении кальция, а также при семейной предрасположенности.
Эстрогены должны использоваться в минимальных эффективных дозах. Рекомендуемые дозы составляют 0.3-1.25 мг/день конъюгированных эстрогенов или 0.01-0.02 мг/день этинилэстрадиола. Для получения максимального эффекта необходимо начать терапию как можно раньше после наступления менопаузы. Пациентки с низким риском возникновения остеопороза, у которых проявляется только легкий атрофический вагинит, могут получать терапию местными средствами. Вагинальный путь введения используют и при лечении нарушений мочевого тракта. Эти препараты необходимо назначать циклами.
Лечение эстрогенами связано с повышением риска возникновения карциномы эндометрия. Назначение прогестиновых препаратов совместно с эстрогенами предотвращает гиперплазию эндометрия и значительно снижает риск возникновения рака. Если эстроген вводится первые 25 дней месяца и в течение последних 10-14 дней добавляется прогестин медроксипрогестерон (10 мг/день), риск возникновения рака снижается в два раза. Если прогестин вызывает седацию или другие нежелательные эффекты, его дозу cнижают до 2.5-5 мг в последние 10 дней цикла.
Ежедневное назначение 0.625 мг конъюгированных лошадиных эстрогенов и 2.5-5 мг медроксипрогестерона устраняет циклические кровотечения и вазомоторные симптомы, предотвращает атрофию половых органов, поддерживает плотность костей и улучшает липидный состав плазмы с небольшим снижением концентрации ЛПНП и повышением концентрации ЛПВП. Основным недостатком постоянной терапии является необходимость проведения биопсии матки, если после нескольких первых месяцев лечения возникают кровотечения.
Эстрогены можно назначать интравагинально и трансдермально, что снижает соотношение печеночных и периферических эффектов. [3].
Побочные эффекты
При терапевтическом использовании эстрогенов наблюдаются следующие побочные эффекты: постменопаузные кровотечения, часто отмечаются тошнота и огрубление молочных желез, чего можно избежать, максимально снижая дозу. Возможна также гиперпигментация, мигрень, гипертензия и заболевание желчного пузыря.
В результате длительного приема эстрагенов возможно небольшое повышение риска развития рака молочной железы. Несмотря на то, что фактор риска мал (1.25), его необходимо учитывать, поскольку эта опухоль возникает у 10 % женщин. У больных получающих эстроген, повышается риск возникновения карциномы эндометрия. Степень риска изменяется в зависимости от длительности терапии и дозы: так, риск в 15 раз выше у больных, принимающих большие дозы эстрогена в течение 5 лет и более, тогда как у больных, получающих в течение непродолжительного периода низкие дозы, риск повышается только в 2-4 раза. Применяя одновременно прогестин, можно не только предотвратить повышение риска, но фактически снизить частоту возникновения рака эндометрия ниже средней по всей популяции.
Известен ряд случаев развития аденокарциномы влагалища у молодых женщин, чьи матери получали большие дозы диэтилстильбэстрола на ранних сроках беременности. Этот тип рака характерен для женщин в возрасте 14-44 лет. Также его прием увеличивает вероятность бесплодия, внематочной беременности и преждевременных родов. Этот препарат можно использовать только для лечения рака или в качестве посткоитального контрацептива. [6].
Противопоказания
Эстрогены нельзя назначать больным с эстрогензависимыми новообразованиями, такими как карцинома эндометрия, или пациенткам с карциномой молочной железы или высоким риском ее развития. Их необходимо избегать при генитальных кровотечениях неустановленной природы, заболеваниях печени или тромбоэмболических нарушениях в анамнезе. [5].
Естественные прогестины
Прогестерон
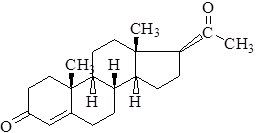
Прогестерон представляет собой основной прогестин у человека. Кроме того, он оказывает важное гормональное действие, он является предшественником эстрогенов, андрогенов и адренокортикостероидов. Он синтезируется яичниками, семенниками и корой надпочечников из циркулирующего в крови холестерина. Большое количество этого гормона синтезируется и высвобождается плацентой во время беременности.
В яичниках продукция прогестерона в первую очередь синтезируется желтым телом. Здоровые мужчины секретируют 1-5 мг прогестерона в сутки, что создает концентрацию в плазме 0,03 мкг/дл. У женщин во время фолликулярной фазы цикла, когда секреция прогестерона составляет только несколько миллиграммов в день, его уровень лишь немного выше. Во время лютеиновой фазы содержание гормона повышается с 0,5 мкг/дл до более чем 2 мкг/дл. [7].
Фармакокинетика
Прогестерон быстро абсорбируется при любом пути введения. Период его полувыведения из плазмы составляет приблизительно 5 минут, при этом небольшое количество гормона временно депонируется в жирах организма. Он практически полностью метаболизируется во время первого прохождения через печень и по этой причине практически не дает эффекта при назначении внутрь.
В печени прогестерон метаболизируется до прегнандиола и конъюгирует с глюкуроновой кислотой. В виде глюкуронида прегнандиола он экскретируется в мочу. Количество прегнандиола в моче используется как показатель секреции прогестерона. [8].
Физиологические эффекты
Механизм действия. Прогестины проникают в клетку и присоединяются к прогестероновым рецепторам, распределенным в ядре и цитоплазме. Комплекс лиганд-рецептор связывается с эффекторным элелементом, активируя транскрипцию генов. Эффекторный элемент для прогестерона подобен кортикоидному эффекторному элементу; специфичность ответа зависит от того, какой рецептор имеется в данной клетке. Комплекс прогестерон-рецептор образует димер до того, как связывается с ДНК. Однако отличие от эстрогеновых рецепторов он может образовывать как гетеро-, так и гомодимеры.
Эффекты прогестерона. Прогестерон оказывает слабое действие на метаболизм белков. Он стимулирует активность липопротеидлипазы и способствует депонированию жиров. Более выражено действие гормона на метаболизм углеводов. Прогестерон увеличивает базальный уровень инсулина и инсулиновый ответ на колебания содержания глюкозы у больных.
Прогестерон повышает температуру тела, влияет на деятельность центров дыхания (активизируется респираторный ответ на СО2). Прогестерон и родственные ему стероиды оказывает также центральное угнетающее и гипнотическое действие.
Прогестерон отвечает за развитие альвеол и долек секреторного аппарата молочных желез, за созревание и изменения секреции эндометрия, которые происходят в процессе овуляции. Гормон снижает уровень многих аминокислот в плазме и усиливает экскрецию азота с мочой. [8].
Клиническое использование прогестинов
Прогестиновые гормоны в основном используются для заместительной гормональной терапии и в качестве средств гормональной контрацепции. При парентеральном, применении в больших дозах в качестве монотерапии (например, 150 мг медроксипрогестерона ацетата внутримышечно каждые 90 дней) возникает длительное подавление овуляции и аменорея. Такое назначение используется при лечении дисменореи, эндометриоза, гирсутизма и патологических кровотечений, а также для контрацепции. Основным недостатком этой схемы является необходимость длительного периода восстановления функции яичников после прекращения приема.
Прием медроксипрогестерона ацетата по 10-20 мг внутрь два раза в неделю или по 100 мг/м2 внутримышечно каждые 1-2 недели останавливает ускоренное половое созревание у детей. Прогестерон можно использовать для тестирования секреции эстрогенов. Кровотечение, следующее за отменой 5-7-дневного введения 150 мг/день прогестерона или 10 мг/день медроксипрогестерона у больных с аменореей, возникает только в том случае, если эндометрий предварительно стимулируется эстрогенами.
Прогестин способен вызывать у некоторых больных повышение кровяного давления. У женщин наиболее активные прогестины снижают также концентрацию ЛПВП в плазме, что повышает вероятность возникновения инфаркта миокарда. [4].
Прогестерон
Progesteronum
Прегнен-4-дион-3,20
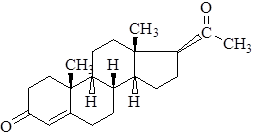
Характеристика. Белый кристаллический порошок. Практически нерастворим в воде, растворим в спирте, трудно растворим в растительных маслах.
Фармакология. При любых способах введения быстро абсорбируется. Максимальная концентрация при приеме внутрь достигается через 1-3 часа, при нитровании аппликации через2-6 часов. Степень связывания с белками плазмы около 90%. В печени превращается в 3-альфа, 5-бета-прегиан-диол. Экскретируется с мочой в виде глюкуронидов и прегнандиола.
Противопоказания. Гиперчувствительность, опухоли груди и репродуктивных органов, нарушение функции печени, вагинальные кровотечения, склонность к тромбозам.
Ограничения к применению. Бронхиальная астма, сердечная недостаточность, гипертензия, нарушение функции почек, заболевание ЦНС, сахарный диабет, внематочная беременность, кормление грудью.
Побочные действия. При приеме внутрь: сонливость и головокружение, расстройства менструального цикла.
Инъекции: тромбоэмболия, апатия, холестатический гепатит, нарушение зрения, изменение массы тела, отеки, увеличение молочных желез, аллергические реакции.
Форма выпуска. 1%, 2,5% растворы (10 и 25 мг) в масле в ампулах по 1 мл. [1].
Группа прегнана
Оксипрогестерона капронат
Oxyprogesteroni caproas
Прегнен-4-ол-17 альфа -диона-3,20 капронат
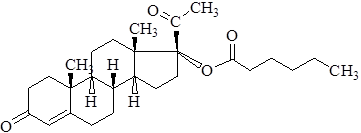
Характеристика. Белый или белый со слегка желтоватым оттенком кристаллический порошок. Практически не растворим в воде, растворим в спирте, жирных маслах.
Фармакология. 17-альфа-оксипрогестерона капронат является синтетическим аналогом гормона желтого тела - прогестерона. Химически отличается от прогестерона тем, что в положении с 17 содержит остаток капроновой кислоты. Из-за этого оксипрогестерон капронат более стоек в организме, чем прогестерон, действует медленнее и оказывает пролонгированный эффект. После однократного внутри мышечного введения действие продолжается от 7 до 14 дней, с целью профилактики и лечения угрожающего выкидыша вводят по 0,125-0,25г (1-2 мл 12,5% раствора) 1 раз в неделю. Оксипрогестерона капронат применяют только в 1-ой половине беременности.
Форма выпуска: 12,5% и 25% раствор в масле в ампулах. [6].
Дидрогестерон
Dydrogesteronum
Синоним: дюфастон.
(9 бетта-10, альфа)- прегна- 4,6- диен- 3,20-дион
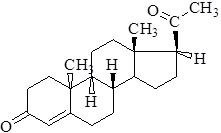
Фармакология. Прием препарата показан во всех случаях дефицита эндогенного прогестерона.
Показания. Андрогенная прогестиновая недостаточность: бесплодие, дисфункционирование маточного кровотечения. Применяется для сохранения беременности.
Дидрогестерон применяется при беременности и кормлении грудью, при этом выделяется с материнским молоком, поэтому грудное вскармливание во время приема препарата не рекомендуется.
Применяется препарат внутрь. [6].
Медроксипрогестерон
Medroxyprogesteronum
Синоним: провера, депопровера
(6 альфа)- 17- (гидрокси)- 6- метилпрегн-4-ен-3,20-дион (и в виде ацетата)
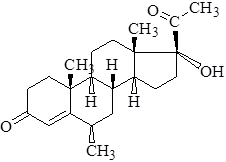
Характеристика. Белый кристаллический порошок без запаха, устойчив на воздухе. Растворим в ацетоне, частично растворим в этаноле и метаноле, трудно растворим в эфире, нерастворим в воде.
Фармакология. Ингибирует секрецию гонадотропинов гипофиза, предотвращает созревание фолликула и овуляцию связывающую с белками плазмы- 90- 95 %, время полувыведения 30 ч. Метаболизируется в печени. Выводится преимущественно с мочой в виде метаболита.
При приеме в целях контрацепции снижает риск возникновения воспалительных заболеваний половых органов. Также применяется при маточных кровотечениях, предменструальном синдроме, вазомоторных симптомах в период менопаузы.
Противопоказания. Гиперчувствительность, вагинальные кровотечения, беременность, кормление грудью.
Побочное действие. Нарушение менструального цикла, бессонница, слабость, аллергические реакции, лихорадка, крапивница.
Форма выпуска: таблетки 5, 10, 100, 200, 500 мг. Гранулированные по 200, 500, 1000 мг. Суспензия (15 %) для инъекций. Дозированный аэрозоль. [6].
Пролекарство
Линестренол
Lynestrenolum
(17 альфа)- 19- норпреги-4-ен-2о-ин-17 ол
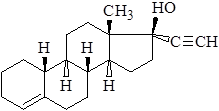
Фармакология. Образуется комплекс со специальными цитоплазматическими рецепторами, связанный с хроматином клеток мишеней и изменяющий синтетические процессы в клетке. Подавляет овуляцию, формирование желтого тела и удлиняет время наступления менструации. Повышает вязкость цервикальной слизи. Время достижения максимальной концентрации около 3 часов. Экскретируется главным образом с мочой.
Применяется при дисфункциональных маточных кровотечений, аменореи, карциноме эндометрия, мастопатии и др.
Побочное действие. Кровотечения, изменения либидо, неврозы, тошнота, боль в груди, увеличение массы тела, кожный зуд. [6].
4. СИНТЕТИЧЕСКИЕ ПРОГЕСТИНЫ
Синтезировано большое количество прогестиновых соединений. Некоторые из них активны при приеме внутрь. Это неоднородная группа соединений, каждое из которых отличается от прогестерона в том или ином отношении. В целом, 21-углеродные соединения (гидроксипрогестерон, медроксипрогестерон, мегэстрол и диметистерон) наиболее близки к прогестерону и фармакологически, и химически. [4].
5. ИНГИБИТОРЫ И АНТАГОНИСТЫ ЭСТРОГЕНА И ПРОГЕСТЕРОНА
Тамоксифен
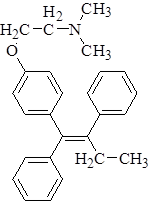
Тамоксифен является конкурентным ингибитором и парциальным агонистом эстрадиола, широко используемым для паллиативного лечения поздних стадий рака молочных желез у женщин в постменопаузном периоде. Препарат назначают по 10-20 мг два раза в день. [2].
Мифепристон
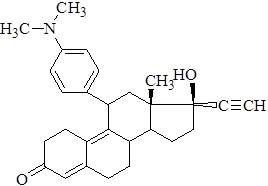
Мифепристон (RU 486) представляет собой 19-норстероид, который прочно связывается с прогестероновыми рецепторами и устраняет действие прогестерона.
Основной областью применения мифепристона является прерывание беременности на ранних сроках. Прием 400-600 мг/день в течение четырех дней или 800 мг/день два дня успешно прерывает беременность в 85 % случаев. Основной побочный эффект — это продолжительное кровотечение. [2].
6. СРЕДСТВА, ВЫЗЫВАЮЩИЕ ОВУЛЯЦИЮ
Кломифен
Кломифена цитрат, являющийся парциальным агонистом эстрогенов, структурно близок эстрогену хлоротрианизену. Соединение активно при пероральном приеме, поскольку быстро абсорбируется.
Кломифен - частичный агонист эстрогеновых рецепторов. Кломифен эффективно подавляет активность более сильных эстрогенов. У людей он вызывает повышение секреции гонадотропинов и эстрогенов.
Фармакологическое значение препарата обусловлено его способностью стимулировать овуляцию у женщин, страдающих аменореей и другими нарушениями этого процесса.
Наиболее частыми побочными эффектами являются горячие приливы, головные боли, запоры, кожные аллергические реакции и обратимая потеря волос, тошнота и рвота, повышенное нервное напряжение, депрессия, утомляемость, болезненность молочных желез, увеличение массы тела, учащение мочеиспускания и болезненные менструации.
Кломифен цитрат рекомендуется вводить в дозе 50 мг/день в течение 5 дней. [2].
Бромокриптин
Производное алкалоидов спорыньи бромокриптин связывается с дофаминовыми рецепторами гипофиза и подавляет секрецию пролактина. У 90 % и более пациенток лечение приводит к возникновению менструации в течение 3-5 недель. Обычно требуемая доза составляет 2.5 мг 2-3 раза в день. [2].
7. КОНТРАЦЕПТИВНЫЕ СРЕДСТВА
С начала своего развития человечество пыталось проводить контроль за рождаемостью, предупреждая возникновение нежелательной беременности. Долгое время люди пытались отделить занятия сексом от зачатия. Известно, что еще в 1850 году до н. э. древние египтяне использовали различные смеси, включающие мед, карбонат натрия и крокодилий навоз, для подавления активности спермы (т.е. использовали вещества, обладающие спермицидным действием). Со временем в этом направлении начали использовать хлопковые тампоны, смоченные вытяжкой из перебродивших соцветий акации. У различных народов в разные времена для предупреждения от беременности было принято помещать во влагалище другие предметы, такие как диски из расплавленного пчелиного воска, промасленная бумага, морские водоросли. [3].
Метод контрацепции с применением гормональных препаратов рекомендован женщинам:
1. любого возраста и с любым количеством беременностей в анамнезе, желающим ограничить свою репродуктивную функцию;
2. страдающим от ряда заболеваний (железодефицитная анемия, фиброзно-кистозная мастопатия, эндометриоз, нарушения менструального цикла, акне и т.д.);
3. нуждающимся в постабортном методе контрацепции (после абортов в первом и втором триместрах и после септического аборта);
4. с осложненным репродуктивным анамнезом;
5. в послеродовом периоде, спустя 21 день после родов при отсутствии грудного вскармливания;
6. с преэклампсией и диабетом беременных в анамнезе;
7. после неосложненных хирургических вмешательств, не требующих иммобилизации;
8. имеющим регулярный менструальный цикл, а также пациенткам с менометроррагиями;
9. страдающим воспалительными заболеваниями органов малого таза или имеющим риск развития подобных заболеваний;
10. инфицированным ВИЧ или туберкулезом;
11. с эктопической беременностью в анамнезе;
12. при наличии подострого течения послеродовой инфекции или эрозии шейки матки. [3].
Классификация гормональных контрацептивных средств
1.Контрацептивные средства планового применения
1.1 Чистые прогестины
1.1.1 Мини-пили
1.1.2 Депо-препараты
2.Средства посткоинтального контрацепции
2.1 Чистые эстрогены
2.2 Комбинированные оральные контрацептивы
2.3 Чистые прогестины
2.4 Антагонисты прогестиновых рецепторов
КОНТРАЦЕПТИВНЫЕ СРЕДСТВА ПЛАНОВОГО ПРИМЕНЕНИЯ
Чистые прогестины
Мини-пили
Мини-пили содержат минимальную концентрацию чистого прогестагена в 1 таблетке. Прием начинается с 1 дня цикла и продолжается в непрерывном режиме. Наиболее часто в препаратах используются норэтистерон (0,35 мг/сутки), левоноргестрел (30 мкг/сутки).
Мини-пили преимущественно показаны:
• женщинам с побочными эффектами или противопоказаниями к применению КОК;
• женщинам после 40 лет и женщинам старше 35 лет с факторами риска (курение);
• женщинам, страдающим диабетом и ожирением;
• женщинам с гипертензией;
• женщинам, страдающим мигренью;
• женщинам в периоде лактации.
Противопоказания к применению контрацептивов, содержащих только гестагены:
• любое серьезное состояние, которое может быть усугублено приемом стероидных гормонов (сосудистые заболевания);
• любые серьезные побочные эффекты оральных контрацептивов, если точно не известно, что они связаны с эстрогенами (т.е. аденома печени);
• перенесенное недавно трофобластическое заболевании;
• аномальные маточные кровотечения, поскольку при приеме препаратов возрастает вероятность нарушений менструального цикла ;
• внематочная беременность в анамнезе или высокий риск развития внематочной беременности;
• наличие функциональных кист в яичниках. [5].
Депо-Преператы
Депо-Провера — гестагенный препарат длительного действия для парентерального применения. Угнетает секрецию гонадотропных гормонов (особенно лютеинизирующего) и подавляет овуляцию. Препарат тормозит также секреторные изменения, необходимые для подготовки эндометрия к имплантации оплодотворенной яйцеклетки, и повышает вязкость слизи шейки матки, препятствует проникновению сперматозоидов.
После внутримышечного введения Депо-Провера абсорбируется медленно, в результате чего создаются низкие, но постоянные концентрации препарата. Максимальная концентрация в плазме крови достигается через 4-20 дней после в/м введения. Остаточные концентрации препарата обнаруживаются в плазме через 7-9 месяцев. Препарат проникает через гематоэнцефалический барьер и в грудное молоко.
Период полувыведения препарата составляет 6 недель.
Назначают по 150 мг каждые 3 мес. Первую инъекцию рекомендуют делать в первые 5 дней цикла или на шестой неделе после родов (при кормлении грудью).
Возможно появление крапивницы, сыпи тромбоэмболии, нервозность, бессонница, сонливость, слабость, депрессия, головокружение, головная боль тошнота нарушения менструального цикла, чувствительность молочных желез изменения веса. [6].
Фармакокинетика
При попадании в циркуляцию эстрадиол прочно связывается с 2-глобулином и с меньшей аффинностью - с альбумином. Связанный эстроген относительно плохо диффундирует в клетку, поэтому физиологически активной является только свободная фракция гормона. В печени и других тканях эстрадиол превращается в эстрон и эстриол и их 2-гидроксилированные производные и конъюгированные метаболиты и экскретируется в желчь. Однако коньюгаты могут гидролизоваться в кишечнике с образованием активных реабсорбируемых соединений. Катехолэстрогены служат нейротрансмиттерами в центральной нервной системе. Они конкурируют за катехол-О-метилтрансферазу и в высокой концентрации подавляют инактивацию катехоламинов этим ферментом. В небольшом количестве эстрогены экскретируются в грудное молоко кормящих матерей.
Так как основное количество эстрогенов и их активных метаболитов экскретируется в желчь и реабсорбируется из кишечника, при пероральном приеме в результате энтеропеченочной циркуляции наблюдается значительное преобладание печеночных эффектов над периферическими. Если необходим периферический эффект эстрогенов, в частности у женщин после менопаузы, печеночные эффекты можно минимизировать, используя другие пути введения: вагинальный, трансдермальный или инъекционный. [3].
Физиологические эффекты
Эстрогены требуются для нормального полового созревания женщин. Они стимулируют развитие влагалища, матки и маточных труб, а также вторичных половых признаков. Эстрогены активируют развитие стромы и протоков молочных желез, влияют на рост подмышечных и лобковых волос и изменяют распределение жира на теле, что создает женский тип телосложения. Большие количествa эстрогенов стимулируют также развитие пигментации кожи, что более выражено в области сосков и половых органов.
Помимо действия на рост мускулатуры матки эстрогены также играют важную роль в развитии эндометрия. Постоянное и длительное воздействие эстрогенов приводит к аномальной гиперплазии эндометрия, которая обычно сопровождается аномальными кровотечениями.
Эстрогены дают ряд важных метаболических эффектов. Они частично отвечают за поддержание нормальной структуры кожи и кровеносных сосудов у женщин, подавляют резорбцию костей, существенно влияют на абсорбцию веществ в кишечнике, так как снижают его перистальтику.
Наряду со стимуляцией синтеза ферментов и факторов роста, приводящих к росту и дифференциации матки, эстрогены оказывают влияние на продукцию и активность многих белков организма. Особенно важны метаболические изменения в печени, так как в ней наиболее высока концентрация; таких белков, как транскортин, тироксин, глобулин, трансферрин, фибриноген. Эти изменения приводят к повышению концентрации циркулирующих тироксина, эстрогенов, тестостерона, железа, меди и других веществ. Эстрогены повышают свертываемость крови. Установлены многочисленные изменения факторов свертываемости при эстрогенной терапии, включая повышение содержания в плазме факторов II, VII, IX и X и снижение содержания антитромбина 3 частично в результате, печеночных эффектов.
Эстрогены изменяют состав лнпидов плазмы повышается содержание липопротеидов высокой плотности (ЛПВП), несколько стнижается содержание липопротеидов низкой плотности (ЛПНП) уменьшается концентрация холестерина. [2].
Клиническое использование
Первичный гипогонадизм
Лечение первичного гипогонадизма обычно начинают в возрасте 11-13 лет для стимуляции развития вторичных половых признаков и менструаций, оптимального роста и предотвращения психологических последствий задержки полового созревания. Терапия начинается с низких доз эстрогенов 3 мг конъюгированных эстрогенов или 5-10 мкг, которые назначают с первого по двадцать первый день каждого месяца. После завершения роста организма постоянная терапия в основном состоит из назначения эстрогенов и прогестинов.
Гормональная терапия в постменопаузном периоде
Кроме признаков и симптомов, следующий сразу же за прекращением нормальной функции яичников, таких как прекращение менструаций, возомоторные симптомы и атрофия половых органов, имеют место и истончение костей, изменение состава липидов, способствующее развитию сердечнососудистых заболеваний.
Когда прекращается нормальное функционирование яичников и концентрация эстрогенов падает в результате менопаузы, происходит резкий подъем концентрации в плазме холестерина и ЛПНП. Значительно изменяется содержание ЛПОНП и триглицеридов. Так как сердечнососудистые заболевания являются наиболее частой причиной смертности в данной возрастной группе, риск заболеваний составляет главную проблему при решении вопроса о целесообразности проведения гормональной терапии и влияет на выбор назначенного гормона. Благоприятное действие заместительной эстрогенной терапии на липиды и липопротеиды крови приводит к снижению частоты инфарктa миокарда па 50 % и инсультов на 40 %.
Развитие остеопороза зависит от количества костной ткани в начале этого процесса, от потребления кальция и от уровня физической активности. Риск остеопороза максимален у худых курильщиков, лиц кавказской расы, у малоактивных людей, при низком потреблении кальция, а также при семейной предрасположенности.
Эстрогены должны использоваться в минимальных эффективных дозах. Рекомендуемые дозы составляют 0.3-1.25 мг/день конъюгированных эстрогенов или 0.01-0.02 мг/день этинилэстрадиола. Для получения максимального эффекта необходимо начать терапию как можно раньше после наступления менопаузы. Пациентки с низким риском возникновения остеопороза, у которых проявляется только легкий атрофический вагинит, могут получать терапию местными средствами. Вагинальный путь введения используют и при лечении нарушений мочевого тракта. Эти препараты необходимо назначать циклами.
Лечение эстрогенами связано с повышением риска возникновения карциномы эндометрия. Назначение прогестиновых препаратов совместно с эстрогенами предотвращает гиперплазию эндометрия и значительно снижает риск возникновения рака. Если эстроген вводится первые 25 дней месяца и в течение последних 10-14 дней добавляется прогестин медроксипрогестерон (10 мг/день), риск возникновения рака снижается в два раза. Если прогестин вызывает седацию или другие нежелательные эффекты, его дозу cнижают до 2.5-5 мг в последние 10 дней цикла.
Ежедневное назначение 0.625 мг конъюгированных лошадиных эстрогенов и 2.5-5 мг медроксипрогестерона устраняет циклические кровотечения и вазомоторные симптомы, предотвращает атрофию половых органов, поддерживает плотность костей и улучшает липидный состав плазмы с небольшим снижением концентрации ЛПНП и повышением концентрации ЛПВП. Основным недостатком постоянной терапии является необходимость проведения биопсии матки, если после нескольких первых месяцев лечения возникают кровотечения.
Эстрогены можно назначать интравагинально и трансдермально, что снижает соотношение печеночных и периферических эффектов. [3].
Побочные эффекты
При терапевтическом использовании эстрогенов наблюдаются следующие побочные эффекты: постменопаузные кровотечения, часто отмечаются тошнота и огрубление молочных желез, чего можно избежать, максимально снижая дозу. Возможна также гиперпигментация, мигрень, гипертензия и заболевание желчного пузыря.
В результате длительного приема эстрагенов возможно небольшое повышение риска развития рака молочной железы. Несмотря на то, что фактор риска мал (1.25), его необходимо учитывать, поскольку эта опухоль возникает у 10 % женщин. У больных получающих эстроген, повышается риск возникновения карциномы эндометрия. Степень риска изменяется в зависимости от длительности терапии и дозы: так, риск в 15 раз выше у больных, принимающих большие дозы эстрогена в течение 5 лет и более, тогда как у больных, получающих в течение непродолжительного периода низкие дозы, риск повышается только в 2-4 раза. Применяя одновременно прогестин, можно не только предотвратить повышение риска, но фактически снизить частоту возникновения рака эндометрия ниже средней по всей популяции.
Известен ряд случаев развития аденокарциномы влагалища у молодых женщин, чьи матери получали большие дозы диэтилстильбэстрола на ранних сроках беременности. Этот тип рака характерен для женщин в возрасте 14-44 лет. Также его прием увеличивает вероятность бесплодия, внематочной беременности и преждевременных родов. Этот препарат можно использовать только для лечения рака или в качестве посткоитального контрацептива. [6].
Противопоказания
Эстрогены нельзя назначать больным с эстрогензависимыми новообразованиями, такими как карцинома эндометрия, или пациенткам с карциномой молочной железы или высоким риском ее развития. Их необходимо избегать при генитальных кровотечениях неустановленной природы, заболеваниях печени или тромбоэмболических нарушениях в анамнезе. [5].
Дозы и лекарственные средства
Эстрогены вызывают практически одинаковые гормональные эффекты, но степень их выраженности зависит от конкретного препарата и пути введения. Как уже отмечалось, эстрадиол является наиболее активным эндогенным эстрогеном и имеет наиболее высокий аффинитет к эстрогенным рецепторам. Его метаболиты эстрон и эстриол оказывают слабое действие на матку. Обнаружено, что другой важный метаболит эстрадиола, 2-гидроксиэстрон (катехолэстроген), выполняет в головном мозгу функции нейромедиатора. Кроме того, он конкурирует с катехоламинами за катехол-О-метилтрансферазу и ингибирует тирозингидроксилазу. Вследствие этого препараты, содержащие эстрон и эстрадиол, дают больше центральных эффектов, чем синтетические эстрогены, метаболизируемые другим путем. [2].
1. ПРИРОДНЫЕ ЭСТРОГЕНЫ
Дата: 2019-05-29, просмотров: 317.