«Світ чарівний та фантастичний»,- такими словами лауреат Нобеліської премії Альберт Сент-Д*єд ї характеризує відчуття досліду, вивчаючого структуру води. Результати тим сильніше дивовижні, що дуже звичайний сам об’єкт вивчення.
Молекула води (Н2О) складається з двох атомів водню та одного атому кисню. Виявляється, майже не вся багатообразність властивостей води та незвичайність їх проявленням визначається, в кінцевому результаті, фізичною природою цих атомів, способом їх об’єднання в молекулу і групуванням утворених молекул.
В окремій досліджуваній молекулі води атоми водню та кисню, точніше ядра, розміщенні так, що утворюють рівнобедрений трикутник. На вершині нього – порівняно велике кисневе ядро, в кутах, прилягаючих до основи, - по одному ядру водню. [5]
У співвідношенні з електронною будовою атомів водню та кисню молекула води розраховує п’ятьма електронними парами. Вони утворюють електронну хмару. Хмара неоднорідна – в ній можна розрізнити окремі скупчення та розрідження. У кисневого ядра утворюється надлишок електронної густини. Внутрішня електронна пара кисню рівномірно обрамляє ядро схематично вона представлена опуклістю з центром – ядром О.

Чотири зовнішніх електрона групуються у дві електронні пари, притягнуті до ядра, але частково нескомпенсовані. Схематично сумарні електронні орбіта- лі цих пар показані у вигляді еліпсів, витягнутих від спільного центра – ядра О . Кожний із залишених двух електронів кисню утворює пару з одним електроном водню. Ці пари також притягуються до електронного ядра. Тому водневі ядра – протони – виявляються трохи оголеними, і тут спостерігається нестача електронної густини.[8]
Таким чином, в молекулі води розрізняють чотири полюси зарядів: два негативних (надлишок електронної густини в області кисневого ядра) та два позитивних ( нестача електронної густини у двох водневих ядер). Для більшої наглядності можна представити, що полюси займають вершини деформованого тетраедра, в центрі якого знаходиться ядро кисню
––– –––
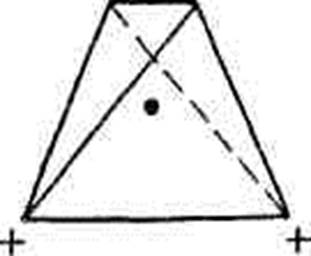
Майже кулеподібна молекула води має помітно виражену полярність, так як електричні заряди в ній розташовані асиметрично. Кожна молекула води є мініатюрним диполем з високим дипольним моментом – 1,87 дебая. Під впливом диполів води у 80 разів слабішають міжатомні чи міжмолекулярні сили на поверхні зануреної в неї речовини.
Інакше кажучи, вода має високу діелектричну проникність, найвищу з усіх відомих нам сполук.
Багато в чому, вода проявляє себе як універсальний розчинник. Її розчинній дії в той чи іншій мірі підпорядковуються і тверді речовини тіла, і рідини, і гази.
Постійно зближуючись з багатьма речовинами, вода фактично завжди представляла собою розчин різного, зачасту дуже складного складу.
Навіть із свіжовипадшої дождьової води можна виділити різні мінеральні та органічні сполуки, розчинені в ній.[6]
В прісних природних водах – річних, озерних – кількість розчинених речовин не перевищує 1 г/л. Від декількох одиниць до десятків грамів на літр коливається вміст солей у морській воді: наприклад, в Балтійському морі їх не більше 5 г/л, в Чорному – 18, а в Червоному близько 40г/л. В середньому в 1л океанської води розчинено 34-35 солей.
Сольовий склад річних та морських вод різний не тільки кількісно, але і якісно. На 89% морські солі складаються з хлоридів ( NaCl, KCl ), на 10% - з сульфатів ( Na2SO4, K2SO4 та MgSO4 ), на 1% - з карбонатів (NaCO3 , KCO3 ), а також незначних кількостей інших солей.
В прісних водах склад мінеральних домішок виглядає інакше. Найбільше з усіх тут карбонатів (Na та K) – до 80 %. Сульфатів (Na, K та Mg) – близько 13%. Інші 7% припадають на хлориди (Na та K) та інші солі.[2]
 Природна вода, що містить в розчині велику кількість солей Са та Mg, називається жорсткою на відміну від м’якої води, наприклад дождьової. Жорстка вода не дає піни з милом, бо розчинні солі жирних кислот, що знаходяться в милі ( а саме пальмітинова та стеаринова), переходять в нерозчинні кальцієві солі тих же кислот:
Природна вода, що містить в розчині велику кількість солей Са та Mg, називається жорсткою на відміну від м’якої води, наприклад дождьової. Жорстка вода не дає піни з милом, бо розчинні солі жирних кислот, що знаходяться в милі ( а саме пальмітинова та стеаринова), переходять в нерозчинні кальцієві солі тих же кислот:
2Са17Н35СООNa + СаSO4 = (C17H35COO)2Ca + Na2SO4
З газів у прісних і морських водах в невеликих кількостях є і різноманітні органічні компоненти – розчинні сполуки типу білків, цукрів, спиртів, вуглеводів і т.д. Це продукти життєдіяльності та розпаду тваринних та рослинних організмів, заселяючих водойми та берега, а також відходи промисловості та сільського господарства.
Полярність молекул води, наявність в них частково нескомпенсованих електричних зарядів породжує схильність до групування молекул в великі «спілки» - асоціати. Виявляється, повністю відповідає формулі Н2О лише вода, яка знаходиться в пароподібному стані. Ці результати показали визначення молекулярної маси водяної пари. В температурному інтервалі від 00 до 1000С концентрація окремих (мономерних молекул) рідкої води не перевищує 1%. Всі останні молекули води об’єднані в асоціати різного ступеня складності, і їх склад описується загальною формулою (Н2О)n.[9]
Безпосередньою причиною утворення асоціатів є водневі зв’язки. Вони виникають між ядрами водню одних молекул та електронними «скупченнями» (неподіленими електронними парами) у ядер кисню інших молекул води. Правда, ці зв’язки в десять разів слабкіше, чим «стандартні» внутрішньо-молекулярні хімічні зв’язки, і достатньо звичайних рухів молекул, щоб зруйнувати їх. Та під впливом теплових коливань так же легко виникають і нові зв’язки цього типу. Виникнення та розпад асоціатів можна виразити схемою:
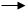 х ∙ Н2О (Н2О)х,
х ∙ Н2О (Н2О)х,
оскільки електронні орбіталі в кожній молекулі води утворюють тетраедричну структуру, водневі зв’язки можуть впорядковуватись розміщенню молекул води у вигляді тетраедричних координованих асоціатів.
Можливі й інші моделі водяної структури. Тетраедрично зв’язані молекули води утворюють своєрідні рої, досить стабільного складу. Простір між роями заповнюють мономерні молекули води.
Дослідники розкривають все більш тонкі та складні механізми «внутрішньої організації» водяної маси. Крім льодоподібної структури , рідкої води та мономерних молекул, описаний і третій елемент структури – нететраедричний.
Визначна частина молекул асоційована не в трьохмірні каркаси, а в лінійні кільцьові об’єднання. Кільця, групуючись, утворюють ще більш складні комплекси асоціатів.
Дата: 2019-05-29, просмотров: 309.