Многими авторами показано, что при ИВЛ появляется несоответствие между распределением воздуха и кровотока в легких [Зильбер А.П., 1971, 1978; Дворецкий Д.П., 1984; Rehder К. et al., 1972, и др.]. В результате этого увеличивается физиологическое мертвое пространство и шунтирование крови справа налево, повышается альвеолоартериальный градиент по кислороду. Нарушения вентиляционно-перфузионных отношений усиливаются с увеличением скорости газового потока (более 0,4 л/с) и частоты дыхания. Монотонный дыхательный объем способствует поступлению воздуха в одни и те же наиболее растяжимые участки легких. Возрастает опасность баротравмы альвеол. В менее растяжимых, участках отмечается склонность к ателектазированию.
По-видимому, ИВЛ значительно изменяет нормальное движение воздуха в легких. Согласно математической модели Шика–Сидоренко (рис. 1.3.3, а), при спокойном вдохе конвекционное движение воздуха по дыхательным путям замедляется по мере разветвления бронхиального дерева и на уровне кондуктивной зоны прекращается. В бронхиолах и альвеолах перемешивание воздуха осуществляется только за счет диффузии газов – броуновского движения молекул. В связи с большей скоростью газового потока при ИВЛ должны происходить смещение зоны конвекционного движения в сторону альвеол и уменьшение зоны диффузионного газообмена (рис. 1.3.3, б). Кроме того, при самостоятельном дыхании в большей степени вентилируются периферические участки легких, которые прилегают к движущейся диафрагме и грудной стенке. При ИВЛ, наоборот, наибольшая вентиляция происходит в перибронхиальных и медиастинальных участках, где в первую очередь создается положительное давление во время искусственного вдоха.
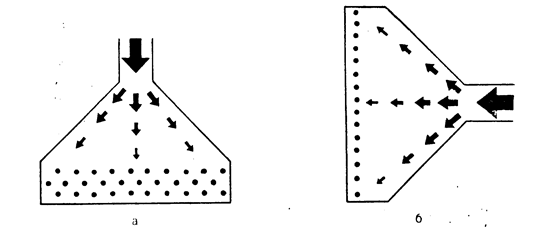
Рис. 1.3.3
С конца 40-х годов в литературе дискутируется вопрос: влияет ли на газообмен и гемодинамику форма кривых давления и газового потока? В 1947 г. A. Cournand и соавт. предложили свою «идеальную кривую давления», a J. Stoffregen (1956) – «улучшенную идеальную кривую
Для обеих характерно быстрое снижение давления в дыхательных путях после конца вдоха. А.С. Сметнев и В.М. Юревич (1984) также считают, что выдох должен начинаться немедленно после конца вдоха и положительное давление в легкие необходимо поддерживать только во время введения в легкие требуемого дыхательного объема. Считается, что это уменьшает вредное влияние ИВЛ на гемодинамику.
С. G. Engstrom и О.Р. Norlander (1962) теоретически обосновали другую форму кривой, на которой имеется плато – статическая фаза после окончания вдоха и перед началом выдоха. По их мнению, такая инспираторная пауза способствует наилучшему распределению воздуха внутри легких.
Ряд авторов считают, что вентиляционно-перфузионные отношения в легких улучшаются, если скорость газового потока нарастает к концу вдоха [Гейронимус Т.В., 1975; Максимов Б.П., 1978; Engstrom С. G., 1963; Johansson N., 1975, и др.]. С другой стороны имеются данные, говорящие в пользу постоянной [Гальперин Ю.С., 1972; Burchardi H., 1974] или даже снижающейся [Baker A.A. et al., 1977; Brychta О. et al., 1980; Danzmann E. et al., 1980; Al-Saady N., Bennett E ., 1985; Felton C.R. et al., 1984] скорости потока во время вдоха. Наконец, имеются серьезные сомнения в том, что форма кривых давления и скорости в дыхательных путях оказывает существенное влияние на газообмен в легких [Кассиль В.Л., 1981; Fuleihan S.F. et al., 1976, и др.].
Существуют также разногласия по вопросу о воздействии различных соотношений времени вдоха и выдоха на распределение воздуха в легких и отношение мертвого пространства к дыхательному объему.
Большинство исследователей считают, что ИВЛ значительно ухудшает механические свойства легких: их эластическое и аэродинамическое сопротивление вдоху возрастает. Увеличению последнего способствует турбулентность газового потока при ИВЛ. Что касается снижения растяжимости легких, то механизм его не совсем ясен, так как показано, что оно наступает буквально через несколько минут после начала ИВЛ [Mundeleer P., 1978].
Все же нам кажется, что влияние ИВЛ на газообмен и механику дыхания зависит прежде всего от исходного состояния легких и всего аппарата внешнего дыхания. Если вентиляционно-перфузионные отношения в легких до ИВЛ не были нарушены, то искусственное дыхание может существенно изменять их в отрицательную сторону. Но если ИВЛ начинают при острой дыхательной недостаточности, при которой обязательно нарушается отношение Уа/Qт, то результат скорее всего оказывается обратным. Увеличивая число вентилируемых альвеол, ИВЛ способствует уменьшению шунтирования крови в легких, снижая тем самым D (А-а) о2. В том, что это происходит, сомнений нет, так как нередко ИВЛ начинают при D (А-а) о2 более 450 мм рт. ст. в условиях самостоятельного дыхания 100% кислородом (FIО2=1,0). При этом PaО2 после начала ИВЛ, как правило, увеличивается, т.е. альвеолярно-артериальный градиент по кислороду значительно снижается. При этом сдвиг вентиляционно-перфузионных отношений в сторону увеличения Vа происходит не за счет дополнительных энергозатрат больного; наоборот, работа дыхания у него практически сводится к нулю.
То же можно сказать об увеличении отношения VD/Vт. В условиях самостоятельного дыхания увеличение физиологического мертвого пространства снижает эффективность вентиляции легких и требует от больного дополнительных затрат энергии на работу дыхания. При ИВЛ эту работу выполняет респиратор, а увеличивая дыхательный объем, легко можно уменьшить VD/VT до нормальной величины, т.е. обеспечить необходимый уровень альвеолярной вентиляции.
Более существенное значение, на наш взгляд, имеет неравномерность вентиляции в плане опасности баротравмы и ателектазирования отдельных участков легких. Этот неблагоприятный эффект ИВЛ должен быть по мере возможности устранен.
В последние годы большое внимание уделяется влиянию ИВЛ на недыхательные функции легких. Установлено, что искусственное дыхание неблагоприятно сказывается на дренажной функции трахеобронхиального дерева. В связи с выключением нормального кашлевого механизма после интубации трахеи или трахеостомии кашель либо отсутствует, либо становится неэффективным даже при хорошей функции экспираторных мышц и достаточном резервном объеме вдоха. Поступление в дыхательные, пути недостаточно согретого и увлажненного воздуха, повышенное содержание кислорода в газовой смеси нарушают работу ресничек бронхиального эпителия и местный иммунитет дыхательной системы [Можаев Г.А., Носов В.В., 1985; Bilnenstock J., 1980, и др.]. Задержка, бронхиального секрета, изменение его реологических свойств вызывают резкое падение коллатеральной вентиляции – закрываются поры Кона. Вследствие лимфостаза происходит сужение мелких бронхов и бронхиол. Указанные изменения приводят к нарушению механических свойств легких, в первую очередь – к повышению сопротивления дыхательных путей. Обеспечение полноценного дренирования трахеобронхиального дерева – одна из первоочередных задач при проведении длительной ИВЛ.
Большое значение имеет влияние ИВЛ на распределение воды в легких. Необходимо напомнить некоторые сведения из физиологии.
Согласно современным представлениям, перемещение воды из внутрисосудистого в интерстициальное пространство и обратно зависит от перепада между гидродинамическим давлением внутри капилляра и гидростатическим вне его, а также от градиента коллоидно-осмотических давлений между плазмой и интерстициальной жидкостью. По закону Старлинга поток жидкости (Q) выражается следующим уравнением:
Q = Кф[(Рвс – Рпв) –σ (Пвс-Ппв)],
где Кф – коэффициент фильтрации; σ – коэффициент отражения для белков; Рвс – внутрисосудистое гидродинамическое давление; Рпв – периваскулярное гидростатическое давление; Пвс – коллоидно-осмотическое давление плазмы (внутрисосудистое); Ппв – коллоидно-осмотическое давление интерстициальной жидкости (периваскулярное).
В легких Рпв соответствует альвеолярному давлению (РА) и, так же как Рвс, меняется в течение дыхательного цикла.
В артериальной части капилляра, где гидродинамическое давление преобладает над периваскулярным гидростатическим и коллоидно-осмотическим, жидкость фильтруется в интерстиций (рис. 1.3.4). В венозной части, где периваскулярное коллоидно-осмотическое давление выше гидродинамического, происходит резорбция жидкости. Та часть жидкости, которая не подверглась резорбции, удаляется с лимфой.
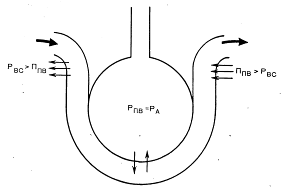
Рис. 1.3.4
Однако взаимоотношения между РА, давлением в артериальном (Ра) и венозном (Pv) участках капилляра зависят от положения различных участков легкого по, отношению к сердцу. Согласно J. В. West (1974) и G.Y. Gibson (1984), при вертикальном положении тела в легких можно различать четыре зоны, определяемые гравитационным фактором (рис. 1.3.5).
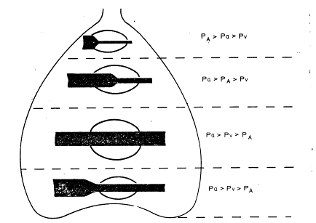
В верхней зоне (верхушки легких) среднее альвеолярное давление во время дыхательного цикла преобладает над артериальным, которое в свою очередь выше венозного:
РА > Ра > Pv.
Здесь в норме легочный кровоток осуществляется только во время вдоха, когда РА становится ниже атмосферного.
В средней зоне артериальное давление становится выше альвеолярного, но последнее преобладает над венозным или равно ему:
Pa > РА > Pv.
Здесь легочный кровоток осуществляется не за счет разницы (Ра – Pv), а благодаря градиенту (Ра – Рд).
В третьей зоне среднее альвеолярное давление в течение дыхательного цикла ниже артериального и венозного:
Ра > Pv > РА.
Именно здесь легочное кровообращение осуществляется с наибольшей интенсивностью.
Наконец, в четвертой зоне (базальные отделы легких) существуют те же отношения:
Ра > Pv >РА,
но перфузия снова снижается из-за местного увеличения интерстициального давления на прекапиллярные сосуды.
Следовательно, в нижних зонах легких Рвс всегда выше Рпв (поскольку Рпв = РА) и фильтрация жидкости происходит наиболее интенсивно. Нижние отделы легких, составляющие всего 25 –30% их общей массы, продуцируют около 50% лимфы, оттекающей по правому лимфатическому протоку [Dembling R.N., 1975].
ИВЛ, существенно изменяя регионарные взаимоотношения между альвеолярным, артериальным и венозным давлением [Зильбер А.П., 1978] (рис. 1.3.6), в значительной степени нарушает процесс обмена воды в легких. А.В. Бобриков и соавт. (1981) показали в эксперименте, что постоянное повышение внутрилегочного давления уже через 3 ч вызывает накопление жидкости в легких. При ИВЛ лимфоток из легких снижается [Caldini P., Leitz DJ., 1975; Schad H. et al., 1978, и др.].
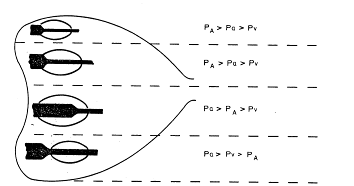
Рис. 1.3.6
Повышенное внутригрудное давление сдавливает правый лимфатический проток, затрудняя отток лимфы из легких. Кроме того, при высоком альвеолярном давлении во время искусственного выдоха может наступить сдавление легочных капилляров. Это значительно усиливает процесс фильтрации воды из артериальной части капилляра в интерстиций, особенно из экстраальвеолярных сосудов, где давление выше, чем в легочных капиллярах. Указанные процессы могут привести к образованию периваскулярных скоплений жидкости в виде муфт, окружающих капилляры. Задержка воды в легких особенно выражена при увеличении РАсо. Гипокапния несколько уменьшает опасность развития интерстициального отека [Schad H. et al., 1978, и др.]. Наконец, в условиях длительной ИВЛ может возникать гипопротеинемия из-за недостаточного снабжения организма энергией и пластическим материалом (азот). Это приводит к снижению коллоидно-осмотического давления плазмы, в результате чего могут развиваться отеки как в ткани легких, так и на периферии.
Приведенные выше данные показывают значение своевременного устранения метаболических нарушений у тяжелобольного в процессе ИВЛ. Сегодня чаще всего бывает трудно диагностировать и устранить задержку воды в легких, но несомненно, что работа в этом направлении должна быть продолжена.
Неблагоприятное влияние длительной ИВЛ на легочное кровообращение и метаболизм может привести к снижению активности и продукции сурфактанта, чему способствуют еще два фактора: высокое FiО2, и увеличение продукции антиальвеол при их растяжении большими дыхательными объемами. При повышении поверхностного натяжения в альвеолах возрастает эластическое сопротивление дыханию [Зильбер А.П., 1978, и др.].
Однако нельзя согласиться с тем, что длительная ИВЛ всегда вызывает снижение растяжимости легких. Как было показано ранее [Кассиль В.Л., 1974], этот процесс зависит не столько от самой ИВЛ, сколько от состояния легких в процессе искусственного дыхания. При развитии бронхолегочных осложнений (трахеобронхит; пневмония, ателектазы и др.) растяжимость легких прогрессивно снижается. По мере улучшения состояния больного растяжимость, как правило, постепенно увеличивается, становясь выше, чем до начала ИВЛ [Кассиль В.Л., Рябова Н.М., 1977].
Дата: 2019-05-29, просмотров: 334.