Ранние исследования в нереплицирующемся внеклеточных тахи- zoites показали, что пуриновое кольцо precur-сор, глицин, было слабо включены в Т. гондий нуклеиновых кислоты (Перотто и Keister, 1971). Когда Т. гондий выращивали в мутантной клетки-хозяина Defi-Cient в De Novo синтеза пуриновых, глюкоза и

| пуринов | 471 |
формиат предшественниками гуанина и аденина кольца были также включены слабо внутриклеточными Т. гондий (Шварцман и Pfefferkorn, 1982). Третье исследование показало, что Т. гондий не могли синтезировать пурин нуклеотиды De Novo из формиата, глицин, серин или (Крюг и др., 1989). В совокупности эти исследования ясно показали, что Т. гондий не может синтезировать пурины De Novo и поэтому строго полагаются на кражу питания пуринов от хоста.
Потенциал ориентации пуриновой ауксотрофии apicomplexan паразитов для ингибирования репликации паразита также показан в ранних исследованиях. Репликация Т. гондий эффективно ингибируется аденинарабинозид (ара-А), а также создание мутантов паразитов, устойчивых к ара-А показано, что активность (АК) паразитом аденозинкиназа требуется для активации и включения ара-А (Пфефферкорн и Pfefferkorn, 1976, 1978).
Большинство отчётных работ по пуринам ауксотрофии в apicomplexan паразитов сосредоточились на машинах, ответственных за взаимопревращени пуринов и включение хоста пуриновые нуклеотидных и нуклеозидов в паразите нуклеотидных пулов. Эта работа достаточно обширна и включает исследования по:
● активности ферментов
● Клонирование генов, экспрессия, кинетический анализ, STRUC-р определение
● регулирование и клеточная локализация
● генные нокауты
● мутантные клетки-хозяева
● геном и эволюционный анализ.
Т. гондий представил наиболее поддающийся модель для решения всех этих разнообразных подходов к расшифровке приобретения пуринов в Apicomplexa.
Т. гондий обладает значительным оборудованием для пуриновых спасанию, и эта обширная техника может позволить этому паразит, чтобы выжить и размножаться в широком диапазоне типов клеток млекопитающих. В отличии от культуры C.parvum обладает самым уменьшенной пуриновыми спасительной машиной из apicomplexans, и это уменьшенная способность, вероятно, будет связана с богатыми питательными веществами, но ограниченно, ниша этого паразита. В фальципаруме пуриновых путей P. лишь немного менее надежны, чем пути, присутствующие в
Т. гондий, Тем не менее, Plasmodium зр. нетипично по заражению и репликации внутри эритроцитов, и это apicomplexan паразит обладает новыми приспособлениями в пуриновых путях, которые не наблюдается в других паразитах.
18.2.3.1 пуринов спасательных путей в Т. гондий
Недавние генетические исследования Т. гондий имеют mented-Комплексы биохимические подходы к более четко определить транспортную и пуринов спасительную способность этого паразита. В ранних исследованиях, {3Н} гипоксантин маркировка Т. гондий-инфицированных Леша-Nyhan мутантных клеток-хозяев человека, дефицит гипоксантин-гуанинфосфорибозилтрансфераза активности, демон-strated, что только внутриклеточная паразиты были помечены без заметного включения в хост-клеточных нуклеиновых кислот (Pfefferkorn и Pfefferkorn, 1977а). Таким образом, поток пуринов является unidirec-ционного от клетки-хозяина к паразиту.
Только комплексное биохимический Investiga-ние деятельности паразитов, участвующей в спасанию, межрайонном преобразовании и включении принимающих пуринов в Т. гондий было оценено в жизнеспособном внеклеточном тахи- zoites (Krug и др., 1989). В какой-то степени, хост-клеточные мембраны и хост метаболизма пуринов ферменты могут загрязнять препараты внеклеточных тахизоитов (Нго и др., 2000). Это исследование также использовало высокие концентрации меченных пуринов, чтобы максимизировать транспорт и включение пуринов в внеклеточных тахизоитах, и такие высокие концентрации пуринов вряд ли помогли-в состоянии внутриклеточных тахизоят. Внеклеточные тахизоиты также не репликации организмов, и эта модель может не точно отражать комплексно-ность пуриновых взаимодействий между внутриклеточными паразитами и клеткой-хозяином.
Пуриновые основания гипоксантин, ксантин, гуанин и аденин были включены и инди-лаборантом наличие гипоксантин-ксантин-гуанин фосфорибозилтрансферазы (HXGPRT) активностью, а также активностью аденин-фосфорибозилтрансферазы (Aprt) (Круг и др., 1989 ). Аденин был включен половину так же эффективно, как гипо- ксантина. Гуанин была зарегистрирована на уровне 55 процентов, а ксантина в 67 процентов от скорости, с которой был включен гипоксантин (Круг и др., 1989).

472 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
Последующие исследования показали, что Т. гондий не имеет гена Aprt или активности (Chaudhary и др., 2004).
Пуриновые нуклеозиды аденозина, инозин, гуанозин и ксантозин был включены в нуклеиновые кислоты. Аденозин был включен более чем в 12 раз, а также любой другой пуринового нуклеозида или нуклеиновым, и предложил паразитом аденозин-киназы (АК), чтобы быть основным маршрутом до АМФ. В противоположность этому, гипоксантин была зарегистрирована на уровне 8,3 процентов, инозина на 8,2 процента, ксантин на 5,6 процента, гуанина на 4,6 процента, аденина на 3,9 процента, гуанозин на 2,5 процента, а Xantho синусоиды на 0,3 процента от скорости, при которой был включен аденозина (Круг и др., 1989). Соответственно, в паразитарных белковых экстрактах, приготовленных из extracellu-лар тахизоитов, активность АК была больше, чем в 15 раз более активны, чем следующий наиболее активный фермент.
Гуанин, гуанозин, ксантин и ксантозин помечены только гуанилатциклазы нуклеотиды. Таким образом, Т. гондий не имеет никакого пути от гуанилата к adeny-поздний нуклеотидов (Крюг и др., 1989). Аденозин, инозин, гипоксантин и меченые аденилатциклазы и гуанилатциклазы нуклеотидных бассейны в приблизительно равных соотношениях (Круг и др., 1989, Пфефферкорн и др., 2001).
Пуриннуклеозидфосфорилазу деятельность (PNP) были обнаружены только для инозина и гуанозина. Деаминазу действия были обнаружены на гуанин (GUAD), аденин (АДЭ), аденозин (АДА) и АМФ (AMPD) (Круг и др., 1989). В то время как сообщалось GUAD может присутствовать в T.gondii, эта активность не показана на текущей модели пуриновых путей (рис 18.1A), потому что эта активность была низкой; есть многочисленный хост GUAD, что может привести к загрязнению тахи- zoite препаратов, и ни один ген не ортолог еще обнаруживается для Т. гондия GUAD (Chaudhary и др., 2004). В то время как активность АДА Т. гондий была демон-strated в тахизоитах, выращенных в мутантной клетке-хозяина, дефицитной по принимающей аденозиндезаминазе (Крюг и др., 1989), путь АК на сегодняшний день является самым значительными путями для включения аденозина из-за высокие удельная активность АК.
Недавнее исследование показало, что аденин был переменно, но в целом слабо включены в Т. гондий
нуклеиновых кислот во время инфекции нормальных клеток-хозяев, но в клетках-хозяевах, которые являются несовершенными в Aprt активности аденин включение было значительно меньше, чем сообщалось ранее в Крюг и соавт. (1989) (Chaudhary и др., 2004). В то время как предполагаемый ген ортолог для Т. гондия ADE был идентифицирован, АДЭ путь к гипоксантину, как представляется, незначительный путем для этого паразита (Крюг и др., 1989,. Chaudhary и др, 2004). Гипоксантин превращается в инозин 5'монофосфата (ИМФ) с помощью HXGPRT. После того, как ИМП доступен, AMP может быть сделано в два этапа по adenylosuccinate синтетазы (ADSS) и adenylosuccinate лиазы (ADSL) и GMP, могут быть сделаны в два этапа по ИМП-дегидрогеназы (IMPDH) и GMP-синтетазы (GMPS). Таким образом, взаимопревращение нуклеотидов происходит только в направлении аденилат к гуанилатциклазы нуклеотидов через AMPD (рис 18.1A) (Круг и др., 1989, Пфефферкорн и др., 2001).
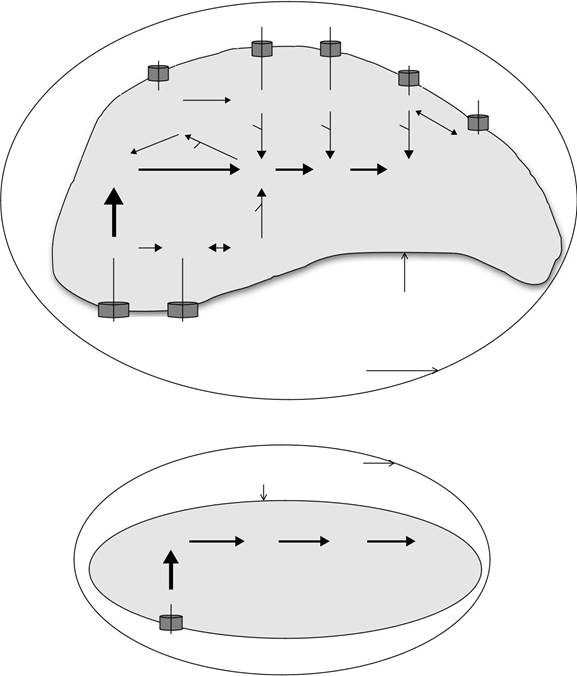
Там нет GMP-редуктазы, а кроме АК никакого другого нуклеозида-киназы или фосфотрансфераз действия не присутствует (Krug и др., 1989). Таким образом, Т. гондий обладает как минимум 10 ферментов, участвующих в взаимопревращения и спасение принимающих пуринов. Генные ортологи было зарегистрировано в течение девяти из этих ферментов в Т. гондий (ADE, ПНП, AK, HXGPRT, ADSS, ADSL, AMPD, IMPDH и ГМР) (Chaudhary и др., 2004). Т. гондий может транспортировать и спасти хост-нуклеозиды аденозин, инозин и гуанозин, а также хост Nucle-obases аденин, гипоксантин, ксантин и гуанин (рис 18.1A). Паразит может incorpo-скорость хозяина пурины в паразита нуклеотидного пула по двум основным маршрутам, через АК и HXGPRT.
Аденозин-киназа и гипоксантин-ксантин-гуанин фосфорибозилтрансферазы Включение хозяина аденозина в бассейн AMP с помощью АК, как представляется, наиболее существенной пуриновых реутилизация (Krug и др., 1989,. Нго и др, 2000; Чаудхарьте и др., 2004). Тем не менее, устойчивость к ара-А из-за мутации и нарушения паразит АК был описан еще в ранних исследованиях (Pfefferkorn и Pfefferkorn, 1976, 1978). Впоследствии инсерционный экран мутагенеза генома был использован для выбора ара-А-устойчивых мутантов. Один класс изолированных мутантов был нарушен в гене и активности АК, демонстрируя

| пуринов | 473 | ||||||
HOST цитозоль клетки
гипоксантин
аденин
гуанин
аденин
гипоксантин
ФРПФ
ФРПФ
ФРПФ
HXGPRT
гуанозин
L-аспартат
AMP
IMP
XMP
GMP
HXGPRT
Т. гондий тахизоит цитозол
гипоксантин
ПНП
Т. гондий тахизоит плазматической мембраны
Паразитофорная вакуоль ПРОСТРАНСТВО
Паразитофорная вакуоль МЕМБРАНА
A
HOST цитозоль клетки
Паразитофорная вакуоль МЕМБРАНА
C.PARVUM PLASMA МЕМБРАНЫ
AMP IMP XMP GMP
AMPD IMPDH GMPS
Аляска
аденозин C.PARVUM цитозол
аденозин
Паразитофорная вакуоль ПРОСТРАНСТВО
В
РИСУНОК 18,1 Модель пуриновых транспорта и спасательных путей в (А) Т. гондий; (В) культуры C.parvum;

474 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
HOST цитозоль клетки
паразитофорной вакуоль МЕМБРАНЫ
П. Falciparum PLASMA МЕМБРАНЫ
ксантин
гуанин
гуанозин
П. Falciparumцитозоль
ПНП
HXGPRT ксантин гуанин гуанозин
| ADSL | ADSS | ФРПФ | |
| L-аспартат |
HXGPRT ФРПФ
| AMP |
AMPD
XMP
IMPDH
HXGPRT
АДА
ПНП
ПНП
АДА
гипоксантин
MTI
MTA
Паразитофорная вакуоль ПРОСТРАНСТВО
С
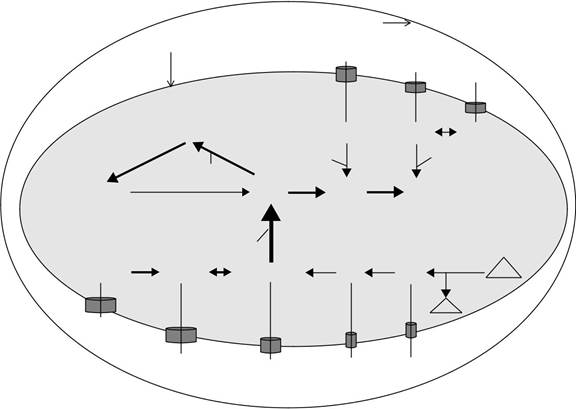
Рисунок 18.1 прод (С) П. фальципарум.
Клетка-хозяин цитозоль показан вне паразитофорной мембраны вакуолей. Паразитофорное вакуоль пространство и паразит плазматическая мембрана указаны. Пурин транспортеры показаны в виде цилиндров, опирающихся в мембране паразита плазмы. Пуриновые соединения, доступные для каждого паразита показаны внутри вакуоли паразитофорного пространства. Внутри паразита цитозоля ферментативного механизма управляющей пуринов взаимопревращения и сэлвидж принимающих пуриновых нуклеотидных и нуклеозидов в аденилат (AMP) и гуанилатциклазы (GMP) нуклеотидных пулов показано. Сплошные линии и стрелки показывают активные пути. Где информа-ция по потоку пуринов доступно взвешивание пути подчеркивается веса линий и стрелок. Взвешивание путей описаны в рисунке 18.1 отражает наиболее вероятные предсказания с толком-состоянием данных; тем не мение, Веса, показанные на этих диаграммах являются лишь гипотетическими и пуриновых поток принимающей пуринов в паразита, а также взаимопревращения и включения в пределах внутриклеточного паразита, остается быть проверена экспериментально. Субстраты каждой активности фермента показаны на стороне сплошной линии, и продукт (ы) каждую активность фермента показаны на стороне стрелки. Активность фермента, ответственная за каждый шаг преобразующего показана в капитальном курсиве рядом с линией стрелки. Аденозин-киназа (АК) и гипоксантин-ксантин-гуанин фосфорибозилтрансферазы (HXGPRT) предста направил основные пути для спасения и включения в состав нуклеотида пула, и эти ключевые виды деятельности, если они присутствуют, показано на рисунке. ААР, аденозиндезаминазы; АДЭ, аденин деаминазы; ПНП, пуриновых нуклеозидов фос-phorylase; ADSS, adenylosuccinate синтетазы; ADSL, adenylosucccinate лиазы; AMPD, АМФ деаминазы; IMPDH, инозин 5'монофосфат-дегидрогеназы; GMPS, GMP-синтетазы; СС, спермидин синтетазы; MTA, 5'-methylthioadenosine; MTI, 5'-methylthioinosine; ФРПФ, 5-фосфорибозил-1-пирофосфат. Закрытые треугольники: PS, синтез полиаминов; S, спермидин.

| пуринов | 475 |
еще раз, что паразит с нарушенной функцией АК по-прежнему размножается, как правило, скорее всего, по спасанию через HXGPRT (Sullivan и др., 1999).
Т. гондий АК была выражена в E.coli для биохимических, кинетических и структурных исследований, в которых выявлены существенные различия между паразитами АК и АК млекопитающих, которые могут быть использованы для разработки лекарственных средств (Darling и соавт, 1999;.. Шумахер и др 2000a, 2000b). Подрывной субстраты Т. гондий АК было показано, чтобы быть селективно токсичен для паразита (Pfefferkorn и Pfefferkorn, 1976; Iltzsch и др., 1995; эль Kouni и др., 1999). Интересно, что ген АК из культуры C.parvum дополняет АК-дефицитную Т. гондий. Такое дополнение система может представлять собой полезную модель с высокой пропускной способностью, по которому для скрининга потенциальных ингибиторов культуры C.parvum АК (Striepen и др., 2004).
HXGPRT представляет собой второй основной путь включения хозяевах пуринов. Однако, как АК, нарушение Т. гондий HXGPRT не оказывает существенного влияния на репликации или жизнеспособности тахизоитов (Pfefferkorn и Borotz, 1994;. Дональда и др, 1996). Уникальная ксантин фосфорибозилтрансфераза активность HXGPRT, которая отсутствует в организме человека, может быть использована для разработки лекарственных средств с использованием токсичных аналогов ксантина. Этот подход был Вели-датировано в исследованиях с использованием 6-thioxanthine, соединением с селективной токсичностью по отношению к T. гондиям (Pfefferkorn и Borotz, 1994; Пфефферкорн и др., 2001). Кристаллическая структура и ферментативные механизмы Т. гондий HXGPRT были определены, и паразит HXGPRT является потенциальной мишенью препарата (Шумахер и др, 1996;.. Heroux и др, 1999a, 1999b).
Паразиты, полностью лишенный АК HXGPRT или являются жизнеспособными, предполагая, что либо путь может быть достаточным для введения пуринового и паразит Repli-катиона (Donald и соавт, 1996;. Салливан и др., 1999). В нокауте паразит Т. гондий HXGPRT, хост аденозин требовался бы для паразита реплик-ции, и будет включен в аденилат нуклеотидов от АК, а затем в гуанилатциклазах нуклеотидов по АК, AMP Аденозиндеминазным, IMPDH и ГМРУ (рис 18.1A). И наоборот, в нокауте-мутанте Т. гондий АК, принимающий гуанин, гуанозин и ксантин обеспечит гуанилатциклазы нуклеотидов, но никакие аденилатный нуклеотиды не могут быть сформированы
из этих пуринов. В этом мутантном принимающем аденине, аденозин, инозин, или гипоксантин может POTEN-ственно удовлетворить спрос паразита для обоих adeny-поздний и гуанилатциклазов нуклеотидов (рис 18.1A). Все потенциальных предшественники хозяина пуриновыха бы воронка через гипоксантин в IMP пул, который может пойти в гуанилатциклазы нуклеотидов через IMPDH и ГИП и аденилатный нуклеотиды через ADSS и ADSL.
Поэтому, в отличие от P. малярийного и культуры C.parvum (обсуждается ниже), Т. гондий обладает функционально избыточной пурином реутилизацией (АК и HXGPRT) с емкостью для удовлетворения требования пурина, используя ассортимент потенциальных нуклеотидного хоста-клетку пуриновой и нуклеозиды. Эта особенность Т. гондий может помочь объяснить, как паразит способен реплицироваться в таком широком Vari-щества клеток-хозяев и тканей, которые могут представлять весьма разнообразные потенциальные ресурсы пурина. Комплекс пурина реутилизация Т. гондий также предполагает, что этот путь может быть подвергнуто сложными регуляторными механизмы (рис 18.1A). Например, паразиты, которые рост ингибируется путем обработкой 6-thioxanthine включают в четыре раз больше гипоксантина и ксантина в нуклеиновые кислоты, чем делать необработанные контрольные паразиты.
Недавние генетические исследования были проведены на Т. Gondii АК и HXGPRT, которые помогают прояснить previ-ОЕ наблюдения. деятельность HXGPRT и АК не могут быть одновременно нарушены в Т. гондий, предполагая, что они являются единственными функциональные маршруты к пуриновых нуклеотидов в паразита (Chaudhary и др., 2004). Следовательно, feasi-BLE выбить АК и HXGPRT деятельность паразита до тех пор, по меньшей мере, один функциональный путь, способ пуриновых нуклеотидов представлена в транс. Низкая активность Aprt активности обнаружена в линиях, дополненных функциональный геном Aprt из Leishmania donovani, но одновременное удаление генов АК и HXGPRT до сих пор не possi-BLE (Chaudhary и др., 2004).
Это генетическое исследование также показало, что одиночный нокаут гена паразита АК или HXGPRT есть

476 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
небольшие, но обнаруживаемые дефекты в пригодности, так как отпугнуть-добытую скорости роста тахизоитов. АК-дефицитные паразиты обладают фитнесом дефекта в скорости роста на 7,6 процента поколения, в то время как HXGPRT-дефицитные паразиты проявляют фитнес дефекта в скорости роста 3,7 процента поколения (Chaudhary и др., 2004). Это важное открытие предполагает, что приобретение пуринового может быть лимитирующей скорость роста паразита. В случае нокаут пара-сайта АК тот же источник хозяина аденозина будет доступен как в диком типе родителе, таким образом, поток аденозина, когда отвлекается из-за отсутствием активности АК, в инозин в гипоксантин в МВП, затем guany-поздно и аденилатный нуклеотиды, не является достаточным, чтобы полностью поддерживать нормальную скорость роста паразита.
Таким образом, паразит транспорт и включение хозяина аденина, аденозина, инозин, гипоксантин, гуанозина, гуанин, ксантин и через паразита HXGPRT недостаточно, чтобы полностью поддерживать нормальную репликацию паразита (рис 18.1A). Аналогичным образом, в HXGPRT нокаут, транспорт и включении принимающего аденозина через высокую активность АК путь-дорогу недостаточно для полной поддержки паразита реплики-ции, что указует на поставку хозяина аденозина само по себе не вполне достаточно, чтобы в полной мере поддерживать макси-маму паразит скорость репликации. В совокупности эти наблюдения указуют на несколько хост пуриновых Nucle-obases и / или нуклеозиды, и оба пути инкорпорации принимающих пуринов в нуклеотидных пулы T.gondii, вероятно, будет необходимо для поддержки максимальной скорости репликации.
Множественные изоформы и локализация HXGPRT Новым признаком Т. гондий пурин реутилизации является выражением двух форм HXGPRT из одного локуса генов путем альтернативного сплайсинга мРНК (Donald и соавт, 1996;. Уайт и др., 2000). Две изоформы отличаются друг от сегмента 49 амино-кислоты, содержащей дополнительный экзон в изоформы II. Обе изоформы ведут себя кинетический аналогичным образом, хотя изоформы II, немного менее эффективно
признание гуанина в качестве субстрата (Уайт и др., 2000). Клеточная компартментализация два HXGPRT изоформа отличается. Изоформы я это цитозольный, в то время как более длинная версия изоформы II, является локальной-роскопией к внутренней мембране комплексу (IMC) из тахизоишь (Чаудхарьте и др., 2005). 49 аминокислот вставки на N-конце изоформы II необходим для локализации в IMC. -Механич низм ИМК локализации был идентифицирован, чтобы быть Palmi-toylation, которые произошли в трех соседних остатков цистеина в течение 49-амино-кислоты вставкой. Мутация этих трех цистеинов заблокирована пальмитоилирование и локализация в ИКА (Chaudhary и др., 2005).
Биологическая основа функциональной избыточности HXGPRT в T.gondii, не является очевидной, поскольку обе изоформы функционально компетентного HXGPRT Activ-ности, (Donald и соавт, 1996;. Дональд и Русы, 1998). Вполне возможно, что эта функциональная избыточность HXGPRT позволяет T.gondii, чтобы расти в более широком разнообразии типов клеток, где пурины могут быть ограничивающими, и дополнительные механизмы могут потребоваться для пуринового транспорта и спасения. Кроме того, эта новая двойная локализация HXGPRT может отражать экономику метаболизма пуринов внутри самого паразита, или, возможно, какой-то неизвестный аспекта регулирования пуринов.
Исследования Т. гондий пуриннуклеозидфосфорилаза Ген Т. гондий ПНП был клонирована и экспрессирована в E.coli. Подобно человеческому и P. Falci-parum ПНПА, рекомбинантный Т. гондий ПНП фермент распознает инозин и гуанозин, как хорошие субстраты, а также аденозин и ксантозин, как плохие субстраты. Оба Т. гондий ПНП ПНП и малярия являются необычными в том, что дезоксинуклеозидов являются плохими субстратами (Chaudhary и др., 2006). Этот необычный субстрат свойство паразита ПНП показывает, что внутриклеточный паразит может иметь доступ к хост-пула гуанозин и инозин, но будет плохо включать хост дезоксигуанозин или дезоксиинозин транспортируемого паразита. Т. гондий ПНП не показали Activ-итй против 5'-methylthioadenosine (МТ) или 5'-methylthioinosine (MTI), и был нечувствительным к ингибированию метилтио (MT) -immucillin-H (Chaudhary и др., 2006). Immucillin-Н является сильным ингибитором нМ фермента паразита в пробирке (Chaudhary и др., 2006).

| пуринов | 477 |
В то время как репликация T.gondii, пара-сайтов дикого типа полностью не зависит от immucillin-H в пробирке, АК нокаута мутант Т. гондий является inhib-ITED по immucillin-H (Chaudhary и др., 2006). Ингибирование роста immucillin-H в нокаут фоне АК в значительной степени восстанавливается посредством Provid-ки избытка гипоксантина в пробирке культуральной среды в (Chaudhary и др., 2006). Если хост-аденин и гипоксантин подаются в достаточном количестве к реплицирующемуся паразиту, этот запас пурина должен придавать устойчивость к immucillin-H даже в нокауте-мутанте АК (рис 18.1A). Таким образом, на основе ингибирования роста с нокаутом АК путем immucillin-H, то возможно, что снабжение принимающего аденозина и инозина в intracel-lular среды превышает потенциальный запас хозяина аденина и гипоксантина, предполагая, что хост-нуклеозиды, а не принимающие нуклеотидные являются более важным пурином бассейном (рис 18.1A). Предостережение этой интерпретации ингибирования паразита ПНПА путем immucillin-H вероятность того, что гипоксантин может, отчасти, антагонизм ингибирования PNP, или что хост ПНП также ингибируется immucillin-H, таким образом уменьшая хост пуриновых бассейнов (Kicska и др., 2002а). Тем не менее, эти исследования дополнительно Вели-дата предложенные пути для пуринов incorpora-ции и спасения в Т. гондий (рис 18.1A). 2002a). Тем не менее, эти исследования дополнительно Вели-дата предложенные пути для пуринов incorpora-ции и спасения в Т. гондий (рис 18.1A). 2002a). Тем не менее, эти исследования дополнительно Вели-дата предложенные пути для пуринов incorpora-ции и спасения в Т. гондий (рис 18.1A).
Генетический отбор, основанный на Т. гондий HXGPRT Ранние исследования установили HXGPRT паразита и как потенциальной цель лекарственного средства, и ген, который был бы пригоден как для положительной и отрицательной генетической селекции в Т. гондиях (Pfefferkorn и Borotz, 1994). Механизм 6-thioxanthine inhibi-ции основан на активации 6-thioxanthine до 6-thioxanthine 5'монофосфат от паразита HXGPRT (Пфефферкорн и др., 2001). В отличие от mercap-topurine у млекопитающих (Elion, 1989a, 1989b), 6-thioxanthine и его нуклеотидная продукта 6-thioxanthine 5'монофосфат не является субстрат для Т. гондия GMPs и не включен в нуклеиновые кислоты. Механизм ингибирования parasitostatic, и в первую очередь включает в себя ингибирование паразита IMPDH на 6-thioxanthine 5'монофосфата (Пфефферкорн и др., 2001).
Т. гондий мутанты, дефицитные по HXGPRT полностью устойчивы к токсическому воздействию
6-thioxanthine (Пфефферкорн и Borotz, 1994). После того, как 6-thioxanthine сопротивления был выбран нокаутом HXGPRT, паразиты с функциональным HXGPRT может быть положительно отбирали по росту в микофеноловой кислоты (MPA) с добавками ксантина или гуанин (Pfefferkorn и Borotz, 1994). Эта схема выбора основана на способности MPA специфический ингибировать IMPDH, блокируя превращение ИМФ в XMP (рис 18.1A). Таким образом, паразиты с нефункциональным HXGPRT не могут быть спасены с ксантина или гуанина, когда IMPDH ингибируется, тогда как паразиты с функциональной HXGPRT будет спасен ксантина или гуанин добавок среды роста, и этот путь будет обходить ингибирование при IMPDH. Биохимический описание этой стратегии селекции также доказали, что Т.
Идентификация гена HXGPRT включен тест этого биохимического прогнозирования и привела к созданию прочной генетической схемы селекции для позитивной и негативной селекции с использованием принципов отбора, описанные выше (Donald и др., 1996). Схема выбора HXGPRT была создана первая система для генетической хит-беги мутагенеза в Т. гондий, где может быть установлен стабильный псевдо-диплоидный во время позитивной селекции, то негативный отбор используется, чтобы вытеснить ген HXGPRT, чтобы создать тонкое или основная мутация в локусе гена интереса (Donald и Руса, 1998). Генетическая модель HXGPRT широко используются для генерации мутантов с нокаутом в несущественных генах паразита, а также в генетических исследованиях развития паразита.ε-proteobacterium типа гена IMPDH из культуры C.parvum (Striepen и др., 2002).
18.2.3.2 пуринов спасательных путей в культуры C.parvum
Экспериментальная работа по пуриновому пути в культурах C.parvum была ограничена отсутствием надежного

478 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
системы для культивирования этого паразита, отсутствие каких-либо генетических моделей, а также трудности с получением очищенных паразитов для биохимического анализа. В Cryptosporidium геном дали первое подробное понимание стратегии паразита принявшую удовлетворить его аппетит к хост-клетки пуринов (Абрахамсено и др., 2004; Striepen и др., 2004; Xu и др., 2004). В дополнении к своей ограниченной способности синтезировать аминокислоты и пиримидины (обсуждается ниже), культуры C.parvum также обладает очень ограниченным репертуаром пуриновых и гаражей Intercon-версия ферментов по сравнению с другими apicomplexans (Chaudhary и др., 2004; Striepen и др. , 2004). Хотя раннее исследование с использованием экстрактов сырой паразитные предложил культуры C.parvum выразил HXGPRT и Aprt деятельности (Doyle и др., 1998), культуры C.parvum отсутствует какой-либо ген ортолог для Aprt или HXGPRT,
Примечательно, что аденозин является единственным хозяином пурин, что имеет какое физиологическое значение для культуры C.parvum, и поставляется в среде кишечника или клетки-хозяева, занимаемого культуры C.parvum (рис 18.1B). Подобно Т. гондий и П. фальципарум, культуры C.parvum обладает геном ортолог аденозина транспортера, которая может нести ответственность за транспорт хозяина аденозина в цитозоль паразита (Абрахамсно и др., 2004). Когда хозяин аденозин доступен в паразите цитозоле, паразит может включать в себя аденозин в нуклеотидном бассейн на АК пути-пути к AMP. После того, как паразит имеет нуклеотидный пул AMP, этот пул удовлетворяет весь спрос на весь аденилат и гуанилатциклазы нуклеотидов (Абрахамсно и др., 2004). AMP является первым деаминированы ИМП по AMPD. ИМФЫ затем преобразуются в XMP с помощью IMPDH и ХМР преобразуются в GMP с помощью ГИП (рис 18.1B). Так как не существует обратный путь от IMP до АМФ, нуклеотидная поток распространяется только от AMP до GMP. Ген parvum IMPDH С. был приобретен горизонтальным переносом генов изε-proteobacterium (Striepen и Киссинджер, 2004; Striepen и др., 2002, 2004). Паразита обладает только эти четыре ферменты, чтобы направить unidirec-ционных потока транспортируемой хозяина аденозина паразитировать аденилатциклазы и гуанилатциклазы нуклеотидов (рис 18.1B).
Потенциальные цели наркотиков в Пурин культуры C.parvum спасательных путей В отличие от Т. гондий, каждый из культуры C.parvum пурин ферменты пути метаболизма (АК, AMPD, IMPDH и ГМР) по отдельности представляет собой потенциальную мишень лекарственного средства. Активность АК культуры C.parvum была Вели-датирована в качестве мишени лекарственного средства в генетических экспериментах с использованием АК-дефицитным мутантом Т. гондия. Культуры C.parvum АК дополняет дефицит АК в Т. гондий, RESTOR-ки значительного АК активности (Striepen и др., 2004).
IMPDH ингибирование с помощью лекарственных средств, таких как рибавирин, мизорибин, и МРА была продолжена в качестве стратегии для индуцирования гуанилата нуклеотидного истощения для Ther-APY при раке, иммунодепрессивной химиотерапии и инфекционных заболеваний (Allison и Eugui, 2000, 2005;. Pockros и др 2003). Способность человека и многих патогенов phosphoribosylate гуанина к GMP может разбавить потенциальный терапевтический эффект ингибирования IMPDH путем предоставления второго маршрута к GMP. Отсутствие этого второго пути к GMP в parvum предполагает C. гуанилатциклазов голодание может быть эффективно индуцируется посредством ингибирования IMPDH или GMPs, а также АК и AMPD. Рибавирин и MPA были показаны в начале работы для ингибирования культуры C.parvum Devel-тие (Woods и Upton, 1998). Недавние работы показали, что C. parvum развитие ингибируется в зависимости от дозы этих ингибиторов IMPDH (Striepen и др., 2004).
18.2.3.3 пуринов спасательных путей в П. фальципарум
Пурин и взаимопревращение Б путь является более разнообразным в P. фальципаруме, чем в культурах C.parvum, и может быть немного менее надежным, чем пути, присутствующие в Т. гондиях. Тем не менее, П. фальципарум (и Plasmodium зр.) Однозначно обладают ферментами метаболизма пуринов, которые высоко адаптированы к внутриклеточным проблемам, с которыми сталкиваются этим паразитом. В Apicomplexa, Plasmodium зр. является уникальным в живых и тиражирование в эритроцитах. Эритроцита является весьма дифференцирован типом клеток, который потерял много возможностей, как правило, присутствует в других типах клеток млекопитающих, и, следовательно, имеет очень ограниченные требования нуклеотидных. Человек эритроциты также не имеет ядра, не Synthe размера ДНК, РНК или белок, и испытывает недостаток как пуриновых и пиримидинового De Novo пути синтеза.

| пуринов | 479 |
Для выполнения своих нуклеотидных требований, П. Falci-parum по-видимому, способен транспортировать пуриновые нуклеотидные гипоксантин, ксантин и гуанин, а также пуриновых нуклеозидов, аденозина, инозин и гуанозин. П. фальципарум обладает соответствующей ферментативной машиной для взаимопревращения и включения любых из этих шести потенциальных источников пуриновых (рис 18.1C) (Chaudhary и др., 2004). P. фальципарум не имеет обратного пути от гуанилата к аденилатный нуклеотидам, и в то время как хост поставляемого ксантина, гуанин, или гуанозин, коллективно, мог бы удовлетворить спрос паразита для гуанилатциклазов нуклеотидов, эти предшественники не могли поставлять любую аденилатный нуклеотиды. Хост аденозина, инозин и hypox-anthine, индивидуально или коллективно, Поэтому, вероятно, будет необходимы для удовлетворения спроса на паразит для аденилата и гуанилатциклазов нуклеотидов. В то время как паразит может транспортировать дополнительные соединения пурина, их физиологическое значение, если таковые имеются, не ясно, в это время. Так, например, аденин транспортируется П. фальципарум, пока не incorpo рейтинг, так как паразит не хватает Aprt и АДЭ генов и активностей (Chaudhary и др., 2004).
Подобно Т. гондий, П. фальципарум может конвертировать аденозин в инозин с помощью ADA, и инозин затем превращают в гипоксантин от паразита ПНП (рис 18.1C). Подобно человеку и Т. гондий ПНП, П. фальципарум ПНП не распознает ни ксантозина или аденозина в качестве субстрата хорошей (Kicska и др., 2002а). Гипоксантин вводят в пул нуклеотидов в качестве IMP по HXGPRT. После того, как IMP доступен, паразит может удовлетворить все свои потребности в аденилате и гуанилатциклазы нуклеотидов. Следует отметить, что P. фальципарум не хватает какой-либо обнаружить ген АК или активность. IMP преобразуется в AMP в два этапа путем последовательных реакций ADSS и ADSL. Это единственный путь к АМП. Паразит может сбалансировать ИМФ и AMP пулов в обратной реакции AMP дезаминирования к IMP (рис 18.1C).
Поскольку П. фальципарум не имеет прямой путь к АМФ из аденозина, наиболее важным пуриновых для включения в пуриновых нуклеотидов становится гипоксантин. Гипоксантин является единственным пуриновым соединением, которое может полностью удовлетворить спрос паразита для оба аденилата и гуанилатциклазов нуклеотидных бассейнов. Как также видно в обоих T.gondii, и
культуры C.parvum (Рисунок 18.1), ИМП превращается в XMP от паразита IMPDH, а впоследствии GMP на паразита ГМР. ХМР и GMP, также включены в P. малярийного через phosphoribosylation ксантина и гуанина, соответственно. Таким образом, в конечном счете, паразит включает в себя все нуклеотиды пуриновых через паразит HXGPRT активность, и обладает мини-мамой из семи различной пурина взаимопревращения или включения деятельности (рис 18.1C).
Потенциальные цели наркотиков в П. фальципарума пурина реутилизация Механизм, используемый P. фальципарум, чтобы удовлетворить свой пуриновый ауксотрофию предполагает, что пуриновые транспортеры, паразит HXGPRT, некоторые пурины взаимопревращения ферменты или недавно обнаружили новые переработки пуриновой или реутилизации могут все быть аменабельными мишенями для лекарственного средства развитие. Из-за отсутствия активности АК в П. малярийного деятельность ADA и PNP были RECOG-зовал в качестве потенциальных мишеней для лекарственных средств в ранних исследованиях (Daddona и др, 1984, 1986;. Webster и др., 1984).
Гипоксантин может быть непосредственно транспортирует паразит из паразитов клетки-хозяина или, изменять-нативно, гипоксантин может подаваться от транспортируемого инозина и аденозина через ADA и деятельность ПНФА. Хост эритроцитов гипоксантин бассейны могут увеличиться в течение инфекции от хозяина catabo-ЛМЗСА АТФ в ухудшении паразитируют эритро-cytes. Хост эритроцитов АТФ катаболизируется последовательно, с помощью АДФ, АМФ, аденозина, и инозина, чтобы произвести гипоксантин через хост ПНФ (Тин и др., 2005). Известно, что истощение гипоксантина эффективно ингибирует репликацию малярийного П. в пробирке (Берман и др, 1991;. Берман и человеческий, 1991); Таким образом, физиологический источник гипоксантина является важным вопросом, требующим ответа оптимизации стратегий для ингибирования приобретения пурина Plasmodium инфекции. Если масса объединенной гипоксантин происходит строго в паразита цитозоле от транспортируемых пуринов хозяина, паразит ААР и деятельность PNP могут быть оптимальные цели наркотиков. Осложняет этот анализ, однако, недавние исследования, которые демонстрируют П. фальципарум быть крайне необычным в обладании тропу от 5'-methylthiopurines в гипоксантин. Если П. фальципарум может перевозить 5'-methylthiopurines из среды эритроцита, паразит

480 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
потенциально могут спасти дополнительный гипоксантин этим новым пути (обсуждается ниже).
Ингибирование ПНФ в П. П. фальципарум фальципарум обладает структурно новый PNP фермент, который ингибируется immucillin соединений (Kicska и др., 2002a). Несколько immucillin соединений связываются P. фальципарум ПНФА с низкими константами ингибирования наномолярных и ингибируют активность ферментов. Человек ПНП также является объектом immucillins, с суб-нмоль констант ингибирования, и в настоящее время эти соединения изучаются для лечения рака и иммуносупрессии химиотерапии. Immucillin-Н, immucillin, который ингибирует как человек и P. фальципарум PnP, индуцированные пуриновые менее смерти в P. фальципарум инфекции (Kicska и др., 2002b). Рост паразита inhibi-ции, индуцированный immucillin-H восстанавливается путем дополнения культуральной среды с высокими дозами гипоксантина, предполагая, что эффект immucillin-H в первую очередь блокировать приобретение основных пуринов, в результате чего пуринового менее смерти (Kicska и др., 2002b). Кристаллическая структура и энергетические исследования по картированию П. трехдневной ПНП и immucillin интер-акций находятся под следствием, чтобы идентифицировать селективные ингибиторы паразита ПНП (Shi и др., 2004;. Lewandowicz и др, 2005).
Ингибирование HXGPRT в П. фальципарум Ранние шпилька-х годов на ингибиторы роста поддержки фальципарум П. HXGPRT активности паразита для разработки лекарственного единения (Queen и др., 1990). П. рост фальципарум в пробирке ингибируется аналоги пурина 6-меркапто-пурин, 6-тиогуанин и 8-азагуанин. Исследования не проводились, чтобы установить, является ли механизм 6-меркаптопурин торможения в P. малярийного аналогичен механизму у млекопитающих, который требует активации с помощью фосфо-рибозилирования через хост HGPRT, а затем Понимать-ции GMPs включать токсическое аналог в гуанилатциклазах нуклеотидного пул для его токсического incorpo-рациона в нуклеиновые кислоты (Elion, 1989a, 1989b).
Ранние исследования характеризуются ферментативные проп-erties и ген, кодирующий P. фальципарум HXGPRT (Queen и др, 1988;.. Vasanthakumar и др, 1989, 1990). Кристаллическая структура P. фальципарум HXGPRT выявили уникальные структурные особенности
Паразит фермента по сравнению со структурой человеческого фермента (Ши и др., 1999а, 1999b). Дополнительные исследования исследовали механизмы ферментов, и особенности направляя субстратной специфичности и свинца ингибиторы переходного состояния были зарегистрированы (Саркар и др., 2004; Томас и Field., 2002; Ши др, 1999a; Li и др., 1999). На основе пуриновых инкорпорации путей выясненных для P. фальципарум, селективно блокирует включение гипоксантин путем ингибирования HXGPRT было предсказано, как правило, чтобы побудить пуринового меньше смерти в P. малярийного (рис 18.1C). Экраны были созданы, чтобы идентифицировать селективные субстраты P. фальципарум HXGPRT (Shivashankar и др., 2001). Вполне возможно, что ксантин phosphoribo-syltransferase деятельность П. трехдневный HXGPRT, которая отсутствует в организме человека,
Inhibitionofguanylatenucleotidepoolsin
П. фальципарум гуанилатциклазы нуклеотиды могут возникнуть из гуанина, поставляемого хоста, гуанин, полученного из хост-гуанозина от паразита ПНП, и ксантин через HXGPRT. Эритроцит хозяин П. малярийного не хватает активности киназы гуанозина, и биохимические данные свидетельствуют о том, что хозяин гуанин и бассейны гуанозиновых доступны для P. малярийных ограничены (Reyes и др., 1982). П. рост фальципарум в пробирке подавляется psicofuranine, ингибитора бактериального GMPs (McConkey, 2000). Psicofuranine ингибирования роста паразита антагонист путем подачи дополни-тельного гуанина паразитировать среды роста (McConkey, 2000). Эти наблюдения дают убедительные доказательства того, что основной путь к GMP лежит через ГИП, и демонстрирует, что при культивировании в пробирке потенциальное предложение хозяина гуанина и гуанозина ограничен (рис 18.1C).
К сожалению, возможное значение хозяина ксантина в формировании GMP не выяснено эти исследования. Ксантин может быть включен в бассейн GMP на последовательных реакции HXGPRT и ГИП. Эритроциты человека, как сообщает, имеет концентрацию ксантина в ~ 3.6ìM,

| пуринов | 481 |
который может быть достаточным для физиологического транспорта и включения пути HXGPRT и ГМРОМ (Траут, 1994). МРА, высоко специфический ингибитор IMPDH, блоки П. фальципарум репликация на микромоле доза в пробирке (Королева и др., 1990). Хотя эти наблюдения указывают на то, что хозяин ксантина бассейны не являются достаточными, чтобы обойти торможение на паразита IMPDH, эти результаты не могут быть окончательно между preted, потому что MPA также подавляет хозяина IMPDH и истощает хост гуанилатциклазы нуклеотидные бассейны.
Inhibitionofadenylatenucleotidepoolsin
П. фальципарум Единственный путь к АМФ из ИМФ нуклеотида пула через последовательные REAC-ций, катализируемых ADSS и ADSL. П. фальципарум ADSL был клонирован и экспрессирован в E.coli для кинетического анализа, а кристаллическая структура теперь помогло-состоянию (Джаялакшй и др., 2002; Eaazhisai и др., 2004). Уникальный механизм реакции был недавно описан для этого необходимого фермента паразита (комбинационный и др., 2004). Ориентация либо ADSS или ADSL, или оба, по прогнозам, чтобы полностью истощить P. Falci-parum существенных аденилат нуклеотидов и ингибируют репликацию паразита (рис 18.1C).
18.2.3.4 новой альтернативы пурина п athway в Apicomplexa
Из apicomplexans, рассмотренный в этой главе, только П. фальципарум обладает уникальным альтернативным путем к пуринам через переработку-'-метил-Thiopurines генерируется во время полиаминов метаболизма (Тин и др., 2005) (рис 18.1C). В то время как ранние исследования намекают на существование этого нового пути (Sufrin и др., 1995), недавние исследования помогли проиллюстрировать важную физиологическую роль для пути, и в пробирке исследования подтверждено компоненты пути, чтобы быть наркотиков цели , Это захватывающая и новая область биологии в П. малярийного плазмодия и зр., И потребует дальнейшего детальные исследований для определения физико-логического значения этого недавно описанного путем-путь оптимизации стратегии для разработки лекарственных средств. Ингибирование роста достигается за счет обработки паразитов-инфицированных эритроцитов с immucillins (Kicska и др., 2002a, 2002b) может быть многогранной, поскольку П. фальципарум ПНП играет двойную роль
как в преобразование инозина в гипоксантин, а в утилизации 5'-methylthioinosine к гипо- ксантина (Тин и др., 2005). Таким образом, П. фальципарум имеет новый путь к гипоксантину. Текущие данные свидетельствуют этот новый путь играет важную роль в обмене веществ паразита во время репликации в эритроцитах (Ting и др., 2005).
Пересечение полиаминов и пуринового Metabo-ЛМЗС в П. фальципарум Эритроциты не синтезируют полиамины, П. фальципарум, в отличие от Т. гондий, должен синтезировать свои собственные полиамины. Таким образом, репликация фальципарума П. может быть заблокирована difluo-romethylornithine (DFMO), ингибитор механизма на основе орнитиндекарбоксилазы (ODC), участвующий в превращении орнитин в путресцин в синтезе полиаминов (Muller и др., 2001). Биосинтеза полиаминов путь образует молекулу-'-methylthioadenosine (МТ) на каждый моль-Cule спермидина, или спермина, то есть СЕНТ размера. В организме человека и других организмов, АПС, как правило, возвращают к регенерации как аденин и метионин бассейны.
Удивительно, но гены, связанные с пуринового спасанием (Aprt) и утилизации MTA в метионин бассейне отсутствуют в геноме P. фальципарум (Гарднер и др, 2002а, 2002b;.. Chaudhary и др, 2004). Тем не менее, П. фальципарум ААР было недавно обнаружено, чтобы иметь новую способность распознавать MTA в качестве субстрата и преобразовать MTA до 5'-methylthioinosine (MTI) (Тины и др., 2005). Кроме того, П. фальципарум ПНП было обнаружено, обладают уникальной способностью распознавать MTI в качестве субстрата и конвертировать MTI в гипоксантин. Этот новый путь был доказан, чтобы быть функциональным, когда exoge-изуча- лося поставляется MTI был включен в P. тропических нуклеиновые кислоты (Тины и др., 2005). Таким образом, уникальные субстратные свойства P. фальципарум ADA и PNP содержат новую мету-Болич пути от МТА MTI к гипоксантину для селективной утилизации пуринов из polyaminine биосинтеза (рис 18.1C).
Ранние исследования показали, что П. фальципарум выражены очень обильные уровни ADA, PnP, и HXGPRT по сравнению с соответствующей деятельностью, присутствующих в принимающей эритроцита, следовательно, указывает на потенциально важную вторичную роль

482 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
за их роли в нормальных путях пуриновых (Reyes и др., 1982). Несмотря на то, П. фальципарум растет нормально в PNP- и ААР-дефицитных эритроцитов принимающих (Daddona и др., 1984, 1986), ингибиторы паразита и хозяина АДА, такие как coformycin, deoxyco-formycin и L-рибозил аналогов coformycins блок P. фальципарум репликации (Daddona и др, 1984;.. Геро и др, 2003). Селективное ингибирование P. фальципарум ПНФ, но не пройдет ПНФ, с МТ-immucillin-Н блокировали репликацию паразита почти столь же эффективно, как immucillin-H (Ting и др., 2005).
Эффективность МТ-immucillin-H против малярии указывает на то, что P. фальципарум ПНП является критическим активность паразита. Это маловероятно, что МТ-immucillin-Н ингибирует полиамин путь пути ингибирования продукции на MTA, так как П. фальципарум АД преобразует MTA в MTI (рис 18.1C) и, что существенно, экзогенно гипоксантин обращает ингибирование ин витро, достигнутое обработка с МТ-immucillin-H или immucillin-H (Kicska и др, 2002b;.. Ting и соавт, 2005). Эти наблюдения указывают на то, что хозяин бассейна (или поток) в одиночку гипоксантин, вероятно, будет недостаточно для поддержания роста паразита в процессе культивирования в пробирке. Таким образом, узел инозин бассейн, хозяин аденозин бассейн или hypoxan-твой восстанавливается в новой рециркуляции пурина пути-дороге, вероятно, будет необходимо для нормальной репликации P. малярийного (рис 18.1C).
Утилизация и / или спасательные? Ключевой вопрос остается-ки на который нужно ответить, играет ли роман путь утилизации пуриновых в П. малярийного любую непосредственную роль в пуринов спасанию. Экзогенно MTI транспортируется П. малярийного и включены в паразита нуклеиновых кислот (рис 18.1C) (Тин и др., 2005). Любые поставки хост MTA транспортируют P. малярийного можно было бы спасти, чтобы hypoxan-Твое и включены в пул нуклеотидов IMP (рис 18.1C). МТА может представлять собой источник сущеста-косяк пуринов для P. фальципарума, если МТ в изобилии в эритроцитах и паразит имеет транспортер, способный красть эту молекулу из
хост цитозол / паразитофорное вакуоль пространство. С другой стороны, это также вероятно, что П. фальципарум может либо секретирует ADA в эритроцитах цитозол или паразитофорную вакуоля пространство для преобразования хоста-АПСА в MTI, или секретирует ПНФ в эритроцитах цитозол или паразитофорную вакуоля пространство для преобразования хоста MTI в гипоксантине. Оба из этих стратегий может увеличить поставки пуринов П. фальципарум, потому что оба MTI и гипоксантин транспортируются и включены в паразита нуклеиновых кислот (рис 18.1C) (Ting и др., 2005). Таким образом, исследования локализации П. Falci-parum АДА и ПНП в пораженных эритроцитов, а также возможностей MTI и MTA транс-порта, необходимо полностью решить основную Phys-iological функции этого нового пути.
18.2.3.5 Источником полиаминов в Apicomplexa
малярийный плазмодий Принимающие Эритроциты не синтезируют полиамины. В отличие от этого, рост П. фальципарум в пробирке эффективно блокируется ингибитором ОДК DFMO (Muller и др., 2001). ODC катализирует превращение орнитина в путресцина на первой стадии в синтезе спермидин и спермин (Tabor и Tabor, 1985). Включение радиоактивно глутамина в орнитин бассейна в П. малярийного было незначительным, что свидетельствует о том, что паразит обладает еще один важным маршрутом, чтобы приобрести или синтезировать орнитин (Gafan и др., 2001). В организмах, которые синтезируют полиамины, другие основные маршруты через ферментов для аргиназы и ODC, или аргинин декарбоксилазы (превращения аргинина в Agmatine) и агматиназой. Аргиназы непосредственно преобразует аргинин в орнитин, в то время как агматиназа обходит орнитин полностью CON-инвертирующий агматин к путресцину (Wu и Morris, 1998).
A П. фальципарум ген аргиназы был клонирован и рекомбинантный фермент, при экспрессии обладает активностью аргиназы без заметной агматиназы активности (Мюллер и др., 2005). Как обсуждалось в разделах 18.3 и 18.4 (пиримидинов и аминокислоты), все apicomplexan паразитов не способны де ново синтеза аргинина и, следовательно, должны приобрести аргинин от хоста.

| пуринов | 483 |
Аргинин взято от хоста П. малярийного используются в синтезе белка, а также биосинтез полиаминов. Простейшим паразитом Leishmania зр. также использует аргиназную активность, которая необходима для биосинтеза полиаминов (Satriano, 2003; Roberts и др., 2004).
Чувствительность P.falciparum к ДФМО предполагает, что ODC активность имеет важное значение. П. фальципарум имеет новый ODC активность, которая существует в виде bifunc-ционных фермента с S-аденозилметионин decar-boxylase. Этот бифункциональный фермент обеспечивает хорошо сбалансированный синтез путресцина из орнитина без вовлечения взаимодействий домен-домен (Krause и др., 2000;. Мюллер и др., 2000; Wrenger и др, 2001; Birkholtz и др., 2004). Путресцин и deoxyadenosylmethionine объединены спермидин-синтазы, создавая одну молекулы спермидина и молекулу MTA, который рециркулирует на MTI АДА, а затем к гипоксантину с помощью ПНФА (рис 18.1C) (Muller и др., 2000; Chaudhary, 2005;. Тины и соавт, 2005). П. фальципарум также транспортирует хозяин spermi-дину (Muller и др., 2001). Нет P.
Cryptosporidium parvum В отличие от П. фальципарум, культуры C.parvum, как представляется, biosynthesize полиамины от пути преимущественно бактерий, присутствующих в и растений, связанных с аргинином decar-boxylase и агматиназу (Yarlett и др., 1996). На основе экстраординарных транспортных мощностей культуры C.parvum, также вероятно, что этот паразит может также транспортировать путресцин или другие полиамин из богатой среды кишечника человека. АЦП культуры C.parvum активность ингибируется difluoromethylargi девять, и не зависит от DFMO (Keithly и др., 1997). Так как культуры C.parvum отсутствует какой-либо ген ортолог или активность для ПНФА (рис 18.1B), этот паразит-инк pable утилизации 5'-methylthiopurines обратно в паразит пуринов бассейна.
токсоплазма Происхождение полиаминов в Т. гондий четко не решен в это время, хотя вес текущих данных свидетельствует о том, что этот паразит ауксотрофная для полиаминов и должны обитать клетки-хозяева, которые могут поставлять полиамины.
Паразита, как представляется, транспортеры, способные транспортировать орнитин, путресцина, или другие полиамины (Chaudhary, 2005). Т. гондий, как представляется, не хватает ODC активности (Seabra и др., 2004), а также рост тахизоитов не зависит от ДФМО (Chaudhary и др., 2006).
Генома Т. гондий действительно показывает наличие гена ортолога с гомологией к АЦП / ODC семейства генов (Киссинджер и др., 2003). Если функциональные, этот ген ортолог будет представлять собой потенциальный АЦП, основанный на отсутствии чувствительности к ДФМ. В настоящее время нет гену ортолог не может быть идентифицирован для члена семейства генов, связанной аргиназа / агматиназы, или любого другого элемента гена в пути биосинтеза полиаминов (Чаудхарьте, 2005). В совокупности эти данные свидетельствуют о том, что Т. гондий не в состоянии биосинтеза полиаминов, и, скорее всего, полагается на прямой транспортировки и спасение предварительно сформированных полиаминов, поставляемых клеткой-хозяином. Отсутствие какого-либо гена ортолога для спермидина-синтазы или спермина-синтазы предполагает, что паразит не производит MTA. Даже в маловероятном случае, что МТ или MTI присутствовал в
T. гондий, 5'-methylthiopurines не может быть переработана в паразит пуринового пула. Т. гондий ПНП не может использовать MTI в качестве действительного субстрата (рис 18.1A) (Chaudhary и др., 2006).
Адаптация полиаминов и пуриновых пути в Apicomplexa Селективная адаптация П. фальципарум ADA и PNP ферментов, чтобы переработать-'-methylthiopurines к гипоксантину может возникнуть в ответ на потерю активности АК (Тины и др., 2005). Потенциал поток пурина отражаются как требованиями паразита и ограничениями пуриновых принимающего эритроцита. Репликация П. малярийный происходит путем шизогонии, где репликация ДНК и ядерное деление координируются в узком окне времени. Шизогония, где многие дочерние ядра быстро формируется, может потребовать повышенное требование для потока пуринового в П. фальципарум. В противоположность этому, Т. гондий реплицируется по endodyogeny и создание дочери паразитов примерно каждые 7 часов. Endodyogeny, где дочернее ядро образуется из одного материнского ядра, может по своей природе требует более низкий потока пуринов поддерживать репликацию.

484 СРАВНИТЕЛЬНЫЕ АСПЕКТЫ нуклеотидных и аминокислотного метаболизма в токсоплазма
Пиримидинов

Пиримидины являются важными компонентами нуклеиновых кислот, а также участвуют в других аспектах клеточного метаболизма, а также. Большинство apicomplexan паразиты сохранили способность к De Novo синтеза молекулы родительского пиримидина, уридин 5'монофосфата (УМФ). В apicomplexan паразиты, которые полагаются на De Novo синтетического пути-пути, таким образом, зависит от соответствующего источника молекул-предшественников для биосинтеза пиримидинов. Эти молекулы-предшественники включают небольшие молекулы, такие как бикарбонат, аминокислоты, и пуриновых нуклеотидов. Следовательно, получение аминокислот и удовлетворяющей пуриновый auxotro-PHY из apicomplexan паразитов необходимо для биосинтеза пиримидинов.
Большинство apicomplexans, в том числе Т. гондия и П. малярийного, имеет функциональные пути для де Novo синтеза пиримидинов. Т. гондий необычен в также обладающем пиримидине спасательной деятельности. Тем не менее, путь биосинтеза пиримидина имеет важное значение для репликации как Т. гондия и П. фальципарум. Некоторые apicomplexans, такие как культуры C.parvum, потеряли способность синтезировать UMP по пути De Novo, и полностью полагаться на гаражи пути приобрести необходимые пиримидины от хоста. В этих apicomplexans, приобретение -пиримидина-idines полностью зависит от транспорта и спасания преформированного pyrmidine нуклеотидных и нуклеозидов от хоста. Культуры C.parvum, однозначно, приобрела несколько видов деятельности пиримидина спасанию не наблюдается в других apicomplexan паразита.
Относительно мало экспериментальных работы были выполнены на соответствующие транспортных путях, необходимых для биосинтеза пиримидинов, или отношений и кросс-регуляторных разговоров могут произойти между пиримидиновыми и пуриновыми путями. Интересно, что пиримидин голодание является одним из триггеров, используемых экспериментально индуцировать в пробирке стадии дифференцировки у Т. гондий от тахизоят к этапам брадизоитных (Bohne и Roos, 1997; Русо и др., 1997). Недавние исследования прояснили функциональную организацию пиримидинового обмена в Apicomplexa, и выявили новые стратегии для целевых
существенные пиримидиновые пути приобретения в apicomplexan паразитов.
Дата: 2019-05-28, просмотров: 291.