Креатинкиназа принимает участие в образовании и расщеплении энергии. Таким образом данному ферменту отводится работа посредника, который в тканях обеспечивает участки энергией там, где это требуется в большей степени. В теле человека максимальное потребление энергии демонстрируется мышцами.
У пациента, находящегося в коме, в плазме крови увеличена активность креатинкиназы за счёт МВ - фракции.
В чем причина повышения активности данного изофермента в плазме крови?
Разрушение кардиомиоцитах инфаркт миокарда.
Какие изоферменты креатинкиназы присутствуют в человеческом организме?
ВВ, МВ, ММ.
В каких органах локализованы эти изоферменты?
BB - головной мозг, МB - сердечная мышца, MM- скелетные мышцы.
Какую роль играет данный фермент в человеческом организме?
Образование и использование запасного макроэргического соединения креатинфосфата.
Какую реакцию катализирует данный фермент?
Обратимое фосфорилирование креатина.
В составе креатинкиназы присутствует две субъединицы: мышечная и мозговая. Для обозначения их используются буквы М и В. В зависимости от того, как субъединицы скомбинировались, можно выделить три вида КФК: ММ, МВ и ВВ. Под первой понимается расположение в миокарде и скелетных мышцах. Обозначение МВ говорит о расположении в большей части в миокарде. Третий вариант предполагает расположение в головном мозге, простате, мочевыделительной системе. Кроме этого, последний вариант может находиться в новообразованиях. Однако анализ крови при отсутствии патологии, повышение демонстрировать не должен. В организме концентрация должна быть минимальна. Связано это с тем, что фермент не покидает пределов гематоэнцефалического барьера.
Таким образом, при лабораторном исследовании общей активности фермента, который мы по привычке продолжаем называть КФК, подразумевают активность каждого из изоэнзимов, выделяемых в кровь из мышцы сердца (2%) и скелетной мускулатуры (98%).
Трудно переоценить значение такого лабораторного показателя, как изофермент КК-МВ или МВ-фракция. Активность общей креатинкиназы, конечно, очень информативный анализ, но она складывается из увеличения активности других изоферментов, то есть, с большой долей вероятности можно утверждать о наличии инфаркта, но полное убеждение в том, что это именно ИМ, даст только активность (или содержание) МВ-фракции.
В норме значения этого показателя не могут превышать 10 U/l (содержание — менее 10 мг/л), вернее, они должны быть ниже. Но все дело в том, что тест-набор для КК-МВ имеют не все лаборатории, например, в районной больнице, которая не располагает специализированным отделением (кардиологическим), реактивы просто нецелесообразно держать, а в поликлинике – тем более. Этот анализ делают пациентам с инфарктом, а человека с подозрением на острую сердечную патологию «скорая» стремится как можно быстрее доставить в кардиологическую клинику или отделение.
Повышена активность МВ-фракции:
При инфаркте миокарда: рост начинается через 4 – 6 часов от приступа, максимум наблюдается через 18 – 30 часов возвращение в норму (если все благополучно) на 3 сутки;
При наследственной нервно-мышечной патологии, называемой кардиомиодистрофией Дюшенна, которая протекает с прогрессирующим поражением поперечнополосатой мускулатуры.
Исследование изоэнзима креатинкиназы сердечной мышцы ценно не только для диагностики поражения миокарда, немалую роль играет КК-МВ в плане наблюдения за состоянием пациента.
Кроме инфаркта миокарда, для которого креатинфосфокиназа является ранним маркером поражения сердечной мышцы (повышается в 10 – 30 раз в первые часы и достигает максимума через 20 – 30 часов), увеличение активности фермента наблюдается в ряде других патологических состояний:
1. Все типы мышечных дистрофий;
2. Полимиозит, вирусный миозит;
3. Травматическое повреждение мышечного аппарата (синдром длительного сдавления или краш-синдром);
4. Обширные хирургические операции (послеоперационный период);
5. Состояние гиперметаболизма скелетных мышц, называемое злокачественной гипертермией (острое фульминантное состояние). Эта патология развивается в ходе проведения общей анестезии для оперативного вмешательства и может представлять собой угрозу жизни пациента;
6. Черепно-мозговые травмы, ушиб мозга;
7. Сосудистая патология головного мозга;
8. Инсульт (цереброваскулярная ишемия);
9. Ревмокардит;
10. Нарушение ритма при сердечной недостаточности (застойной);
11. ТЭЛА (повышение активности креатинкиназы отмечается сравнительно редко);
12. Поражение сердечной мышцы при гипоксии (шок, гипертермия);
13. Значительная нагрузка на мышечный аппарат (бег, силовые виды спорта, профессиональная деятельность);
14. Инъекции некоторых лекарственных препаратов в мышцу (наркотики, ненаркотические анальгетики, отдельные антибиотики, седативные и психотропные);
15. Феномен Рейно;
16. Отравление стрихнином;
17. Нарушение кровообращения и трофики, приводящее к развитию некроза (пролежни) – проблемы ослабленных лежачих пациентов;
18. Спазмы скелетной мускулатуры;
19. Острая алкогольная интоксикация;
20. Психическая патология (эпилепсия, маниакально-депрессивный синдром, шизофрения);
21. Воздействие радиоактивного излучения с развитием острой лучевой болезни;
22. Патология щитовидный железы со снижением ее функции (гипотиреоз);
23. Злокачественные новообразования, локализованные в матке, кишечнике, мочевом пузыре и других органах.
Учитывая, что тироксин (гормон щитовидной железы) ингибирует активность креатинкиназы, у больных, имеющих патологию ЩЖ со снижением функции, активность фермента может повышаться до 50 раз, в то время как усиленная работа «щитовидки», наоборот, снижает активность КФК.
Не повышается креатинкиназа при стенокардии и практически не реагирует этот фермент на страдания печени и легких, даже если клетки этих органов по каким-либо причинам, кроме злокачественных опухолей, начнут усиленно разрушаться.
51. Тучный мужчина 45 лет обратился с жалобами на периодические боли в области сердца и одышку. Анализ липидов плазмы крови натощак показал: содержание общего холестерола - 6,5 ммоль/л, холестерола ЛВП -- 1,4 ммоль/л, ТАГ - 8 ммоль/л (норма - 1,5 - 2,5 ммоль/л). Для какой патологии характерны данные признаки?
ОТВЕТ: АТЕРОСКЛЕРОЗ. (отвечает Мавджуда) смотрим 17 вопрос!!!
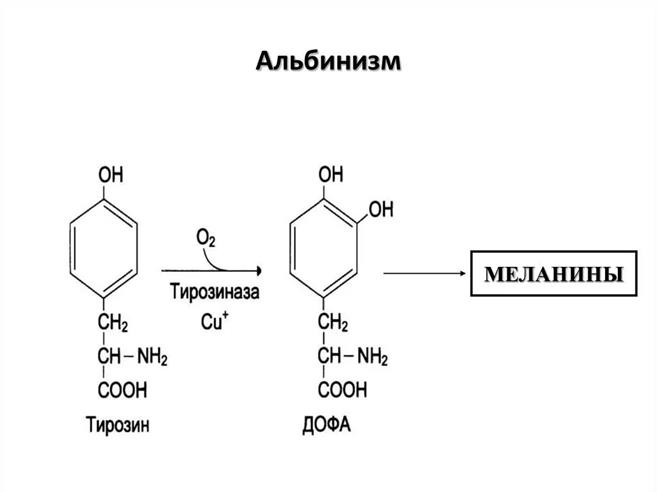
52. У пациента отсутствуют механизмы защиты от ультрафиолетовых лучей, он быстро получает солнечные ожоги, загар - не появляется. Какое это заболевание? Укажите его причины. а) Назовите синтез какого вещества нарушен в организме этих людей. б) Напишите схему его образования в норме. в) Назовите фермент, дефект которого вызывает перечисленные симптомы
Альбинизм — врождённое рецессивно-наследуемое отсутствие пигмента меланина (у животных) или хлорофилла (у растений), фенотипически проявляющийся отсутствием присущей для данного вида окраски кожи, волос, шерсти, радужной и пигментной оболочек глаз, зелёных частей растений
В настоящее время считается, что причиной альбинизма является отсутствие (или блокада) фермента тирозиназы, необходимой для нормального синтеза меланина — особого вещества, от которого зависит окраска тканей
В генах, ответственных за образование тирозиназы, могут возникать самые различные нарушения. От характера нарушения зависит степень недостатка пигмента у людей с альбинизмом. У некоторых людей, страдающих данным расстройством, с образованием тирозиназы всё обстоит благополучно, и учёные предполагают, что в подобных случаях, возможно, происходит мутация генов, регулирующих образование другого важного для обмена меланина энзима.
У человека тирозиназа (медьсодержащая оксидаза) активирует процесс гидроксилирования тирозина в ДОФА и дофхинон. Ионы цинка активируют превращение дофахрома в 5,6-гидроксиндол, а меланосомы содержат цинк в высокой концентрации.
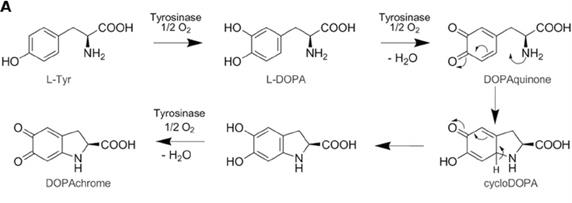
Тирозиназа (монофенол L-ДОФА; окислительная оксидоредуктаза ; E.C.1.14.18.1 ) играет ключевую роль при синтезе меланина в меланоцитах ( Prota G.,1980). Она катализирует три реакции в цепи биосинтеза ммеланина:
1) гидроксилирование l-тирозина, т.е. превращение тирозина в 3,4-диоксифенилаланин (ДОФА, dopa)
2) окисление ДОФА в ДОФА-хинон;
3) окисление 5,6-диоксииндола в индол-5,6-хинон
Дофахинон в меланоцитах переходит в эумеланин путем последовательных спонтанных (неэнзиматических) реакций, включая циклизацию и окислительную полимеризацию. На ранних стадиях дофахинон проходит внутримолекулярную циклизацию, при которой аминогруппы образуют систему хинона, формируя лейкодопахинон, который окисляется до допохрома (Raper красный компонент). Допахром при физиологических условиях проходит реорганизацию и путем декарбоксилирования превращается в 5,6-дигидрохиндол и 5,6- дигидрохиндол-2-карбоксиловую кислоту. Синтезируемые соединения включаются в высокомолекулярный полимер эумеланин.
Для переключения синтеза с эумеланина на феомеланин в меланоцитах необходимо наличие цистеина, содержащего реактивные сульфгидрильные группы, которые реагируя с допахиноном, образуют цистеинилдопа продукты
представлены метаболические пути ведущие к формированию эумеланин а и феомеланин а. Оба цикла начинаются с энзиматического превращения тирозина в дофа и дофахинон. Последующие пути зависят от биохимической среды пигментной клетки, которая находится под генетическим контролем.
В эумеланин-формирующих меланоцитах дофахинон проходит классический путь меланогенеза, результатом которого является образование черного нерастворимого гетерополимера путем окислительного связывания различных индольных продуктов. В феомеланин-формирующих меланоцитах переключение цикла приводит к образованию сульфгидрильного пигмента через SH-содержащие компоненты, такие как цистеин. Цистеин реагирует с дофахином неэнзиматически, формируя цистеинилдофа, который легко превращается в бензотриазин путем окислительной циклизации цистеинильных остатков.
Он представляет собой два катиона меди, каждый из которых ориентирован с помощью трёх гистидиновых остатков. Активный центр этого фермента очень похож на активный центр гемоцианина как по структуре, так и по свойствам. Эти два вещества, по-видимому, имеют общее происхождение. Активный центр тирозиназы способен захватывать одну молекулу кислорода, которая затем используется для окисления субстрата[2][3].
Тирозиназа человека представляет собой трансмембранный белок, расположенный в мембранах меланоцитов. Большая часть молекулы тирозиназы, включая её активный центр, находится внутри меланосомы, и лишь небольшая часть расположена вне меланосомы, в цитоплазме меланоцита[4][5].
Дата: 2019-05-28, просмотров: 1032.