1) Физическое тепло жидкого металла определяется из выражения (38)
Известно: GМ = 90,67 кг (см. п.13.6).
Тогда QМ = (54,8 + 0,84 × tМ) × 90,67 = 4969 + 76,164 × tМ.
2) Физическое тепло шлака определяется из выражения (39)
Известно: GШ = 12,576 кг (см. таблица 23).
Тогда QШ = (2,09 × tМ – 1379) × 12,576 = 26,284 × tМ – 17343.
3) Физическое тепло отходящих газов определяется из выражения (40)
Известно: GСО = 6,447 кг; GСО2 = 2,677кг (см. таблицу 24).
Принимаем tГ = 2000 ˚С.
Тогда QГ = (1,32 × 2000 – 220) × (6,447 + 2,677) = 22081,1 кДж.
4) Затраты тепла на разложение оксидов железа неметаллических материалов определяется из выражения (41). Для расчета учитывают только оксиды железа, поступающие в конвертер с неметаллическими материалами (см. таблицу 23):
QFe = 3707 × 0,037 + 5278 × 0,457 = 2548,7 кДж.
5) Потери тепла с выносами и выбросам определяется из выражения (42)
Известно: GВ = 1,0 кг. Принимаем tМС = 1550 ˚С.
Тогда QВ = (54,8 + 0,84 × 1550) × 1,0 = 1356,8 кДж.
6) Затраты тепла на пылеобразование определяется из выражения (43)
Известно: GП = 0,913 кг (см. п.13.6).
Тогда QД = (54,8 + 0,84 × 2000) × 0,913 = 1583,7 кДж.
7) Тепло на разложение карбонатов определяется из выражения (44)
Известно: GИК = 0,301 кг (см. таблицу 24).
Тогда QК = 4038 × 0,301 = 1214,6 кДж.
8) Тепловые потери определяются из выражения (45). Приняв величину тепловых потерь равной 3% от прихода тепла получим: QП = 191037 × 3 / 100 = 5731,1 кДж.
Общий расход тепла составит
4969 + 76,164 × tМ + 26,284 × tМ – 17343 + 22081 + 2549 + 1357 + 1584 +
+ 1215 + 5371 = 22142 + 102,448× tМ.
Приравняв приходную и расходную части теплового баланса, определим температуру жидкого металла в конце продувки.
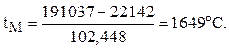
Определим величину перегрева металла над температурой начала затвердевания из выражения (1)
TПЕР = 1649 – 1530 = 119 ˚С.
Полученная величина перегрева находится в рекомендованном интервале: 100-120 ˚С (см. таблицу 1).
Составим тепловой баланс плавки в конверторе (таблица 26).
Таблица 26 – Тепловой баланс плавки в конвертере с верхней продувкой
| Приход тепла | Расход тепла | ||||
| Статьи прихода | Количество | Статьи расхода | Количество | ||
| кДж | % | кДж | % | ||
| Физическое тепло жидкого чугуна | 97978 | 51,3 | Физическое тепло жидкого металла | 130532 | 68,3 |
| Тепловой эффект реакций окисления | 69467 | 36,4 | Физическое тепло шлака | 25989 | 13,6 |
| Химическое тепло образования оксидов железа шлака | 16499 | 8,6 | Затраты тепла на разложение оксидов железа неметаллических материалов | 2549 | 1,3 |
| Тепловой эффект реакций шлакообразования | 5647 | 3,0 | Физическое тепло отходящих газов | 22081 | 11,6 |
| Тепло дожигания СО | 1447 | 0,8 | Потери тепла с выносами и выбросами | 1357 | 0,7 |
| Затраты тепла на пылеобразование | 1584 | 0,8 | |||
| Тепло на разложение карбонатов | 1215 | 0,6 | |||
| Тепловые потери | 5731 | 3,0 | |||
| Итого | 191037 | 100 | Итого | 188981 | 100 |
Невязка баланса составляет 100 ·(191037-188981)/191037 = 1,08 %, что находится в допустимых пределах (1-2 %)
13.8 Расчет раскисления стали и ее химического состава
В соответствии с рекомендациями, изложенными в п. 10, раскисление стали марки 10 будем вести в ковше ферромарганцем, ферросилицием и алюминием, составы которых приведены в таблице 27.
Таблица 27 - Химический состав применяемых раскислителей
| Материал - раскислитель | Химический состав, % | ||||
| C | Mn | Si | P | S | |
| Ферромарганец ФМн75 | 7,0 | 75,0 | 2,0 | 0,45 | 0,03 |
| Ферросилиций ФС75 | - | 0,3 | 75,0 | 0,05 | 0,03 |
| Алюминий А5* | 0 | 0,03 | 0,3 | 0 | 0 |
* - содержание алюминия 99,5 %.
Определим расход ферромарганца. Известно: GМ = 90,67 кг; [Mn]М = 0,048 кг (см. таблицу 21); [Mn]ФМ = 75,0%. Принимаем: [Mn]С = 0,5% (см. таблицу 18); UMn = 30% (см. таблицу 15). Тогда
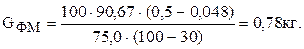
При раскислении ферромарганцем масса жидкой стали увеличивается. Это увеличение необходимо учитывать при расчете расхода ферросилиция. Увеличение массы металла почти в точности равно массе ферромарганца, так как частичный угар марганца компенсируется поступлением в металл примерно такого же количества железа из шлака.
Следовательно, масса металла после раскисления ферромарганцем составит:
90,67 + 0,78 = 91,45 кг.
Определим расход ферросилиция. Известно: GМ = 91,45 кг; [Si]М = 0,0 кг; [Si]ФС = 75,0%. Принимаем: [Si]С = 0,27% (см. таблицу 18); USi = 35% (см. таблицу 15).
Тогда 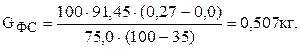
Определение массы и химического состава стали после раскисления, а также массы продуктов раскисления, производится в таблице 28.
Расход алюминия на раскисление выбираем с учетом практических данных в зависимости от содержания углерода перед раскислением (см. таблицу 14). Поскольку [C] = 0,105%, то принимаем расход алюминия марки А5 – 350 г/т стали. При этом поступлением кремния и марганца в металл при введении алюминия пренебрегаем из-за незначительного содержания этих элементов.
Состав металла после раскисления соответствует требованиям, предъявляемым к заданной марке стали 10.
Таблица 28 - Баланс элементов при раскислении стали
| Расчетные показатели | С | Si | Mn | Р | S | Fe | Всего | |||
| оста-ется | окис-ляется до СО | оста-ется | окис-ляется до SiO2 | оста-ется | окис-ляется до MnО | |||||
| Содержится перед раскис-лением, кг | 0,090 | 0,000 | 0,048 | 0,007 | 0,017 | 90,509 | 90,672 | |||
| Вносится ферро-марганцем, кг | 50%* 0,027 | 50%* 0,027 | 65%* 0,010 | 35%* 0,005 | 70%* 0,410 | 30%* 0,176 | 100%* 0,004 | 100%* 0,000 | 100%* 0,121 | 0,572 |
| Вносится ферросилицием, кг | 65%* 0,247 | 35%* 0,133 | 70%* 0,001 | 30%* 0,001 | 100%* 0,001 | 100%* 0,000 | 100%* 0,124 | 0,373 | ||
| Содержится после рас-кисления, кг | 0,117 | 0,247 | 0,459 | 0,011 | 0,017 | 90,755 | 91,606 | |||
| Образуется оксида, кг | 0,027× ×28/12=0,064 | 0,138× ×60/28=0,297 | 0,177× ×71/55==0,227 | Образует-ся после раскис-ления, кг | ||||||
| Состав металла, % | 0,117× ×100/91,606= =0,128 | 0,247× ×100/91,606= =0,270 | 0,459× ×100/91,606= =0,501 | 0,012 | 0,018 | газа | шлака | |||
| 0,064 | 0,524 | |||||||||
* - процент от общего количества элемента в материале.
Дата: 2019-05-28, просмотров: 299.