Пример 6:
В 300 г воды растворено 70 г нитрата натрия. Плотность полученного раствора 1,15 г¤см3. Определить процентную, нормальную и моляльную концентрации растворов.
| Дано: m(H2O) = 300 г m(NaNO3) = 70 г ρ = 1,15 г/см3 | Решение: 1) Процентная концентрация (С%) рассчитывается по формуле:
mраствора - масса раствора, г. В данной задаче растворенным веществом является нитрат натрия, массой 70 г; масса раствора равна сумме масс растворенного вещества и растворителя mраствора = 70 + 300 = 370 г.
2) Нормальная концентрация (Сн) рассчитывается по формуле:
Mэ – эквивалентная масса растворенного вещества, г/моль-экв; V – объем раствора, л. Mэ(NaNO3) = V = ρ· mраствора = 1,15 ·370 =195,5 мл = 0,1955 л
3) Моляльная концентрация (Сm) рассчитывается по формуле
M – молярная масса растворенного вещества, г/моль; mрастворителя - масса растворителя (воды) г.
|
| Найти С% , Cн, Сm |
Ответ: С% = 18,9%, Сн = 4,21 моль-экв/л, Cm = 2,75 моль/кг.
101. Рассчитайте процентную концентрацию и титр гидроксида калия в 330 г раствора с нормальной концентрацией 0,6 моль-экв/дм3 (ρ = 1,012 г/см3).
102. Рассчитать объем 20% раствора серной кислоты (r = 1,139 г¤ cм3) необходимый для приготовления 300 см3 раствора H2SO4 с нормальной концентрацией 0,1 моль-экв/дм3. Определить титр раствора.
103. Определить процентную концентрацию и моляльную концентрацию раствора сульфита натрия с нормальной концентрацией 2 моль-экв/дм3 и плотность 1,09 г/см3.
104. Определить, какую массу раствора гидроксида бария нормальной концентрацией 1,2 моль-экв/дм3 (r = 1,089 г¤см3) можно получить при растворении 122 г основания в воде. Рассчитайте процентную и моляльную концентрацию раствора.
105. Определить, какую массу соли необходимо взять, чтобы приготовить 500 см 3 раствора сульфата натрия, нормальная концентрация которого 0,6 моль-экв/дм3. Рассчитайте процентную концентрацию и титр полученного раствора (ρ = 1,060 г/см3).
106. Определить массу соли, которая содержится в 700 см3 0,5 нормального раствора сульфата магния. Рассчитайте процентную концентрацию и титр раствора (ρ = 1,12 г/см3).
107. В 200 г воды растворено 45 г карбоната натрия. Плотность полученного раствора 1,09 г¤см3. Определить процентную, нормальную и моляльную концентрации растворов.
108. Сколько нитрата хрома (III) и воды (в граммах) необходимо взять, чтобы приготовить 350 г 13%-ного раствора. Рассчитайте нормальную концентрацию и титр раствора (ρ = 1,21 г/см3).
109. Рассчитайте процентную концентрацию и титр фосфата калия в 620 г раствора с нормальной концентрацией 0,3 моль-экв/дм3 (ρ = 1,06 г/см3)
110. Определить процентную и моляльную концентрацию нитрита никеля (II) в растворе, нормальная концентрация которого 0,8 моль-экв/дм3 и плотность 1,11 г/см3
111. Определить, какую массу раствора нитрита магния с нормальной концентрацией 0,7 моль-экв/дм3 (r = 1,13 г¤см3) можно получить при растворении 82 г соли в воде. Рассчитайте процентную концентрацию и титр раствора.
112. Определить какую массу соли необходимо взять, чтобы приготовить 450 см 3 раствора хлорида железа (III), нормальная концентрация которого 0,4 моль-экв/дм3. Рассчитайте процентную и моляльную концентрацию полученного раствора (ρ = 1,18 г/см3).
113. Определить массу соли, которая содержится в 1200 см3 0,3 нормального раствора нитрата цинка. Рассчитайте процентную концентрацию и титр раствора (ρ = 1,12 г/см3).
114. В 800 г воды растворено 111 г бромида алюминия. Плотность полученного раствора 1,31 г¤см3. Определить процентную, нормальную и моляльную концентрации растворов.
115. Сколько йодида бериллия и воды (в граммах) необходимо взять, чтобы приготовить 1100 см3 5%-ного раствора. Рассчитайте нормальную концентрацию и титр раствора (ρ = 1,08 г/см3).
116. Рассчитайте процентную концентрацию и титр раствора серной кислоты объемом 550 см3 раствора с нормальной концентрацией 0,15 моль-экв/дм3 (ρ = 1,03 г/см3).
117. Определить процентную и моляльную концентрацию гидрокарбоната калия в растворе, нормальная концентрация которого 0,9 моль-экв/дм3 и плотность 1,02 г/см3.
118. Определить какую массу раствора гидроксида натрия нормальной концентрацией 2,5 моль-экв/дм3 (r = 1,23 г¤см3) можно получить при растворении 95 г щелочи в воде. Рассчитайте процентную концентрацию и титр раствора.
119. Определить какую массу соли необходимо взять, чтобы приготовить 900 см3 раствора фторида кальция, нормальная концентрация которого 1,2 моль-экв/дм3. Рассчитайте процентную и моляльную концентрацию полученного раствора (ρ = 1,25 г/см3).
120. Определить массу соли, которая содержится в 1300 см3 0,8 нормального раствора нитрата серебра. Рассчитайте процентную концентрацию и титр раствора (ρ = 1,29 г/см3).
Тема 7. Свойства растворов.
Пример 7:
Вычислить температуру замерзания раствора, содержащего 9,0 г глюкозы С6Н12О6 в 100 г воды. Криоскопическая константа воды -1,86.
Решение:
| Дано: m(С6Н12О6) = 9,0 г. m(Н2О) = 100 г. Ккр = 1,86 | Решение:
mр-ля – масса растворителя (воды), г; M – молярная масса растворенного вещества, г/моль.
M (С6Н12О6) = 6·12 + 12·1 + 6·16 = 180 г/моль Подставив числа в формулу, рассчитаем изменение температуры замерзания:
Вычитая 0,93 из температуры замерзания воды, находим понижение температуры замерзания раствора: |
| Найти tзам |
Ответ: tзам = -0,93°С
121. Вычислите массу глицерина С3Н5(ОН)3, растворенного в воде, зная, что этот раствор кипит при 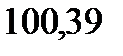
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 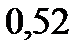
 .
.
122. Раствор, содержащий 55,4 г неэлектролита в воде объемом 2,5 л, кипит при 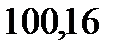
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 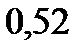
 . Вычислите молекулярную массу неэлектролита.
. Вычислите молекулярную массу неэлектролита.
123. Вычислите молекулярную массу вещества, зная, что раствор, содержащий 0,04 г этого вещества и бензола массой 20 г, кристаллизуется при температуре на 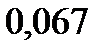
 ниже, чем чистый бензол. Криоскопическая константа бензола
ниже, чем чистый бензол. Криоскопическая константа бензола 
 .
.
124. Для раствора, состоящего из 0,94 г неэлектролита и 50 г этилового спирта, повышение температуры кипения составляет 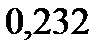
 . Эбуллиоскопическая константа этилового спирта
. Эбуллиоскопическая константа этилового спирта 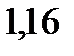
 . Вычислите молярную массу растворенноговещества.
. Вычислите молярную массу растворенноговещества.
125. При растворении некотороговещества массой 15 г в диэтиловом эфире массой 400 г температура кипения последнего повысилась на 
 . Вычислите значения молярной массы для растворенного вещества. Эбуллиоскопическая константа эфира
. Вычислите значения молярной массы для растворенного вещества. Эбуллиоскопическая константа эфира 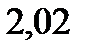
 .
.
126. При какой температуре должен кипеть раствор, содержащий растворенный неэлектролит количеством вещества 0,062 моль в воде объемом 200 мл?
127. Раствор, содержащий фосфор и бензол, масса которых соответственно равна 0,1155 и 19,03 г, замерзает при 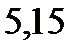
 . Чистый бензол замерзает при
. Чистый бензол замерзает при 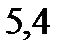
 . Криоскопическая константа для бензола
. Криоскопическая константа для бензола 
 . Найдите молекулярную формулу фосфора.
. Найдите молекулярную формулу фосфора.
128. Найдите молекулярную формулу серы, зная, что температура кипения чистого бензола на 
 ниже температуры кипения раствора, содержащего серу массой 0,81 г в бензоле массой 100 г. Эбулиоскопическая константа бензола
ниже температуры кипения раствора, содержащего серу массой 0,81 г в бензоле массой 100 г. Эбулиоскопическая константа бензола 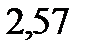
 .
.
129. Раствор, состоящий из 9,2 г иода и 100 метилового спирта, закипает при 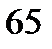
 . Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта
. Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта 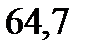
 , а его эбуллиоскопическая константа
, а его эбуллиоскопическая константа 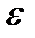 =
= 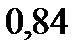
 .
.
130. Раствор, содержащий ацетон массой 100 г и глицерин С3Н8О3 массой 2,67 г кипит при 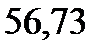
 . Температура кипения ацетона
. Температура кипения ацетона 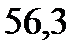
 . Вычислите эбуллиоскопическую константу ацетона.
. Вычислите эбуллиоскопическую константу ацетона.
131. Раствор, содержащий неэлектролит массой 13,8 г в воде объемом 1 л, замерзает при 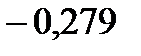
 . Найдите молярную массу неэлектролита. Криоскопическая константа воды
. Найдите молярную массу неэлектролита. Криоскопическая константа воды 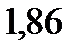
 .
.
132. Раствор, содержащий 1 г растворенного вещества в 50 г воды, замерзает при 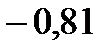
 . Найдите молярную массу растворенного вещества. Криоскопическая константа воды
. Найдите молярную массу растворенного вещества. Криоскопическая константа воды 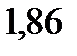
 .
.
133. Насколько градусов понизится температура замерзания, если в бензоле массой 100 г растворить нафталин ( 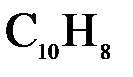 ) массой 4 г. Криоскопическая константа бензола
) массой 4 г. Криоскопическая константа бензола 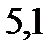
 .
.
134. Насколько градусов повысится температура кипения, если в воде объемом 1 л растворить глюкозу массой 90 г? Эбуллиоскопическая константа воды 
 .
.
135. Какую массу глюкозы 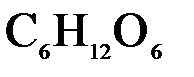 необходимо растворить в воде объемом 100 мл, чтобы температура понизилась на
необходимо растворить в воде объемом 100 мл, чтобы температура понизилась на 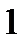
 . Криоскопическая константа воды
. Криоскопическая константа воды 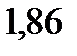
 .
.
136. Какую массу глюкозы 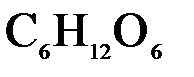 необходимо растворить в 100 мл воды, чтобы температура кипения повысилась на
необходимо растворить в 100 мл воды, чтобы температура кипения повысилась на 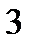
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 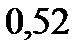
 .
.
137. Вычислите массу метанола СН3ОН растворенного в воде, если температура кристаллизации кэтогораствора 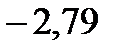
 . Криоскопическая константа воды
. Криоскопическая константа воды 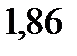
 .
.
138. При какой температуре замерзает раствор, содержащий 14,4 г глюкозы 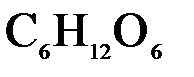 в 200 мл воды. Криоскопическая константа воды
в 200 мл воды. Криоскопическая константа воды 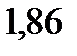
 .
.
139. При какой температуре замерзает раствор, содержащий 3 г мочевины в 200 мл воды. Криоскопическая константа воды 
 .
.
140. При какой температуре кипят и замерзают водные растворы неэлектролитов, моляльность которых равна 1 моль/кг. Криоскопическая константа воды 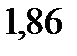
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 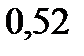
 .
.
Дата: 2019-05-28, просмотров: 623.
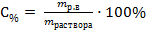 , здесь mр.в.- масса растворенного вещества, г;
, здесь mр.в.- масса растворенного вещества, г;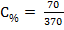 ·100% = 18,9%
·100% = 18,9%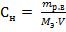 , здесь mр.в.- масса растворенного вещества, г;
, здесь mр.в.- масса растворенного вещества, г;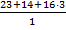 = 85 г/моль-экв.
= 85 г/моль-экв.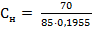 = 4,21 моль-экв/л
= 4,21 моль-экв/л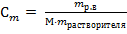 ·1000 здесь mр.в.- масса растворенного вещества, г;
·1000 здесь mр.в.- масса растворенного вещества, г;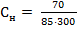 ·1000 = 2,75 моль/кг
·1000 = 2,75 моль/кг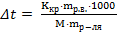 ,где mрв – масса растворенного вещества (глюкозы), г;
,где mрв – масса растворенного вещества (глюкозы), г;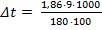 = 0,93°С
= 0,93°С