Тема 1. Количество вещества. Эквивалент. Эквивалентная масса.
Пример 1:
Рассчитать эквивалент и эквивалентную массу указанных веществ: Сr2O3, H2SO4, Na3PO4. Определить число молей, содержащихся в 80 г каждого вещества.
Решение:
Сr2O3 – оксид, эквивалент и эквивалентная масса оксида рассчитываются по формулам:
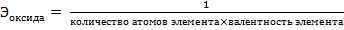 ,
,
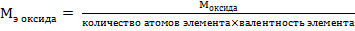 или
или 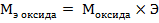
Количество атомов хрома – 2, валентность – III, M(Сr2O3) = 52·2+16·3 = 152 г/моль, отсюда следует:
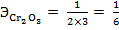 ,
, 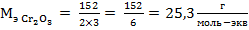
Н2SO4 – кислота, эквивалент и эквивалентная масса кислоты рассчитываются по формулам:
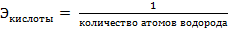 ,
,
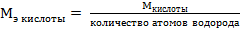 или
или 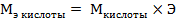
Количество атомов водорода – 2, M(Н2SO4) = 1·2+32+16·4 = 98 г/моль отсюда, следует:
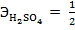 ,
, 
Na3PO4 – соль, эквивалент и эквивалентная масса соли рассчитываются по формулам:
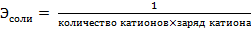 ,
,
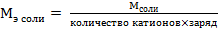 или
или 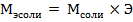
Количество катионов Na+ – 3, заряд катиона 1, M(Na3PO4) = 23·3+31+16·4 = 141 г/моль, отсюда следует:
 ,
, 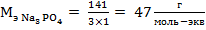
Число молей любого вещества рассчитывается по формуле: 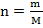 , где m – масса вещества, г; M – молярная масса вещества, г/моль. По условию задачи массы веществ равны 80 г, молярные массы рассчитаны выше, отсюда следует:
, где m – масса вещества, г; M – молярная масса вещества, г/моль. По условию задачи массы веществ равны 80 г, молярные массы рассчитаны выше, отсюда следует:
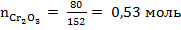 ,
, 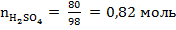 ,
, 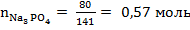
1. Рассчитать эквивалент и эквивалентную массу указанных веществ: SO3, Fe(OH)3, Na2Cr2O7. Определить число молей, содержащихся в 80 г каждого вещества.
2. Рассчитать эквивалент и эквивалентную массу указанных веществ: Cr2O3, H3AsO3, K2MnO4. Определите массу 1,8 моль каждого вещества.
3. Рассчитать эквивалент и эквивалентную массу указанных веществ. I2O5, HCNS, Mg3(PO4)2. Определить число молей, содержащихся в 150 г каждого вещества.
4. Рассчитать эквивалент и эквивалентную массу указанных веществ. SiO2, H2CO3, NH4Cl.. Определите массу 1,6 моль каждого вещества.
5. Рассчитать эквивалент и эквивалентную массу указанных веществ. Cl2O7, H3BO3, Pb(NO3)2. Определить число молей, содержащихся в 320 г каждого вещества.
6. Рассчитать эквивалент и эквивалентную массу указанных веществ. CO2, Cu(OH)2, BaCO3. Определите массу 0,9 моль каждого вещества.
7. Рассчитать эквивалент и эквивалентную массу указанных веществ. Mn2O7, HClO2, Ba(HS)2. Определить число молей, содержащихся в 140 г каждого вещества.
8. Рассчитать эквивалент и эквивалентную массу указанных веществ. ZnO, Mn(OH)2, Al(NO3)3. Определите массу 3,0 моль каждого вещества.
9. Рассчитать эквивалент и эквивалентную массу указанных веществ. Fe2O3, HClO4, Na2SiO3. Определить число молей, содержащихся в 135 г каждого вещества.
10. Рассчитать эквивалент и эквивалентную массу указанных веществ. N2O5, H3PO4, Al2(SO4)3. Определите массу 1,7 моль каждого вещества.
11. Рассчитать эквивалент и эквивалентную массу указанных веществ. P2O5, H2SO4, K3PO4. Определить число молей, содержащихся в 410 г каждого вещества.
12. Рассчитать эквивалент и эквивалентную массу указанных веществ. K2O, H2S, Al2(CO3)3. Определите массу 3,1 моль каждого вещества.
13. Рассчитать эквивалент и эквивалентную массу указанных веществ. As2O5, Ni(OH)2, CaCO3. Определить число молей, содержащихся в 250 г каждого вещества.
14. Рассчитать эквивалент и эквивалентную массу указанных веществ. SO2, Bi(OH)3, SnSO4. Определите массу 2,2 моль каждого вещества.
15. Рассчитать эквивалент и эквивалентную массу указанных веществ. Bi2O3, H2SO3, Cu(NO3)2. Определить число молей, содержащихся в 158 г каждого вещества.
16. Рассчитать эквивалент и эквивалентную массу указанных веществ. TiO2, Sr(OH)2, K2SO3. Определите массу 3,4 моль каждого вещества.
17. Рассчитать эквивалент и эквивалентную массу указанных веществ N2O4, Mn(OH)2, Ca(НCO3)2. Определить число молей, содержащихся в 230 г каждого вещества.
18. Рассчитать эквивалент и эквивалентную массу указанных веществ. I2O5, HCNS, Mg3(PO4)2. Определите массу 0,5 моль каждого вещества.
19. Рассчитать эквивалент и эквивалентную массу указанных веществ. Fe2O3, HClO4, Na2SiO3. Определить число молей, содержащихся в 620 г каждого вещества.
20. Рассчитать эквивалент и эквивалентную массу указанных веществ. CaO, CsOH, Fe2(SO4)3. Определите 0,4 моль каждого вещества.
Решение:
1) Расставим степени окисления у всех элементов во всех соединениях в уравнении и укажем элементы, степень окисления которых изменяется в результате реакции:
0 +1 +5 -2 +1 -1 +4 -1 +2 -2 +1 -2
Pt + HNO3 + HCl → PtCl3+ NO + H2O
2) Составим схемы перехода электронов:
Pt0 – 4 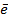 → Pt+4, процесс окисления, элемент восстановитель;
→ Pt+4, процесс окисления, элемент восстановитель;
N+5 + 3 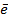 → N+2, процесс восстановления, элемент окислитель.
→ N+2, процесс восстановления, элемент окислитель.
Т.к. количество отданных и принятых электронов должно быть одинаковым, необходимо их уравнять, определив наименьшее общее кратное для чисел 3 и 4 это число 12
| 122 |
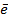 → Pt+4 3
→ Pt+4 3
N+5 + 3 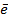 → N+2 4
→ N+2 4
Полученные цифры являются стехиометрическими коэффициентами, которые следует проставить в уравнении реакции перед окислителем и восстановителем в правой и левой части уравнения. Остальные элементы уравниваем в следующем порядке: металлы, неметаллы, водород. Согласно закону сохранения масс, количество атомов одного и того же элемента до и после реакции должно быть одинаковым.
3Pt + 4HNO3 + 12HCl → 3PtCl4+ 4NO + 8H2O
В заданиях 21-40 методом электронного баланса подобрать коэффициенты в схемах окислительно-восстановительных реакций. Указать окислитель и восстановитель, подписать процессы окисления и восстановления.
21. KClO3 + MnSO4 + KOH ® K2MnO4 + KCl + H2SO4
Pb + HNO3(разб) ® Pb(NO3)2 + NO + H2О
22. KMnO4 + CH4 + H2SO4 ® MnSO4 + CO2 + K2SO4 + Н2О
FeSO4 + HNO3 + H2SO4 ® NO + H2O + Fe2(SO4)3
23. CuS + HNO3 ® S + NO + Cu(NO3)2 + H2O
I2 + Ba(OH)2 ® Ba(IO3)2 + BaI2 + H2O
24. KBr + H2SO4 ® Br2 + SO2 + K2SO4 + H2O
K2CrO4 + H2S + H2SO4 ® Cr2(SO4)3 + S + K2SO4 + H2O
25. Zn + NaOH + NaNO3 ® NH3 + Na2ZnO2 + H2O
K2FeO4 + H2SO4 ® O2 + Fe2(SO4)3 + K2SO4 + H2O
26. KMnO4 + HI + H2SO4 ® MnSO4 + I2 + K2SO4 + H2O
SnCl2 + K2Cr2O7 + H2SO4 ® Sn(SO4)2 + CrCl3 + K2SO4 + H2O
27. KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O
CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O
28. NO2 + NaOH ® NaNO2 + NaNO3 + H2O
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
29. Pt + HNO3 + HCl ® PtCl4 + NO + H2O
FeSO4 + KClO3 + H2SO4 ® KCl + Fe2(SO4)3 + H2O
30. KNO3 + Al + KOH + H2O ® NH3 + KAlO2
KMnO4 + KBr + H2SO4 ® K2SO4 + MnSO4 + Br2 + H2O
31. NaCrO2 + Br2 + NaOH ® NaBr + Na2CrO4 + H2O
Fe2O3 + KNO3 + KOH ® K2FeO4 + KNO2 + H2O
32. Au + H2SeO4 ® SeO2 +Au2(SeO4)3 + H2O
Mn(NO3)2 + KВiO3 + HNO3 ® Bi(NO3)3 + HMnO4 + H2O + KNO3
33. MnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O
FeSO4 + HNO3 + H2SO4 ® NO + H2O + Fe2(SO4)3
34. K2Cr2O7 + KCl + H2O ® KClO4 + CrCl3 + KOH
Ca + HNO3 ® NH4NO3+ Ca(NO3)2 + H2O
35. KMnO4 + KNO2 + H2SO4 ® MnSO4 + K2SO4 + KNO3 + H2O
Bi2O3 +Br2 + KOH ® KBr + KBiO3 + H2O
36. Mn(NO3)2 + KВiO3 + HNO3 ® Bi(NO3)3 + HMnO4 + H2O + KNO3
K2Cr2O7 + KCl + H2O ® KClO4 + CrCl3 + KOH
37. Fe2O3 + KNO3 + KOH ® K2FeO4 + KNO2 + H2O
KMnO4 + KBr + H2SO4 ® K2SO4 + MnSO4 + Br2 + H2O
38. NaCrO2 + Cl2 + NaOH ® NaCl + Na2CrO4 + H2O
NO2 + KOH ® KNO2 + KNO3 + H2O
39. NaBr + H2SO4 + NaBrO3 → Br2 + Na2SO4 + H2O
(NH4)2Cr2O7→Cr2O3 + N2↑ + H2O
40. HClO + H2O2→HCl + O2 + H2O
KMnO4 + H2S + H2SO4 → MnSO4 + K2SO4 + S + H2O
Пример 6:
В 300 г воды растворено 70 г нитрата натрия. Плотность полученного раствора 1,15 г¤см3. Определить процентную, нормальную и моляльную концентрации растворов.
| Дано: m(H2O) = 300 г m(NaNO3) = 70 г ρ = 1,15 г/см3 | Решение: 1) Процентная концентрация (С%) рассчитывается по формуле:
mраствора - масса раствора, г. В данной задаче растворенным веществом является нитрат натрия, массой 70 г; масса раствора равна сумме масс растворенного вещества и растворителя mраствора = 70 + 300 = 370 г.
2) Нормальная концентрация (Сн) рассчитывается по формуле:
Mэ – эквивалентная масса растворенного вещества, г/моль-экв; V – объем раствора, л. Mэ(NaNO3) = V = ρ· mраствора = 1,15 ·370 =195,5 мл = 0,1955 л
3) Моляльная концентрация (Сm) рассчитывается по формуле
M – молярная масса растворенного вещества, г/моль; mрастворителя - масса растворителя (воды) г.
|
| Найти С% , Cн, Сm |
Ответ: С% = 18,9%, Сн = 4,21 моль-экв/л, Cm = 2,75 моль/кг.
101. Рассчитайте процентную концентрацию и титр гидроксида калия в 330 г раствора с нормальной концентрацией 0,6 моль-экв/дм3 (ρ = 1,012 г/см3).
102. Рассчитать объем 20% раствора серной кислоты (r = 1,139 г¤ cм3) необходимый для приготовления 300 см3 раствора H2SO4 с нормальной концентрацией 0,1 моль-экв/дм3. Определить титр раствора.
103. Определить процентную концентрацию и моляльную концентрацию раствора сульфита натрия с нормальной концентрацией 2 моль-экв/дм3 и плотность 1,09 г/см3.
104. Определить, какую массу раствора гидроксида бария нормальной концентрацией 1,2 моль-экв/дм3 (r = 1,089 г¤см3) можно получить при растворении 122 г основания в воде. Рассчитайте процентную и моляльную концентрацию раствора.
105. Определить, какую массу соли необходимо взять, чтобы приготовить 500 см 3 раствора сульфата натрия, нормальная концентрация которого 0,6 моль-экв/дм3. Рассчитайте процентную концентрацию и титр полученного раствора (ρ = 1,060 г/см3).
106. Определить массу соли, которая содержится в 700 см3 0,5 нормального раствора сульфата магния. Рассчитайте процентную концентрацию и титр раствора (ρ = 1,12 г/см3).
107. В 200 г воды растворено 45 г карбоната натрия. Плотность полученного раствора 1,09 г¤см3. Определить процентную, нормальную и моляльную концентрации растворов.
108. Сколько нитрата хрома (III) и воды (в граммах) необходимо взять, чтобы приготовить 350 г 13%-ного раствора. Рассчитайте нормальную концентрацию и титр раствора (ρ = 1,21 г/см3).
109. Рассчитайте процентную концентрацию и титр фосфата калия в 620 г раствора с нормальной концентрацией 0,3 моль-экв/дм3 (ρ = 1,06 г/см3)
110. Определить процентную и моляльную концентрацию нитрита никеля (II) в растворе, нормальная концентрация которого 0,8 моль-экв/дм3 и плотность 1,11 г/см3
111. Определить, какую массу раствора нитрита магния с нормальной концентрацией 0,7 моль-экв/дм3 (r = 1,13 г¤см3) можно получить при растворении 82 г соли в воде. Рассчитайте процентную концентрацию и титр раствора.
112. Определить какую массу соли необходимо взять, чтобы приготовить 450 см 3 раствора хлорида железа (III), нормальная концентрация которого 0,4 моль-экв/дм3. Рассчитайте процентную и моляльную концентрацию полученного раствора (ρ = 1,18 г/см3).
113. Определить массу соли, которая содержится в 1200 см3 0,3 нормального раствора нитрата цинка. Рассчитайте процентную концентрацию и титр раствора (ρ = 1,12 г/см3).
114. В 800 г воды растворено 111 г бромида алюминия. Плотность полученного раствора 1,31 г¤см3. Определить процентную, нормальную и моляльную концентрации растворов.
115. Сколько йодида бериллия и воды (в граммах) необходимо взять, чтобы приготовить 1100 см3 5%-ного раствора. Рассчитайте нормальную концентрацию и титр раствора (ρ = 1,08 г/см3).
116. Рассчитайте процентную концентрацию и титр раствора серной кислоты объемом 550 см3 раствора с нормальной концентрацией 0,15 моль-экв/дм3 (ρ = 1,03 г/см3).
117. Определить процентную и моляльную концентрацию гидрокарбоната калия в растворе, нормальная концентрация которого 0,9 моль-экв/дм3 и плотность 1,02 г/см3.
118. Определить какую массу раствора гидроксида натрия нормальной концентрацией 2,5 моль-экв/дм3 (r = 1,23 г¤см3) можно получить при растворении 95 г щелочи в воде. Рассчитайте процентную концентрацию и титр раствора.
119. Определить какую массу соли необходимо взять, чтобы приготовить 900 см3 раствора фторида кальция, нормальная концентрация которого 1,2 моль-экв/дм3. Рассчитайте процентную и моляльную концентрацию полученного раствора (ρ = 1,25 г/см3).
120. Определить массу соли, которая содержится в 1300 см3 0,8 нормального раствора нитрата серебра. Рассчитайте процентную концентрацию и титр раствора (ρ = 1,29 г/см3).
Тема 7. Свойства растворов.
Пример 7:
Вычислить температуру замерзания раствора, содержащего 9,0 г глюкозы С6Н12О6 в 100 г воды. Криоскопическая константа воды -1,86.
Решение:
| Дано: m(С6Н12О6) = 9,0 г. m(Н2О) = 100 г. Ккр = 1,86 | Решение:
mр-ля – масса растворителя (воды), г; M – молярная масса растворенного вещества, г/моль.
M (С6Н12О6) = 6·12 + 12·1 + 6·16 = 180 г/моль Подставив числа в формулу, рассчитаем изменение температуры замерзания:
Вычитая 0,93 из температуры замерзания воды, находим понижение температуры замерзания раствора: |
| Найти tзам |
Ответ: tзам = -0,93°С
121. Вычислите массу глицерина С3Н5(ОН)3, растворенного в воде, зная, что этот раствор кипит при 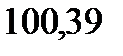
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 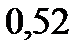
 .
.
122. Раствор, содержащий 55,4 г неэлектролита в воде объемом 2,5 л, кипит при 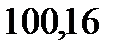
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 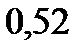
 . Вычислите молекулярную массу неэлектролита.
. Вычислите молекулярную массу неэлектролита.
123. Вычислите молекулярную массу вещества, зная, что раствор, содержащий 0,04 г этого вещества и бензола массой 20 г, кристаллизуется при температуре на 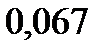
 ниже, чем чистый бензол. Криоскопическая константа бензола
ниже, чем чистый бензол. Криоскопическая константа бензола 
 .
.
124. Для раствора, состоящего из 0,94 г неэлектролита и 50 г этилового спирта, повышение температуры кипения составляет 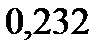
 . Эбуллиоскопическая константа этилового спирта
. Эбуллиоскопическая константа этилового спирта 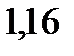
 . Вычислите молярную массу растворенноговещества.
. Вычислите молярную массу растворенноговещества.
125. При растворении некотороговещества массой 15 г в диэтиловом эфире массой 400 г температура кипения последнего повысилась на 
 . Вычислите значения молярной массы для растворенного вещества. Эбуллиоскопическая константа эфира
. Вычислите значения молярной массы для растворенного вещества. Эбуллиоскопическая константа эфира 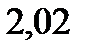
 .
.
126. При какой температуре должен кипеть раствор, содержащий растворенный неэлектролит количеством вещества 0,062 моль в воде объемом 200 мл?
127. Раствор, содержащий фосфор и бензол, масса которых соответственно равна 0,1155 и 19,03 г, замерзает при 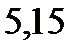
 . Чистый бензол замерзает при
. Чистый бензол замерзает при 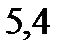
 . Криоскопическая константа для бензола
. Криоскопическая константа для бензола 
 . Найдите молекулярную формулу фосфора.
. Найдите молекулярную формулу фосфора.
128. Найдите молекулярную формулу серы, зная, что температура кипения чистого бензола на 
 ниже температуры кипения раствора, содержащего серу массой 0,81 г в бензоле массой 100 г. Эбулиоскопическая константа бензола
ниже температуры кипения раствора, содержащего серу массой 0,81 г в бензоле массой 100 г. Эбулиоскопическая константа бензола 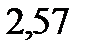
 .
.
129. Раствор, состоящий из 9,2 г иода и 100 метилового спирта, закипает при 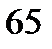
 . Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта
. Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта 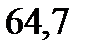
 , а его эбуллиоскопическая константа
, а его эбуллиоскопическая константа 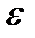 =
= 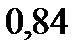
 .
.
130. Раствор, содержащий ацетон массой 100 г и глицерин С3Н8О3 массой 2,67 г кипит при 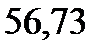
 . Температура кипения ацетона
. Температура кипения ацетона 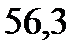
 . Вычислите эбуллиоскопическую константу ацетона.
. Вычислите эбуллиоскопическую константу ацетона.
131. Раствор, содержащий неэлектролит массой 13,8 г в воде объемом 1 л, замерзает при 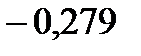
 . Найдите молярную массу неэлектролита. Криоскопическая константа воды
. Найдите молярную массу неэлектролита. Криоскопическая константа воды 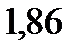
 .
.
132. Раствор, содержащий 1 г растворенного вещества в 50 г воды, замерзает при 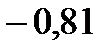
 . Найдите молярную массу растворенного вещества. Криоскопическая константа воды
. Найдите молярную массу растворенного вещества. Криоскопическая константа воды 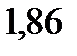
 .
.
133. Насколько градусов понизится температура замерзания, если в бензоле массой 100 г растворить нафталин ( 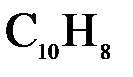 ) массой 4 г. Криоскопическая константа бензола
) массой 4 г. Криоскопическая константа бензола 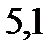
 .
.
134. Насколько градусов повысится температура кипения, если в воде объемом 1 л растворить глюкозу массой 90 г? Эбуллиоскопическая константа воды 
 .
.
135. Какую массу глюкозы 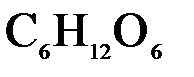 необходимо растворить в воде объемом 100 мл, чтобы температура понизилась на
необходимо растворить в воде объемом 100 мл, чтобы температура понизилась на 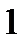
 . Криоскопическая константа воды
. Криоскопическая константа воды 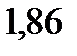
 .
.
136. Какую массу глюкозы 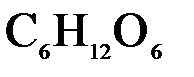 необходимо растворить в 100 мл воды, чтобы температура кипения повысилась на
необходимо растворить в 100 мл воды, чтобы температура кипения повысилась на 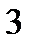
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 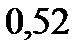
 .
.
137. Вычислите массу метанола СН3ОН растворенного в воде, если температура кристаллизации кэтогораствора 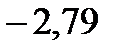
 . Криоскопическая константа воды
. Криоскопическая константа воды 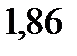
 .
.
138. При какой температуре замерзает раствор, содержащий 14,4 г глюкозы 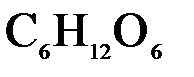 в 200 мл воды. Криоскопическая константа воды
в 200 мл воды. Криоскопическая константа воды 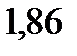
 .
.
139. При какой температуре замерзает раствор, содержащий 3 г мочевины в 200 мл воды. Криоскопическая константа воды 
 .
.
140. При какой температуре кипят и замерзают водные растворы неэлектролитов, моляльность которых равна 1 моль/кг. Криоскопическая константа воды 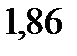
 . Эбуллиоскопическая константа воды
. Эбуллиоскопическая константа воды 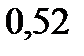
 .
.
Пример 8:
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворt между нитратом свинца и хлоридом калия.
Решение:
молекулярное уравнение:
Pb(NO3)2 + 2КСl = PbCl 2 ↓ + 2KNO3
ионно-молекулярное уравнение:
Pb2+ + 2NO3- + 2К + +2Сl- = PbCl2 + 2K+ + 2NO3-
краткое ионно-молекулярное уравнение:
Pb2+ + 2Сl- = PbCl 2 ↓
141. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой.
142. Какое из веществ: 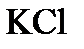 ,
,  ,
,  ,
, 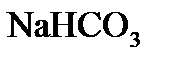 - взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
- взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
143. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) 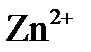 +
+ 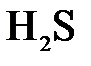 =
= 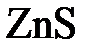 + 2
+ 2 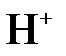
б) 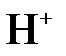 +
+ 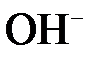 =
= 
в)  +2
+2 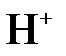 =
=  +
+ 
144. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) 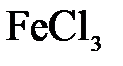 и
и 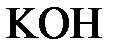 ; б)
; б) 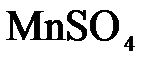 и
и 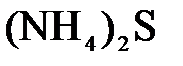 ; в)
; в) 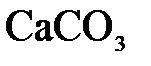 и
и  .
.
145. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) 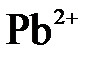 +
+ 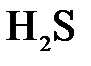 =
= 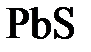 + 2
+ 2 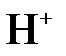
б)  + 2
+ 2 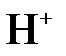 =
=  +
+ 
в) 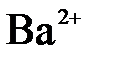 +
+ 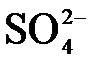 =
= 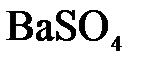
147. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а)  + 2 + 2 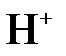 = =  + 2 + 2  б)
б) 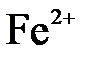 + 2 + 2 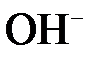 = =  в)
в) 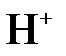 + + 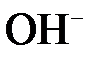 = = 
|
148. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а)  и и  ; б) ; б)  и и 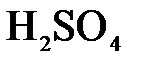 ; в) ; в)  и и  . .
|
149. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) 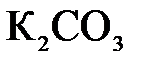 и и  ; б) ; б)  и и  ; в) ; в)  и и 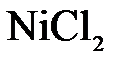 . .
|
150. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) 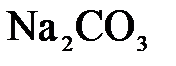 и и 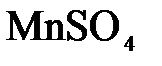 ; б) ; б) 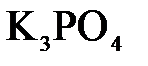 и и  ; в) ; в)  и и  . .
|
151. Составьте молекулярные уравнения реакций взаимодействия в растворах между а)  и и 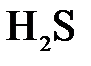 ; б) ; б) 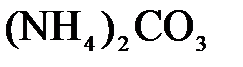 и и  ; в) ; в) 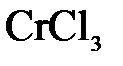 и и  . .
|
152. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между а)  и и  ; б) ; б) 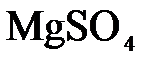 и и 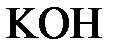 ; в) ; в) 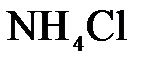 и и  . .
|
153. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) 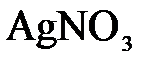 и и 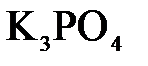 ; б) ; б) 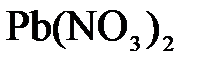 и и 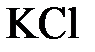 ; в) ; в) 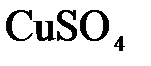 и и 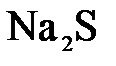 . .
|
154. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) 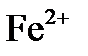 + + 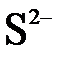  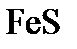 б) б)  + + 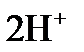 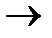 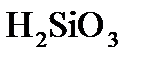
|
155. Какое из веществ: 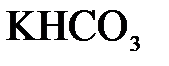 , , 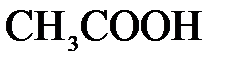 , , 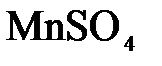 , , 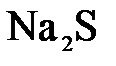 - взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. - взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
|
156. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) 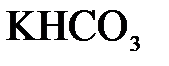 и и  ; б) ; б)  и и  ; в) ; в) 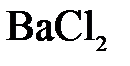 и и 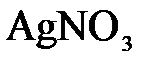 . .
|
157. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) 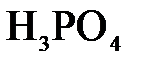 и и  ; б) ; б) 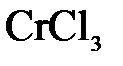 и и 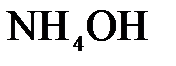 ; в) ; в) 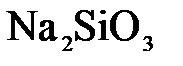 и и  . .
|
158. Какое из веществ:  , ,  , ,  - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
|
| 159. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой. |
| 160. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) сульфидом натрия и соляной кислотой; б) сульфатом железа (II) и сульфидом калия; в) иодидом натрия и нитратом свинца. |
Тема 10. Коррозия металлов.
Пример 10:
Как протекает атмосферная и кислотная коррозия изделия из меди, покрытого слоем магния, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
Решение:
1) Атмосферная коррозия
При контакте двух металлов образуется гальваническая пара, один из металлов с меньшим электродным потенциалом, является анодом; второй – катодом.
φ(Mg2+/Mg0)= -2,36 В - анод; φ(Сu2+/Cu0)= +0,34В – катод
схема гальванической пары в атмосферных условиях: (А) Mg | O2, Н2О| Cu (К)
анодный процесс: Mg0 - 2 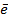 → Mg2+
→ Mg2+
катодный процесс: O2 +2Н2О + 4 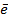 → 4OH-
→ 4OH-
суммарное уравнение коррозии: 2Mg0 + O2 +2Н2О → 2Mg2+ + 4OH-
или: 2Mg0 + O2 +2Н2О → М g ( OH )2 – продукт коррозии
2) Кислотная коррозия
схема гальванической пары в кислой среде: (А) Mg | Н+ | Cu (К)
анодный процесс: Mg0 - 2 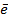 → Mg2+
→ Mg2+
катодный процесс: 2Н+ + 2 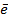 → Н2
→ Н2
суммарное уравнение коррозии: Mg0 + 2Н+ → Mg2+ + Н2
Продуктом коррозии является соль металла-анода.
181. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
182. Как протекает кислотная коррозия железа, покрытого слоем магния, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
183. Как протекает атмосферная коррозия свинца, покрытого слоем хрома, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
184. Как протекает кислотная коррозия железа, покрытого слоем титана, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
185. Как протекает атмосферная коррозия цинка, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
186. Как протекает кислотная коррозия свинца, покрытого слоем олова при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
187. Как протекает атмосферная коррозия луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
188. Как протекает атмосферная коррозия никеля, покрытого слоем серебра, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
189. Как протекает кислотная коррозия марганца, покрытого слоем алюминия, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
190. Как протекает атмосферная коррозия цинка, покрытого слоем платины, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
191. Как протекает атмосферная коррозия марганца, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Укажите состав продуктов коррозии.
192. Железное изделие покрыто кадмием. Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе. Какие продукты коррозии образуются при этом?
193. Свинцовая пластина покрыта оловом, находится во влажном воздухе. Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе. Какие продукты коррозии образуются при этом?
194. Медное изделие покрыто марганцем. Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия в азотной кислоте. Какие продукты коррозии образуются при этом?
195. Никелевое изделие покрыто марганцем. Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе. Какие продукты коррозии образуются при этом?
196. Как протекает коррозия железа, покрытого слоем магния в кислой среде? Каков состав продуктов коррозии?
197. Как происходит атмосферная коррозия луженого никеля при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
198. Изделие из меди покрыли серебром. Составьте электронные уравнения анодного и катодного процессов коррозии изделия при нарушении покрытия во влажном воздухе.
199. Cсвинцовая пластина, покрыта медью, находится во влажном воздухе. Составьте электронные уравнения анодного и катодного процессов коррозии этой пластинки при нарушении покрытия. Каков состав продуктов коррозии железа?
200. Как протекает коррозия железа, покрытого слоем магния, в сернокислой среде, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
ТАБЛИЦА 1 - Термодинамические характеристики
элементов и их соединений в стандартных условиях (Т=298 К, р=1 атм)
| Химическое соединение | Агрегатное состояние | Энтальпия образования (DН0298), кДж/моль | Энтропия (S0298), Дж/(моль×К) |
| С | К(графит) | 0 | 5,7 |
| С2Н2 | Г | 226,5 | 200,6 |
| С2Н4 | Г | 52,2 | 219,2 |
| С2Н5ОН | Ж | -277,6 | 160,7 |
| С2Н6 | Г | -85,6 | 191,3 |
| Са(ОН)2 | К | -986,6 | 76,1 |
| СаСО3 | К | -1207,0 | 88,3 |
| CaC2 | к | – 62,8 | 70,3 |
| СаО | К | -635,5 | 39,7 |
| СН3ОН | Ж | 37,4 | 126,8 |
| СН4 | Г | -74,8 | 186,0 |
| СО | Г | -110,4 | 197,7 |
| СО2 | Г | -393,3 | 213,6 |
| Fe | K | 0 | 27,1 |
| Fe2O3 | K | -821,4 | 89,9 |
| Fe 3 O4 | K | -1117,1 | 146,4 |
| FeO | K | -268,, | 56,0 |
| H2 | Г | 0 | 130,5 |
| H2O | Ж | -285,6 | 70,0 |
| H2O | Г | -241,6 | 188,8 |
| H2S | Г | -20,1 | 205,4 |
| HCl | Г | -92,9 | 192,4 |
| HI | Г | 25,9 | 206,5 |
| I2 | Г | 62,2 | 260,2 |
| N2 | Г | 0 | 191,3 |
| N2O | Г | 82,0 | 219,9 |
| N2O4 | Г | 9,6 | 303,8 |
| N2O5 | К | -42,7 | 178,0 |
| NH3 | Г | -46,0 | 192,2 |
| NH4Cl | К | -315,1 | 34,4 |
| NO | Г | 90,3 | 210,4 |
| NO2 | Г | 33,8 | 239,9 |
| О2 | Г | 0 | 204,9 |
| S | К(ромб) | 0 | 31,8 |
| SO 2 | Г | -298,5 | 247,5 |
| SO 3 | Г | -394,8 | 255,8 |
| Ti | К | 0 | 30,6 |
| TiCl4 | К | -804,2 | 252,4 |
| TiO2 | К | -943,9 | 60,3 |
| Cl 2 | Г | 0 | 222,8 |
| Al | т | 0 | 28,35 |
| Al2O3 | к | – 1676 | 50,92 |
| Al(OH)3 | к | – 1275,7 | 71,1 |
| AlCl3 | р | – 697,4 | 167,0 |
ТАБЛИЦА 2 – стангдартные электродные потенциалы
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li+ | -3,05 |
| K | 1e | K+ | -2,925 |
| Rb | 1e | Rb+ | -2,925 |
| Cs | 1e | Cs+ | -2,923 |
| Ba | 2e | Ba2+ | -2,91 |
| Sr | 2e | Sr2+ | -2,89 |
| Ca | 2e | Ca2+ | -2,87 |
| Na | 1e | Na+ | -2,71 |
| Mg | 2e | Mg2+ | -2,36 |
| Al | 3e | Al3+ | -1,66 |
| Mn | 2e | Mn2+ | -1,18 |
| Zn | 2e | Zn2+ | -0,76 |
| Cr | 3e | Cr3+ | -0,74 |
| Fe | 2e | Fe2+ | -0,44 |
| Cd | 2e | Cd2+ | -0,40 |
| Co | 2e | Co2+ | -0,28 |
| Ni | 2e | Ni2+ | -0,25 |
| Sn | 2e | Sn2+ | -0,14 |
| Pb | 2e | Pb2+ | -0,13 |
| Fe | 3e | Fe3+ | -0,04 |
| H2 | 2e | 2H+ | 0,00 |
| Cu | 2e | Cu2+ | +0,34 |
| Cu | 1e | Cu+ | +0,52 |
| 2Hg | 2e | Hg2 2+ | +0,79 |
| Ag | 1e | Ag+ | +0,80 |
| Hg | 2e | Hg2+ | +0,85 |
| Pt | 2e | Pt2+ | +1,20 |
| Au | 3e | Au3+ | +1,50 |
Приложение 1.
|
№ варианта | номер задания | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 00 | 1 | 21 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 |
| 01 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 |
| 02 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 |
| 03 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 |
| 04 | 5 | 25 | 45 | 65 | 85 | 105 | 125 | 145 | 165 | 185 |
| 05 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 |
| 06 | 7 | 27 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 |
| 07 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 |
| 08 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 |
| 09 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 |
| 10 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 |
| 11 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 |
| 12 | 13 | 33 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 |
| 13 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 |
| 14 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 |
| 15 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 |
| 16 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 |
| 17 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 |
| 18 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 |
| 19 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 20 | 1 | 39 | 57 | 75 | 93 | 111 | 129 | 147 | 165 | 183 |
| 21 | 2 | 40 | 58 | 76 | 94 | 112 | 130 | 148 | 166 | 184 |
| 22 | 3 | 21 | 59 | 77 | 95 | 113 | 131 | 149 | 167 | 185 |
| 23 | 4 | 22 | 60 | 78 | 96 | 114 | 132 | 150 | 168 | 186 |
| 24 | 5 | 23 | 41 | 79 | 97 | 115 | 133 | 151 | 169 | 187 |
| 25 | 6 | 24 | 42 | 80 | 98 | 116 | 134 | 152 | 170 | 188 |
| 26 | 7 | 25 | 43 | 61 | 99 | 117 | 135 | 153 | 171 | 189 |
| 27 | 8 | 26 | 44 | 62 | 100 | 118 | 136 | 154 | 172 | 190 |
| 28 | 9 | 27 | 45 | 63 | 81 | 119 | 137 | 155 | 173 | 191 |
| 29 | 10 | 28 | 46 | 64 | 82 | 120 | 138 | 156 | 174 | 192 |
| 30 | 11 | 29 | 47 | 65 | 83 | 101 | 139 | 157 | 175 | 193 |
| 31 | 12 | 30 | 48 | 66 | 84 | 102 | 140 | 158 | 176 | 194 |
| 32 | 13 | 31 | 49 | 67 | 85 | 103 | 121 | 159 | 177 | 195 |
| 33 | 14 | 32 | 50 | 68 | 86 | 104 | 122 | 160 | 178 | 196 |
| 34 | 15 | 33 | 51 | 69 | 87 | 105 | 123 | 141 | 179 | 197 |
| 35 | 16 | 34 | 52 | 70 | 88 | 106 | 124 | 142 | 180 | 198 |
| 36 | 17 | 35 | 53 | 71 | 89 | 107 | 125 | 143 | 161 | 199 |
| 37 | 18 | 36 | 54 | 72 | 90 | 108 | 126 | 144 | 162 | 200 |
| 38 | 19 | 37 | 55 | 73 | 91 | 109 | 127 | 145 | 163 | 181 |
| 39 | 20 | 38 | 56 | 74 | 92 | 110 | 128 | 146 | 164 | 182 |
| 40 | 3 | 39 | 57 | 75 | 93 | 111 | 129 | 147 | 165 | 183 |
| 41 | 4 | 40 | 58 | 76 | 94 | 112 | 130 | 148 | 166 | 184 |
| 42 | 5 | 21 | 59 | 77 | 95 | 113 | 131 | 149 | 167 | 185 |
| 43 | 6 | 22 | 60 | 78 | 96 | 114 | 132 | 150 | 168 | 186 |
| 44 | 7 | 23 | 42 | 79 | 97 | 115 | 133 | 151 | 169 | 187 |
| 45 | 8 | 24 | 43 | 80 | 98 | 116 | 134 | 152 | 170 | 188 |
| 46 | 9 | 25 | 44 | 62 | 99 | 117 | 135 | 153 | 171 | 189 |
| 47 | 10 | 26 | 45 | 63 | 100 | 118 | 136 | 154 | 172 | 190 |
| 48 | 11 | 27 | 46 | 64 | 83 | 119 | 137 | 155 | 173 | 191 |
| 49 | 12 | 28 | 47 | 65 | 84 | 120 | 138 | 156 | 174 | 192 |
| 50 | 13 | 29 | 48 | 66 | 85 | 104 | 139 | 157 | 175 | 193 |
| 51 | 14 | 30 | 49 | 67 | 86 | 105 | 140 | 158 | 176 | 194 |
| 52 | 15 | 31 | 50 | 68 | 87 | 106 | 125 | 159 | 177 | 195 |
| 53 | 16 | 32 | 51 | 69 | 88 | 107 | 126 | 160 | 178 | 196 |
| 54 | 17 | 33 | 52 | 70 | 89 | 108 | 127 | 146 | 179 | 197 |
| 55 | 18 | 34 | 53 | 71 | 90 | 109 | 128 | 147 | 180 | 198 |
| 56 | 19 | 35 | 54 | 72 | 91 | 110 | 129 | 148 | 167 | 199 |
| 57 | 20 | 36 | 55 | 73 | 92 | 111 | 130 | 149 | 168 | 200 |
| 58 | 1 | 37 | 56 | 74 | 93 | 112 | 131 | 150 | 169 | 188 |
| 59 | 2 | 38 | 57 | 75 | 94 | 113 | 132 | 151 | 170 | 189 |
| 60 | 3 | 39 | 58 | 76 | 95 | 114 | 133 | 152 | 171 | 190 |
| 61 | 4 | 40 | 59 | 77 | 96 | 115 | 134 | 153 | 172 | 191 |
| 62 | 5 | 39 | 60 | 78 | 97 | 116 | 135 | 154 | 173 | 192 |
| 63 | 6 | 40 | 57 | 79 | 98 | 117 | 136 | 155 | 174 | 193 |
| 64 | 7 | 39 | 58 | 80 | 99 | 118 | 137 | 156 | 175 | 194 |
| 65 | 8 | 40 | 41 | 75 | 100 | 119 | 138 | 157 | 176 | 195 |
| 66 | 9 | 21 | 42 | 76 | 93 | 120 | 139 | 158 | 177 | 196 |
| 67 | 10 | 22 | 43 | 74 | 94 | 111 | 140 | 159 | 178 | 197 |
| 68 | 11 | 23 | 44 | 75 | 84 | 112 | 129 | 160 | 179 | 198 |
| 69 | 12 | 24 | 45 | 76 | 85 | 108 | 130 | 147 | 180 | 199 |
| 70 | 13 | 25 | 46 | 77 | 86 | 109 | 121 | 148 | 165 | 200 |
| 71 | 14 | 26 | 47 | 78 | 87 | 110 | 122 | 142 | 166 | 183 |
| 72 | 15 | 27 | 48 | 79 | 88 | 111 | 123 | 143 | 164 | 184 |
| 73 | 16 | 28 | 49 | 80 | 89 | 112 | 124 | 144 | 165 | 181 |
| 74 | 17 | 29 | 50 | 75 | 90 | 113 | 125 | 145 | 166 | 182 |
| 75 | 18 | 30 | 51 | 76 | 91 | 114 | 126 | 146 | 167 | 183 |
| 76 | 19 | 31 | 52 | 77 | 92 | 115 | 127 | 147 | 168 | 184 |
| 77 | 20 | 32 | 53 | 78 | 93 | 116 | 128 | 148 | 169 | 185 |
| 78 | 20 | 33 | 54 | 79 | 94 | 117 | 129 | 149 | 170 | 186 |
| 79 | 1 | 34 | 55 | 80 | 95 | 118 | 130 | 150 | 171 | 187 |
| 80 | 2 | 35 | 56 | 61 | 96 | 119 | 131 | 151 | 172 | 188 |
| 81 | 3 | 36 | 57 | 62 | 97 | 120 | 132 | 152 | 173 | 189 |
| 82 | 4 | 37 | 58 | 63 | 98 | 111 | 133 | 153 | 174 | 190 |
| 83 | 5 | 38 | 59 | 64 | 83 | 112 | 122 | 154 | 175 | 191 |
| 84 | 6 | 39 | 60 | 65 | 84 | 113 | 123 | 155 | 176 | 192 |
| 85 | 7 | 25 | 45 | 66 | 85 | 114 | 124 | 156 | 177 | 193 |
| 86 | 8 | 26 | 46 | 67 | 86 | 115 | 125 | 157 | 178 | 194 |
| 87 | 9 | 27 | 47 | 68 | 87 | 116 | 126 | 158 | 179 | 195 |
| 88 | 10 | 28 | 48 | 61 | 88 | 117 | 127 | 159 | 180 | 196 |
| 89 | 11 | 29 | 49 | 62 | 89 | 118 | 128 | 160 | 165 | 197 |
| 90 | 12 | 30 | 50 | 63 | 90 | 119 | 129 | 147 | 166 | 198 |
| 91 | 13 | 31 | 51 | 64 | 99 | 120 | 130 | 148 | 167 | 199 |
| 92 | 14 | 32 | 52 | 65 | 100 | 101 | 135 | 149 | 168 | 200 |
| 93 | 15 | 33 | 53 | 66 | 93 | 102 | 136 | 150 | 169 | 181 |
| 94 | 16 | 34 | 54 | 67 | 94 | 103 | 137 | 151 | 170 | 182 |
| 95 | 17 | 35 | 55 | 68 | 95 | 104 | 138 | 152 | 171 | 183 |
| 96 | 18 | 36 | 56 | 69 | 96 | 105 | 139 | 153 | 172 | 184 |
| 97 | 19 | 37 | 57 | 70 | 81 | 106 | 140 | 154 | 173 | 185 |
| 98 | 20 | 38 | 58 | 71 | 82 | 107 | 121 | 155 | 174 | 186 |
| 99 | 1 | 39 | 59 | 72 | 99 | 108 | 134 | 156 | 175 | 187 |
Приложение 2
| МИНОБРНАУКИ РОССИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ УХТИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ (УГТУ) Контрольная работа по химии Студента группы ТМО-17 (з) Иванова И.И. Шифр: 12345678 2018 г |
Тема 1. Количество вещества. Эквивалент. Эквивалентная масса.
Пример 1:
Рассчитать эквивалент и эквивалентную массу указанных веществ: Сr2O3, H2SO4, Na3PO4. Определить число молей, содержащихся в 80 г каждого вещества.
Решение:
Сr2O3 – оксид, эквивалент и эквивалентная масса оксида рассчитываются по формулам:
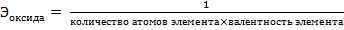 ,
,
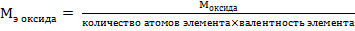 или
или 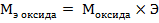
Количество атомов хрома – 2, валентность – III, M(Сr2O3) = 52·2+16·3 = 152 г/моль, отсюда следует:
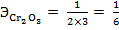 ,
, 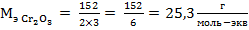
Н2SO4 – кислота, эквивалент и эквивалентная масса кислоты рассчитываются по формулам:
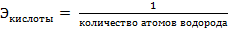 ,
,
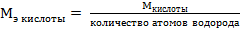 или
или 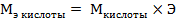
Количество атомов водорода – 2, M(Н2SO4) = 1·2+32+16·4 = 98 г/моль отсюда, следует:
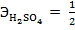 ,
, 
Na3PO4 – соль, эквивалент и эквивалентная масса соли рассчитываются по формулам:
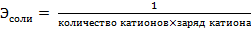 ,
,
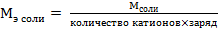 или
или 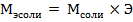
Количество катионов Na+ – 3, заряд катиона 1, M(Na3PO4) = 23·3+31+16·4 = 141 г/моль, отсюда следует:
 ,
, 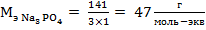
Число молей любого вещества рассчитывается по формуле: 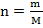 , где m – масса вещества, г; M – молярная масса вещества, г/моль. По условию задачи массы веществ равны 80 г, молярные массы рассчитаны выше, отсюда следует:
, где m – масса вещества, г; M – молярная масса вещества, г/моль. По условию задачи массы веществ равны 80 г, молярные массы рассчитаны выше, отсюда следует:
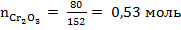 ,
, 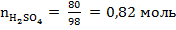 ,
, 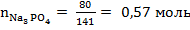
1. Рассчитать эквивалент и эквивалентную массу указанных веществ: SO3, Fe(OH)3, Na2Cr2O7. Определить число молей, содержащихся в 80 г каждого вещества.
2. Рассчитать эквивалент и эквивалентную массу указанных веществ: Cr2O3, H3AsO3, K2MnO4. Определите массу 1,8 моль каждого вещества.
3. Рассчитать эквивалент и эквивалентную массу указанных веществ. I2O5, HCNS, Mg3(PO4)2. Определить число молей, содержащихся в 150 г каждого вещества.
4. Рассчитать эквивалент и эквивалентную массу указанных веществ. SiO2, H2CO3, NH4Cl.. Определите массу 1,6 моль каждого вещества.
5. Рассчитать эквивалент и эквивалентную массу указанных веществ. Cl2O7, H3BO3, Pb(NO3)2. Определить число молей, содержащихся в 320 г каждого вещества.
6. Рассчитать эквивалент и эквивалентную массу указанных веществ. CO2, Cu(OH)2, BaCO3. Определите массу 0,9 моль каждого вещества.
7. Рассчитать эквивалент и эквивалентную массу указанных веществ. Mn2O7, HClO2, Ba(HS)2. Определить число молей, содержащихся в 140 г каждого вещества.
8. Рассчитать эквивалент и эквивалентную массу указанных веществ. ZnO, Mn(OH)2, Al(NO3)3. Определите массу 3,0 моль каждого вещества.
9. Рассчитать эквивалент и эквивалентную массу указанных веществ. Fe2O3, HClO4, Na2SiO3. Определить число молей, содержащихся в 135 г каждого вещества.
10. Рассчитать эквивалент и эквивалентную массу указанных веществ. N2O5, H3PO4, Al2(SO4)3. Определите массу 1,7 моль каждого вещества.
11. Рассчитать эквивалент и эквивалентную массу указанных веществ. P2O5, H2SO4, K3PO4. Определить число молей, содержащихся в 410 г каждого вещества.
12. Рассчитать эквивалент и эквивалентную массу указанных веществ. K2O, H2S, Al2(CO3)3. Определите массу 3,1 моль каждого вещества.
13. Рассчитать эквивалент и эквивалентную массу указанных веществ. As2O5, Ni(OH)2, CaCO3. Определить число молей, содержащихся в 250 г каждого вещества.
14. Рассчитать эквивалент и эквивалентную массу указанных веществ. SO2, Bi(OH)3, SnSO4. Определите массу 2,2 моль каждого вещества.
15. Рассчитать эквивалент и эквивалентную массу указанных веществ. Bi2O3, H2SO3, Cu(NO3)2. Определить число молей, содержащихся в 158 г каждого вещества.
16. Рассчитать эквивалент и эквивалентную массу указанных веществ. TiO2, Sr(OH)2, K2SO3. Определите массу 3,4 моль каждого вещества.
17. Рассчитать эквивалент и эквивалентную массу указанных веществ N2O4, Mn(OH)2, Ca(НCO3)2. Определить число молей, содержащихся в 230 г каждого вещества.
18. Рассчитать эквивалент и эквивалентную массу указанных веществ. I2O5, HCNS, Mg3(PO4)2. Определите массу 0,5 моль каждого вещества.
19. Рассчитать эквивалент и эквивалентную массу указанных веществ. Fe2O3, HClO4, Na2SiO3. Определить число молей, содержащихся в 620 г каждого вещества.
20. Рассчитать эквивалент и эквивалентную массу указанных веществ. CaO, CsOH, Fe2(SO4)3. Определите 0,4 моль каждого вещества.
Дата: 2019-05-28, просмотров: 610.
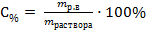 , здесь mр.в.- масса растворенного вещества, г;
, здесь mр.в.- масса растворенного вещества, г;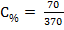 ·100% = 18,9%
·100% = 18,9%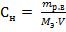 , здесь mр.в.- масса растворенного вещества, г;
, здесь mр.в.- масса растворенного вещества, г;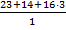 = 85 г/моль-экв.
= 85 г/моль-экв.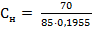 = 4,21 моль-экв/л
= 4,21 моль-экв/л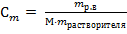 ·1000 здесь mр.в.- масса растворенного вещества, г;
·1000 здесь mр.в.- масса растворенного вещества, г;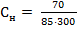 ·1000 = 2,75 моль/кг
·1000 = 2,75 моль/кг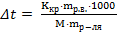 ,где mрв – масса растворенного вещества (глюкозы), г;
,где mрв – масса растворенного вещества (глюкозы), г;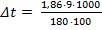 = 0,93°С
= 0,93°С