Пример 5:
Процесс представлен следующим уравнением: N 2 O 4 « 2 NO + O 2 ; D H > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) понижении давления в системе; б) при повышении температуры; в) при увеличении концентрации NO?
Решение:
Согласно закону действующих масс, скорости прямой и обратной реакции будут равны:
vпрям. = [N2O4], vобр. = [NO]2·[O2]
Константа химического равновесия: 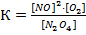
a) Согласно принципу Ле-Шателье, при понижении давления химическое равновесие смещается в сторону большего объема газообразных веществ, в данном случае в сторону прямой реакции;
б) Прямая реакция является эндотермической, обратная – экзотермической. При повышении температуры химическое равновесие смещается в сторону эндотермической, т.е. прямой реакции;
в) При увеличении концентрации вещества, химическое равновесие смещается в сторону его расходования, т.е. при увеличении концентрации NO химическое равновесие сместится в сторону обратной реакции.
81. Процесс представлен следующим уравнением: 2 NO + O 2 « 2 NO 2 ; D H < 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации кислорода?
82. Процесс представлен следующим уравнением: 2 SO 2(г) + O 2(г) « 2 SO 3(г) ; D H < 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) понижении давления в системе; б) при повышении температуры; в) при увеличении концентрации SO2?
83. Процесс представлен следующим уравнением: СО2 + Н2 « СО + Н2О(г); D H < 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при понижении температуры; в) при увеличении концентрации СO2?
84. Процесс представлен следующим уравнением: N 2 O 3 « NO 2 + N О; D H > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при увеличении концентрации NO2?
85. Процесс представлен следующим уравнением: 2 NO « N 2 + O 2 ; D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) понижении давления в системе; б) при повышении температуры; в) при увеличении концентрации O2?
86. Процесс представлен следующим уравнением: SO 2 + Cl 2 « SO 2 Cl 2 ; D H < 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) понижении давления в системе; б) при повышении температуры; в) при увеличении концентрации Cl2?
87. Процесс представлен следующим уравнением: COCl 2 « CO + Cl 2 ; D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации Cl2?
88. Процесс представлен следующим уравнением: 2N О2 ↔ 2 N О + О2; D Н > 0.
Напишите выражения: для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации NO2?
89. Процесс представлен следующим уравнением: 2 NO + Cl 2 « 2 NOCl ; D Н < 0
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации NO?
90. Процесс представлен уравнением: NH 4 ОН(р) « NH 3(г) + H 2 О(ж); D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации NН3?
91. Процесс представлен следующим уравнением: РС l 5(г) « PCl 3(г) + Cl 2 ; D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации PCl3?
92. Процесс представлен следующим уравнением: С(тв) + Н2О(г) « С O + Н2; D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) понижении давления в системе; б) при понижении температуры; в) при увеличении концентрации Н2?
93. Процесс представлен следующим уравнением: 2 NOBr(г) « 2 NO + Br 2(г); D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при увеличении концентрации NO?
94. Процесс представлен уравнением: С2Н4(г) + НС l(г) « C 2 H 5 Cl(г); D Н < 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации HCl?
95. Процесс представлен следующим уравнением: С2Н6 « С2Н4 + Н2; D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при увеличении концентрации C2H6?
96. Процесс представлен уравнением: С2Н4(г) + Н2О(ж) « С2Н5ОН(ж); D Н > 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при уменьшении концентрации C2H4?
97. Процесс представлен следующим уравнением:
С2Н5ОН(р) + HCl(р) « С2Н5 Cl(р) + H 2 Oр); D Н > 0.Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при увеличении концентрации C2H5ОН?
98. Процесс представлен следующим уравнением:
С2Н5 Cl(р) + KOH(р) « С2Н5 OH(р) + KCl(р); D Н < 0. Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при понижении температуры; в) при уменьшении концентрации C2H5Cl?
99. Процесс представлен уравнением: Cl 2(г) + H 2 O(ж) « HCl(р) + HClO(р); D H < 0.
Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при увеличении концентрации Cl2?
100. Процесс представлен следующим уравнением:
СО2 + Н2О(ж) + СаСО3(кр) « Са(НСО3)2(р) ; D H < 0.Напишите выражения для скорости прямой реакции; для скорости обратной реакции; для константы химического равновесия.
Куда смещается равновесие при а) повышении давления в системе; б) при повышении температуры; в) при увеличении концентрации СО2?
Дата: 2019-05-28, просмотров: 325.