Введение
В последние годы вопросы защиты сельскохозяйственных растений в системе возделывания культур выдвигаются на передний план и являются особенно актуальными, так как уровень развития патогенной микрофлоры в почве и на семенном материале достиг критического значения. В семенном фонде большинства хозяйств, практически отсутствует здоровый материал, почти каждая партия семян в той или иной мере заражена различными патогенными микроорганизмами. Данная ситуация усугубляется из года в год, так как не соблюдаются основные элементы технологии возделывания культур [1].
Ежегодно только от болезней растений Россия теряет от 8,5 до 25 млн. т зерна, среднегодовое значение потерь за последние годы составляет 18,3 млн. т [2]. Известно, что через семена передается более половины всех болезней растений. Именно семена являются источником опасных и вредоносных заболеваний, наносящих существенный вред товарному производству. Поэтому во многих странах предпосевная обработка семян средствами защиты растений является не только необходимым, но и законодательно обязательным приемом защиты основных сельскохозяйственных культур от вредных организмов.
Сегодня практически нет незараженных семян и, в зависимости от погодных условий, в период вегетации семена могут быть заражены до 70%. Так, на ячмене преобладают Bipolaris sorokiniana (Sacc.) Shoemaker, виды родов Altemaria, Fusarium. Во влажные годы в общем комплексе грибов на семенах ячменя встречаемость Bipolaris sorokiniana может достигать 47,6%, видов р. А1-ternaria – 31,7%, p. Fusarium – 17,5%; на озимой пшенице – видов p. Alternaria – 51,7%, p. Fusarium – до 15%. Пораженность семян различных сортов яровой пшеницы находится в пределах 47,5 – 62,3%, из них p. Fusarium – 23 – 37,5%, р. Altemaria – 10 – 34,4% [3].
В повышении урожайности зерновых культур важное место принадлежит защите их от болезней, которые приводят не только к значительному снижению сбора зерна, но и к ухудшению его качества, а иногда и к гибели посевов [4].
Пшеница, ячмень, рожь и овес являются основными продовольственными и фуражными культурами нашей страны. Наиболее важной из них является пшеница, это основная продовольственная культура России. Посевы пшеницы занимают более 25 млн. га, ее ежегодные валовые сборы – 40 – 50 млн. т, в том числе товарного зерна – около 20 млн. т [5]. Выращивание этой культуры, в основном, сосредоточено в степной и лесостепной зонах страны с умеренным климатом.
Сдерживающим фактором повышения урожайности пшеницы являются паразитарные заболевания, среди которых особо вредоносны головневые, ржавчинные грибы, корневые гнили и мучнистая роса. В ряде районов с повышенной влажностью отмечается сильное развитие септориоза, фузариоза колоса и оливковой плесени. Нередко большой вред наносят бактериальные, вирусные и микоплазменные болезни. В отдельные годы пшеница страдает от непаразитарных заболеваний, являющихся следствием недостаточной засухоустойчивости и зимостойкости, а также от выпревания и вымокания. Причинами заболевания пшеницы могут также быть избыточная и недостаточная обеспеченность растений элементами питания, низкий уровень агротехники [4].
В нашей стране, в основном, распространены яровые сорта ячменя, поскольку они успевают созревать за короткое лето, хотя урожай ярового ячменя ниже, чем озимого, и составляет в разные годы от 1,2 до 1,8 т/га против 2, – 8 4,5 т/га – у озимого. В России озимый ячмень возделывают только на юге – в предгорьях Кавказа [5]. В 90-х годах прошлого столетия наиболее актуальное значение среди болезней ярового ячменя приобрели гельминтоспориозы, включающие в себя целый комплекс болезней, в частности, темно-бурую и сетчатую пятнистости, корневую гниль, «черный зародыш» зерна, а также ринхоспориоз, фузариоз. Прямые потери зерна ячменя, вызываемые этим патогенным комплексом, оцениваются в 20 – 50% и более [6].
Важным звеном в борьбе с болезнями сельскохозяйственных культур является внедрение в производство иммунных сортов. Однако эта работа в хозяйствах ведется крайне неудовлетворительно и новые сорта часто остаются неиспользованными.
Также неудовлетворительно ведутся работы по подготовке семенного материала. Зачастую посев проводится некондиционными семенами с низкими посевными качествами. Такие семена, попав в почву, очень долго не прорастают и являются источником питания для многих групп патогенов. Сформированный урожай имеет высокий процент обсеменения не только наружной, но и внутренней инфекции. Из-за финансовых затруднений до минимума снижены затраты на обработку семян химическими и биологическими препаратами [1].
Согласно утвержденному в России государственному стандарту, оригинальные и элитные семена не должны содержать головневую инфекцию. Однако из-за отсутствия должного контроля в виде фитоэкспертизы семян нередки случаи, когда даже элитные посевы все же содержат опасную инфекцию. Служба защиты растений осуществляет фитоэкспертизу семян с целью выявления реальной картины поражения семян и необходимости их протравливания. Однако уровень инфицированности семян грибами Bipolaris sorokiniana и Fusarium spp. и особенности их развития таковы, что не позволяют вводить какие-то пороги или ограничения при решении вопроса о целесообразности протравливания – все семена должны подвергаться обеззараживанию [7].
В контексте сказанного, мы, в условиях Челябинской области попытались выявить отдельные аспекты влияния черноты зародышей на хозяйственно – ценные признаки зерновых культур, а также эффективность применения некоторых препаратов.
Обзор литературы
Корневые гнили
Корневые гнили зерновых культур в настоящее время получили повсеместно широкое распространение. Поражаются как озимые, так и яровые культуры в течение всего вегетационного периода [8]. Видовой состав возбудителей корневых гнилей, как правило, приурочен к определенным эколого-географическим районам и чаще носит смешанный характер. Так, фузариозно-гельминтоспориозная корневая гниль с преобладанием видов p. Fusarium встречается в районах возделывания озимой пшеницы (Центрально – Черноземный район, Краснодарский и Ставропольский края, Ростовская область), а гельмин-тоспориозно-фузариозная с преобладанием гриба Bipolaris sorokiniana – на яровых культурах (пшеница, ячмень) – в Нечерноземной зоне (Северо-Западный, Центральный, Волго-Вятский районы) и в зоне преимущественного выращивания яровой пшеницы от Поволжья до Приморского края [3]. Усиление болезни наблюдается в условиях орошаемого земледелия.
Корневые гнили – это группа болезней пшеницы, ржи и ячменя со сходными признаками [9]. К ним относятся поражения всех подземных частей растений и гниль корневой шейки (узла кущения) до первого междоузлия стебля. Возникают они при неблагоприятных условиях для роста и развития растений.
Корневая гниль яровой пшеницы вызывается главным образом различными видами грибов из рода Fusarium и грибом Helminthosporium sativum. На пораженных корнях и корневой шейке встречаются также другие, преимущественно сапрофитные грибы (альтернария, пенициллиум, триходерма, мукоровые и др.), которые следует рассматривать как вторичных спутников болезненного процесса гнили корней. По основным возбудителям эти заболевания называют фузариозно-гельминтоспориозной корневой гнилью [10]. Для этого вида заболеваний характерно неравномерное распространение болезни по отдельным полям, причем сильно зараженные посевы могут граничить с относительно здоровыми. Основной источник инфекции – почва. Однако в годы с обильными осадками или в районах с влажным климатом возможна массовая передача инфекции через семена (гельминтоспориоз и фузариоз). Эпифитотиям корневых гнилей обычно предшествует длительный предэпифитотийный период, в течение которого происходит накопление инфекции в почве. Предпосылкой обычно служит перенасыщение севооборотов зерновыми культурами, восприимчивыми к заболеванию, а также погодные условия, способствующие сохранению почвенной инфекции. В таких условиях эпифитотии могут принимать хронический характер и повторяться ежегодно без существенных колебаний в распространении [9].
Болезнь внешне проявляется в виде побурения корней, подземного междоузлия, узла кущения, основания стебля. Корневые гнили могут вызывать гибель всходов, отставание растений в росте, щуплость колоса или полное отмирание продуктивных стеблей. Как правило, поражение и гибель проростков вызывает семенная инфекция, а отмирание продуктивных стеблей – почвенная [3].
Исследованиями К.Г. Кривовой и А.Н. Нестерова установлено, что основным возбудителем корневой гнили яровой пшеницы и ячменя в Северном Казахстане является гриб Helminthosporium sativum P.K. et. B. [11, 8].
Позднее было установлено, что на пшенице, ржи и ячмене развивается три вида возбудителей гельминтоспориозов – Bipolaris sorokiniana Shoemaker, Drechslera graminea Jto, Drechslera teres Jto (приложение А). Первый вид вызывает корневые гнили, щуплость и почернение зародыша (черный зародыш) всех перечисленных культур. Последующие два вида поражают ячмень, вызывая полосатую и сетчатую пятнистости. Все виды развиваются на семенах и резко снижают их посевные качества [12].
На ячмене это заболевание проявляется в течение всей вегетации. Патогены могут поражать проростки, которые буреют, деформируются и часто гибнут еще под землей. Сильно пораженное зерно теряет всхожесть. У больных растений наблюдается побурение колеоптиля, корневой шейки, первого влагалищного листа. Молодые растения с незначительными поражениями при благоприятных условиях справляются с инфекцией и впоследствии нормально развиваются, а при неблагоприятных условиях и сильном поражении растения могут погибнуть. В фазе трубки возбудители поражают подземное, первое надземное междоузлие и первый узел. В этой фазе вегетации болезнь наиболее опасна в связи с тем, что происходит нарушение взаимосвязи подземной (корни) и надземной части растений. При этом замедляются рост и развитие растений, что приводит к снижению веса зерна в колосе, отмиранию стеблей и белоколосости. По К.Г. Кривовой потери урожая от корневых гнилей в Северном Казахстане, в среднем, составляют 14–15%, что превышает потери от всех болезней, вместе взятых. Порог вредоносности корневой гнили на хлебных злаках составляет 5% в начале вегетации и 30% развития гельминтоспориозной гнили ячменя во время цветения [11, 13].
В ряде районов Алтая и Западной Сибири потери урожая составляют не менее 15%, при этом масса 1000 зерен снижается на 32 – 35%. В среднем вред от заболевания на яровой пшенице оценивается в 1,1 – 1,6% на каждый процент развития болезни после превышения порога вредоносности. На 40% может снижаться всхожесть семян [5].
Многочисленные литературные источники указывают на достаточно широкий спектр возбудителей корневой гнили пшеницы. Ранее в их числе называли представителей рода Helminthosporium, Fusarium, Ophiobolus, Cercosporella [14].
Для условий недостаточного увлажнения К.Г. Кривова и А.Н. Нестерова на пшенице выделили полупаразитарный гриб Helminthosporium sativum и некоторые виды рода Fusarium. Ряд авторов под руководством известного фитопатолога С.М. Тупеневича гриб Helminthosporium sativum называют основным возбудителем корневой гнили пшеницы. В руководстве для полевого определения болезней пшеницы, изданном по линии СИММИТ (2002) возбудителями болезни называют кроме Helminthosporium sativum и Fusarium также гриб Phytium [8, 11, 14].
В отношении ячменя указывается, что в Кустанайской области корневые гнили вызываются грибами родов Bipolaris и Drechslera [15]. По данным В.В. Постовалова в патогенном комплексе болезни ячменя в Курганской области превалируют виды родов Fusarium и Bipolaris sorokiniana. Исследования М.Н. Ткаченко показали еще более широкий состав возбудителей и сопутствующей микрофлоры корневой гнили ячменя в той же Курганской области – виды родов Fusarium, Helminthosporium, Altemaria, Penicillium, Rhizopus, Aspergillus, Tricho-thecium, но основными возбудителями признаются два возбудителя – Bipolaris sorokiniana и грибы рода Fusarium [16, 17].
Как уже отмечалось выше, Челябинская станция защиты растений в 2006 г. находит, что в комплексе патогенов, вызывающих корневые гнили в целом для зерновых культур преобладали грибы родов Alternaria, Helminthosporium, Fusarium, (Приложение А). С учетом этого обстоятельства мы обратили свое внимание на указанные объекты.
Патогенные свойства возбудителей обыкновенной корневой гнили обусловлены их способностью, вырабатывать гидролитические ферменты и токсины, например, Bipolaris sorokiniana – гельминтоспорол, гельминтоспорал, вик-токсин, цитокинин. При этом установлено, что метаболиты грибов оказывают токсическое воздействие на проростки и всходы в период активного роста мицелия при пониженной температуре (10–15 °С) и слабой концентрацией Сахаров в питательной среде (1 – 2%). Токсины Bipolaris sorokiniana можно отнести к регуляторам роста с высокой активностью [18].
Bipolaris sorokiniana развивается при температуре от 5–6 до 35–37 °С, оптимум 20 – 22 °С [14]. А максимальное заражение растений – происходит при температуре 15 °С и относительной влажности воздуха 95 – 98%. [4]. Интенсивное образование конидий начинается при относительной влажности воздуха 90% и температуре 22 – 28 °С.
Конидии при 22 – 24 °С образуются на четвертые сутки, а при 12 – 16 °С – на десятые. В ризосфере растений-хозяев под влиянием их корневых выделений температурные границы для прорастания конидий расширяются. Через 24 ч. 95% конидий проросло при температуре 3 – 5 °С. Конидии не теряют жизнеспособности в течение нескольких месяцев при минус 32 – 43 °С и даже при минус 50 °С поэтому хорошо переносят суровые сибирские зимы [18].
Мицелий и конидии являются основными формами размножения, распространения и перезимовки гриба. Весной мицелий трогается в рост и образует конидии. Заражение происходит внедрением мицелия и ростков прорастающих конидий в ткани корней и стеблей растения, где гриб образует эндогенный мицелий. Влажная погода способствует развитию конидиального спороношения в виде бархатистого налета на корнях, растительных остатках культуры и сорняков. Конидии аэрогенно или с каплями дождя разносятся на другие растения и в том числе, на формирующиеся колосья. Температура оптимум 19 – 26 °С обеспечивает грибу преимущественно более теплые зоны страны и большую вредоносность гриба в случаях более поздних сроков посева яровой пшеницы. Гриб хорошо развивается в почвах с реакцией от слабощелочной до нейтральной при влажности 60 – 80% от полной влагоемкости. Гельминтоспориоз наиболее активен на ослабленных растениях, которые гриб заражает в период прорастания семян и развития всходов. Распространяясь вверх по стеблю, гриб преимущественно локализуется в основании стебля и первом междоузлии. Патоген поражает пшеницу в течение всей вегетации пшеницы, а осенью и весной спороносит на стерне. Зимует гриб в сапрофитном состоянии на растительных остатках в почве. Сохраняется гриб также в виде конидий и хламидоспор в почве. При условии отсутствия минерализации растительных остатков, мицелий гриба способен сохранять свою жизнеспособность в течение 2–3 лет. Если в почве созданы условия для активных микробиологических процессов, то в течение вегетационного периода мицелий гельминтоспориоза почти полностью вытесняется из растительных остатков. Это фунгистатическое действие почвы сдерживает прорастание конидий патогена. Однако это фунгистатическое действие может сниматься воздействием корневых выделений вегетирующих растений, и тогда конидии гельминтоспориоза активно прорастают. Вот почему необходимо соблюдать правильный севооборот для очищения почвы от инфекции [14]. На перезимовавших пораженных остатках растений гриб может образовывать псевдотеции с сумками и сумкоспорами. В этой стадии его называют Cochliobolus sativum Drechsl. Болезнь вызывает нарушение физиолого-биологических функций растений – снижение содержания в листьях хлорофилла, изменение состава аминокислот, длительное содержание роста растений, ослабление минерального питания. Эти нарушения являются причиной снижения зерновой продуктивности растений и ухудшения качества зерна [4]. Helminthosporium sativum – паразит с широкой специализацией. Он поражает более 65 видов растений семейства злаковых, (мятликовых), особенно ячмень, твердые пшеницы, затем мягкую пшеницу. Очень слабо гриб поражает овес и практически не поражает кукурузу, просо, гречиху, подсолнечник, горох, люцерну и эспарцет. Заметим здесь, что в первые годы почвы целины были практически свободны от патогена [14].
В связи с тем, что на одном и том же поле различные растения могут быть поражены с одной стороны конкретными патогенами, а с другой – их комплексом, то и болезнь часто не имеет ярко выраженных симптомов, присущих лишь одному из патогенов. Поэтому симптомы проявления болезни часто даются под общим названием «обыкновенная корневая гниль».
Согласно международной ассоциации селекционных учреждений (СИМ-МИТ 2002 г.) при поражении гельминтоспориозом и фузариозом основание стебля, узловые корни темнеют и становятся коричневыми. Заболевание может выразиться белоколосостью, заметной еще до наступления зрелости зерна. Отдельные пораженные растения полегают. Поражение до или после всходов (раннее поражение) вызывает гибель всходов. В целом полевая идентификация болезни затруднена, так как разные грибы могут поражать различные части растений.
Согласно атласу проявления болезней [15] корневая гниль злаков проявляется в виде слабого кущения, увядания листьев отмирания стеблей. Зерно щуплое. Болезнь развивается очагами. Однако наиболее полно симптоматика поражения яровой пшеницы корневой гнилью описана в более раннем источнике [16]. Так, семенная инфекция поражает проростки, которые приобретают бурую окраску и на 5 – 6-й день могут погибать, не выходя на поверхность почвы. Если же инфекция находится на поверхности семян или гриб перезимовал на растительных остатках в почве, то болезнь всходов проявляется на 15 – 20 день и часто с незначительным поражением первичных (зародышевых) корней и колеоптиле. Один из признаков поражения – изменение окраски узла кущения и основания стебля – в коричневый цвет. Растение может погибнуть. Наиболее опасно, когда болезнь поражает подземное, первое надземное междоузлие и первый узел. В этом случае у растений нарушается связь надземной части с корневой системой. В результате наблюдается невыколашивание, отмирание отдельных стеблей, белоколосица, образование мелкого колоса без зерна. В благоприятных условиях Helmin-thosporium sativum поражает листья (бурая пятнистость) и зерно нового урожая.
Сообщения о крупных эпифитотиях указанных возбудителей отсутствуют. Однако многие источники указывают на значительные потери в результате изреженности стеблестоя, снижения продуктивной кустистости, озерненности колоса и массы зерна. Так, у СМ. Тупеневича мы находим, что коэффициент корреляции между развитием корневой гнили и снижением продуктивной кустистости равен +0,60.
Недобор зерна по разным предшественникам от поражения яровой пшеницы корневой гнилью составлял 4,8 – 6,6%. В 60-х годах прошлого столетия недобор зерна по разным источниками составлял 14,7 – 29,6% от контроля. При сильном развитии базального бактериоза недобор урожая может достигать 20% и более [4, 15].
Часть основных и боковых корней под влиянием B. sorokiniana погибает [17], вследствие чего обеспеченность растений корнями снижалась на 15 -85%.
При поражении эпикоптиля болезнью в слабой степени зерновая продуктивность растений уменьшалась на 11 – 25%, а в средней – на 42 – 67%. Значит, обыкновенная гниль эпикоптиля – самое уязвимое звено в системе растения как организма, существенно снижающее зерновую продуктивность яровой пшеницы. При поражении основания стебля обыкновенной гнилью зерновая продуктивность яровой пшеницы снижалась на 15,2%.
Для яровой пшеницы порог вредоносности варьирует в среднем от 2,5 до 6%, а для ячменя – от 2 до 5, т.е. примерно в тех же пределах [17].
Базальный бактериоз
Возбудители – Pseudomonas ramonicum Schn. et Iluchina и Ervinia caroto-vora Hoi. – грамотрицательные палочки. Болезнь обнаружена во многих районах страны, преимущественно на пшенице, реже на других злаках. Это подвижные, полиморфные грамотрицательные палочки с полярными жгутиками. Бактерии растут при температуре от 2 до 37 °С (оптимум 25 – 30 °С), но при 48 °С погибают в течение 10 минут. [4]. Поражают колос и зерно, листья и стебли. На колосе чернеют основания колосковых чешуи. Черные пятна появляются сбоку колосковой чешуи, может чернеть вся колосковая чешуя. На зерновке часто чернеет зародыш. На листьях появляются водянистые, постепенно темнеющие пятна [22]. При сильном развитии болезни наблюдается карликовость стеблей, сухая гниль оберточного листа, побурение колеоптиля, сплошные почернения колосковых чешуи, зерна чернеют у основания с покраснением остальной части.
Наибольшая вредоносность базального бактериоза отмечается в годы с пониженной температурой и повышенной влажностью в летний период. При сильном его развитии растения преждевременно теряют часть листьев, а зерна делаются щуплыми, всхожесть их снижается [4]. В этих случаях недобор урожая может достигать 20% и более [21]. В связи с изложенным мы сочли целесообразным выявить вредоносность черноты зародышей зерновых культур в условиях северной лесостепи и эффективность некоторых препаратов, обычно рекомендуемых для подавления возбудителей корневых гнилей в условиях умеренно-засушливой степи Челябинской области.
Экспериментальная часть
Цель и задачи исследований
Целью исследований является изучение фитопатологической обстановки в основных зерносеющих районах Челябинской области и возможности снижения проявления болезни на примере яровой пшеницы и ячменя, ржи и других зерновых культур.
В этой связи нами поставлено три задачи:
1 Выявить распространённость черноты зародыша яровой пшеницы, ржи, ячменя;
2 Выявить эпифитотийную обстановку по корневым гнилям;
3 Определить уровень экономической эффективности применения средств защиты растений.
Объекты исследований
Объекты исследования – грибы рода р. Аlternaria, p. Fusarium, p. Helmintosporium, Плесневение, Бактериозы. Исследования проведены в Челябинской области, данные исследования за 2005 г., 2006 г., 2007 г., 2008 г., 2009 г.
Методика исследований
Нами проведена обработка материала по отчёту СТАЗР (2006 г.). Работа этой организации выполнялась по методикам ВНИИФ (Всероссийский научно-исследовательский институт фитопатологии), которые включают в себя фито-патологический анализ семян зерновых культур на зараженность возбудителями черноты зародыша корневых гнилей (ГОСТ 12044–81) [18].
Партии для определения зараженности семян болезнями отбирали по ГОСТу 12036–85. Масса партии пшеницы и ячменя составляла не более 60 т.
Среднюю пробу для определения зараженности семян болезнями во влажной камере и на питательных средах отбирали в размере 200 г. и помещали в бумажный пакет или мешок из ткани. Внутрь вкладывали этикетку. Анализ проводили в рулонах фильтровальной бумаги [25, 24].
Из средней пробы, предназначенной для анализа семян на зараженность болезнями, выделяли навеску. Из семян основной культуры отбирали четыре рабочие пробы по 100 семян пшеницы и ячменя. Для проращивания семян использовали два слоя увлажненной до полной влагоемкости фильтровальной бумаги.
Анализировали четыре рабочих пробы по 100 семян, поэтому размер полосок фильтровальной бумаги для каждой пробы был 10 х 110 см (± 2 см). Фильтровальную бумагу перед анализом стерилизовали или проглаживали утюгом. Бумагу, перед раскладкой семян смачивали свежекипяченой водой. Раскладку семян проводили в условиях, обеспечивающих максимальную стерильность. Семена дезинфицировали в 0,5% растворе перманганата калия в течение 5 минут, потом их несколько раз промывали свежекипяченой остуженной водой. Семена раскладывали в одну линию с интервалом 1–2 см на расстоянии 2–3 см от верхнего и боковых краев бумаги зародышами вниз.
Разложенные на бумаге семена накрывали такой же полоской увлажненной фильтровальной бумаги и сворачивали в рулон. Ставили их в высокие стаканы или 2–3-х литровые банки, на дно наливали немного воды. В условиях высокой влажности и при температуре 24–26 °С семена проращивали. Анализировали один раз на 12-й день.
Под микроскопом просматривали полоску, срезанную с фильтровальной бумаги, с остатками мицелия возбудителей болезней.
По каждой из четырех проб подсчитывали количество семян, зараженных каждой болезнью и общее количество зараженных семян. Зараженность семян в процентах вычисляли по формуле [1].
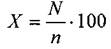 (1)
(1)
где N – суммарное количество зараженных семян в четырех пробах, шт.; п – общее количество семян, взятых для анализа, шт.
В настоящее время существует целый арсенал подавления возбудителей корневой гнили. Среди них обычно выдвигают химические меры защиты пшеницы и ячменя Витаваксом, Импактом, Винцитом, Премисом и др. В последние годы активно стали применять препараты – Дивиденд, Доспех, Виал ТТ, Триходермин, Фитоспорин, Интеграл, Планриз, Гумат калия д, Агат – 25К.
Эффективность некоторых из них проверено на опыте, проведенном в 2006 году в Брединском районе (Агрофирма «Калининская»). Агротехническая часть испытаний проводилась в соответствии с зональными рекомендациями по возделыванию яровой пшеницы. Площадь поля – 100 га. В опыте использовали сорт яровой пшеницы Эритроспермум 59. В таблице 1 представлена схема опыта.
Таблица 1 – Схема опыта по яровой пшенице в Брединском районе
В литрах на тонну
| Вариант | Препарат | Норма расхода препарата |
| 1 | Контроль | - |
| 2 | Доспех | 0,5 |
| 3 | Доспех | 0,4 |
| 4 | Дивиденд+Агат 25К | 1 +40г/т |
| 5 | Тебу 60 | 0,5 |
| 6 | Дивиденд микс | 0,75 |
| 7 | Дивиденд микс | 1,0 |
В Чебаркульском районе («ЧНИИСХ» Россельхозакадемии, п. Тимирязевский) закладка опыта производилась мелкоделяночным способом в 4-х повторностях на яровой пшенице и ячмене. Учет корневых гнилей проводился также по методике ВНИИФ. Для проведения опыта препараты были предоставлены фирмами: ООО Фирма «Сингента» (г. Москва), ООО «Агрорус и КО» (г. Москва), ЗАО Фирма «Август» (г. Москва), ЗАО «БиО БИЗ и КО» (г. Москва), ООО «Алсико – Агропром» (г. Москва), ЗАО «Торговый Дом Агрохимпром» (г. Барнаул). Схема опыта представлена в таблице 2.
Таблица 2 – Схема опыта по яровой пшенице и ячменю в Чебаркульском районе
В литрах на тонну
| Вариант | Препарат | Норма расхода препарата | |
| яровая пшеница | ячмень | ||
| 1 | Контроль | - | - |
| 2 | Дивиденд стар | 1,0 | 1,0 |
| 3 | Стингер | 0,5 | 0,5 |
| 4 | ВиалТТ | 0,4 | 0,4 |
| 5 | Бинорам | 0,70 | 0,70 |
| 6 | Доспех | 0,5 | 0,5 |
| 7 | Агат 25К | 40 г./т | 40 г./т |
В течение вегетационного периода проводили три учета корневых гнилей:
- первый – фаза всходы (9 июля);
- второй – фаза конец цветения (26 июля);
- третий – фаза восковая спелость (18 августа).
При учетах в 20 точках по диагонали поля отбирали пробы по 10–20 растений в каждой.
Образцы промывали водой, подсчитывали количество погибших, пораженных и здоровых растений. Для учета интенсивности поражения растений мы использовали единую шкалу [9].
0 – признаки болезни отсутствуют;
1 – единичные штрихи, слабое побурение колеоптиле или подземного междоузлия;
2 – сильное побурение подземного междоузлия или основания стебля и узловых корней;
3 – сильное почернение подземного междоузлия, поражение корней, основания стебля, трухлявость;
4 – полное отмирание растений.
Далее находили интенсивность развития заболевания в учетной точке, а потом уже и на поле. Также определяли распространенность болезни, и потери урожая по шкале [15].
Интенсивность поражения рассчитывали по формулам (2, 3, 4):
1) Для определения интенсивности развития заболевания в учетной точке:
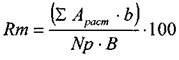 (2)
(2)
где Rm – интенсивность поражения в учетной точке, %; ΣА раст • b – сумма произведений количества пораженных растений на соответствующий балл пораженности; Np – общее число растений в учетной точке; В-высший балл шкалы учета.
2) Для определения развития заболевания на поле:
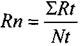 (3)
(3)
где Rn – интенсивность поражения на поле, %; ΣRt – арифметическая сумма процента интенсивности поражения в точках, %; N t – количество учетных точек.
По интенсивности развития болезни определяли потери урожая [2].
3) Распространенность болезни определяли по формуле:
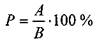 (4)
(4)
где Р – распространенность болезни, %; А – число продуктивных стеблей в пробе; В-общее число пораженных стеблей [9].
Полевой опыт был заложен в полном соответствии с методикой Госсортосети (1985 год) с использованием малогабаритных сеялок, комбайнов и семяочистительной техники.
Результаты исследований
Меры борьбы с болезнью
Ограничению развития патогенных грибов способствует протравливание семян. Процент протравленных семян к высеянным семенам в области варьирует по годам от 54 до 82,6. Всего протравлено в 2008 году 196,6 тыс. т семян (таблица 8).
Таблица 8 – Процент протравленных семян за 2008 г.
| Наименование культур | Всего семян в наличие, ц/га | Протравлено, % | ||
| Всего | Химическими средствами | Биологическими средствами | ||
| Яровая пшеница | 142,2 | 137,0825 | 125,7655 | 11,317 |
| Яровой ячмень | 51,16 | 47,532 | 44,148 | 3,384 |
| Овес | 15,32 | 11,338 | 10,939 | 0,399 |
| Озимая пшеница | 0 | 0 | 0 | 0 |
| Озимый ячмень | 0 | 0,349 | 0,349 | 0 |
| Озимая рожь | Нет данных | 0,349 | 0,349 | 0 |
Однако проведение протравливания семян остается малодоступным приемом многим сельхозпроизводителям из-за их финансовой несостоятельности. Во многих хозяйствах нет средств на приобретение протравителей и протравочных машин, парк которых ежегодно ветшает. Да и при протравливании зачастую нарушается норма расхода препарата, чаще в сторону ее занижения.
В основном в хозяйствах области для протравливания используют приставки к погрузчикам и самодельно оборудованные на базе. Качество протравливания из-за неравномерного нанесения протравителя на зерно в этих аппаратах низкое.
Полученные данные имеют важное практическое значение и указывают на необходимость защиты семян от болезни посредством специальных препаратов.
Экономическая эффективность
Сложные экономические условия, в которых оказались хозяйства аграрного сектора в последнее время, ухудшили условия выращивания зерновых культур (ограниченный выбор предшественника, рост засоренности посевов, нарушение сроков и качества обработки почвы, снижение объемов переходящих семенных фондов и обеспеченности растений основными элементами питания, а также объемов протравливания, и как следствие – тяжелая фитопатологическая ситуация в посевах).
В ходе работы была проанализирована экономическая эффективность мероприятий, направленных на подавление развития и распространения корневых гнилей на яровой пшенице.
Для определения экономической эффективности использовали следующие показатели: затраты на производство продукции, себестоимость 1 т зерна, валовая прибыль, экономический эффект и рентабельность производства продукции (таблица 9).
Расчет стоимости полученного урожая производили исходя из цены реализации яровой пшеницы 6000 рублей за 1 тонну. Расчёт показателей экономической эффективности приведён в таблице 9.
Таблица 9 – Расчёт экономической эффективности применения средств химизации
| Показатель | Контроль | Виал-ТТ |
| 1. Урожайность, т/га | ||
| 2. Затраты труда, чел.-ч: | ||
| на 1 га | ||
| на 1 т | ||
| 3. Прямые затраты на 1 га, руб. | ||
| 4. В том числе все затраты на применение средств химизации и уборку дополнительного урожая, руб. | ||
| 5. Прибавка урожая, т/га | ||
| 6. Стоимость валовой продукции с 1 га, руб. | ||
| 7. Стоимость прибавки с 1 га, руб. | ||
| 8. Себестоимость 1 т. продукции, руб. | ||
| 9. Чистый доход с 1 га, руб. | ||
| 10. Дополнительный чистый доход с 1 га, руб. | ||
| 11. Производительность труда, руб./чел.-ч | ||
| 12. Рост производительности труда, % | ||
| 13. Окупаемость затрат, руб./руб. | ||
| 14. Окупаемость дополнительных затрат, руб./руб. | ||
| 15. Рентабельность, % | ||
| 16. Рентабельность дополнительных затрат, % |
По данным таблицы 9 видно, что материально-денежные затраты по сравнению с контролем возросли на рублей. Наибольший чистый доход получен с применением протравителя. Рентабельность в варианте с применением препарата Виал-ТТ выше на % по сравнению с контролем. Таким образом, применение протравителя Виал-ТТ с нормой расхода 1 л/т является экономически эффективным.
Охрана труда
Охрана окружающей среды
Все виды сельскохозяйственных работ так или иначе взаимосвязаны с окружающей средой. Эрозия почв, истощение и загрязнение водных источников, засоление земель, образование подвижных песков и оврагов, снижение содержания гумуса и основных элементов минерального питания растений в почвах сельскохозяйственных угодий, повышение кислотности почв, ухудшение состояния сельскохозяйственных земель – все это представляет важные проблемы, связанные с невосполнимым ущербом, наносимым ресурсам и окружающей среде.
Значительный ущерб водным ресурсам, как поверхностным, так и надземным и подземным, наносят значительные склады минеральных и органических элементов в виде удобрений, ядохимикатов и пестицидов, а также горючесмазочных материалов, на которых нарушаются регламенты их хранения и транспортировки. Для окружающей среды большую опасность представляют продукты сгорания топлива сельскохозяйственной техники, эксплуатационные и технологические разливы топливно-смазочных материалов.
Охрана земель включает систему организационных, экономических, правовых, инженерных и других мероприятий, направленных на защиту земель от необоснованных изъятий из сельскохозяйственного оборота, вредных антропогенных и природных воздействий в целях повышения эффективности природопользования и создания благоприятной экологической обстановки.
Охрана земель и их рациональное использование осуществляется на основе комплексного подхода к угодьям, как и к сложным природным образованиям, с учетом их зональных и региональных особенностей. Система рационального использования земель носит природоохранительный ресурсосберегающий характер и предусматривает сохранение почв, ограничение воздействия на растительный и животный мир, геологические породы и другие компоненты окружающей среды.
Выводы
1 Изучение комплекса возбудителей, обуславливающих проявление черноты зародыша семян зерновых культур в условиях Челябинской области, показало, что, ежегодно вся масса семян инфицирована возбудителями черноты зародыша и корневой гнили грибами рода Fusarium, Alternaria, Helmintosporium. При этом основным патогенном является гриб Alternaria. Таким образом, становится очевидным, что весь семенной фонд пшеницы и ячменя в Челябинской области нуждается в защите от корневых гнилей.
2 Опыты станции защиты растений показали, что в условиях степи Челябинской области защита сорта яровой пшеницы Эритроспермум 59 от корневой гнили посредством обработки семян такими препаратами как Дивиденд микс с нормой расхода 0,75 – 1,0 л/т, Доспех с нормой расхода 0,4 – 0,5 л/т, Агат 25К+Дивиденд микс с нормой расхода 40 г./т и 1,0 л/т приводит к получению положительного эффекта.
Более эффективен Дивиденд микс с нормой расхода 1,0 л/т.
3 Экономические расчеты показали, что в сравнении с контролем использование препарата Дивиденд микс с нормой расхода 1,0 л/т оправдывает расходы на применение. Прибавка урожая составила 0,41 т/га.
Рекомендации производству
На основании полученных результатов, можно считать, что наилучшим вариантом в подавлении комплекса возбудителей черноты зародыша и корневой гнили зерновых культур Челябинской области является препарат Дивиденд микс. Целесообразно использовать препарат с нормой расхода 1 л/т.
Список литературы
1. Интеграл – высокоэффективный биологический препарат комплексного действия / К.К. Сатубалдин, М.Я. Менликиев, Л.А. Сангинас, С.Б. Никитин. – Екатеринбург: ЗАО научно производственная система «Элита-комплекс», 2002. – С. 3–4.
2. Фитосанитарная экспертиза зерновых культур / С.С. Санин, В.И. Черкашин, Л.Н. Назарова, Е.А. Соколова. – М.: ФГНУ «Росинформагротех», 2002. – 140 с.
3. Долженко В.И., Котикова Г.Ш., Здрожевская С.Д. Средства защиты растений для предпосевной обработки семян / В.И. Долженко, Г.Ш. Котикова, С.Д. Здрожевская. – Санкт-Петербург: Всероссийский НИИ защиты растений (ВНИИ), 2001. – 54 с.
4. Пересыпкин В.Ф. Сельскохозяйственная фитопатология / В.Ф. Пересыпкин. – М.: Агропромиздат, 1989. – 480 с.
5. Грибные болезни зерновых культур / М.М. Левитин, С.Л. Тютерев // Защита и карантин растений. – 2003. – №11. – С. 48.
6. Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность / В.А. Зинченко. – М.: КолосС, 2006. – 232 с: ил.
7. Буга С.Ф. Роль протравливания семян / С.Ф. Буга // Защита и карантин растений. – 2004. – №3. – С. 21.
8. Нестеров А.Н. Изучение путей повышения эффективности комплекса агротехнических мероприятий в борьбе с корневой гнилью яровой пшеницы в условиях Северного Казахстана / Нестеров А.Н.: автореф. дис. канд. с.-х. наук. – Л., 1975. – 21 с.
9. Информационное обеспечение прогнозов распространения и развития многоядных вредителей и болезней зерновых культур и картофеля / А.Ф. Ченкин, В.П. Блинова, А.С. Воловик, В.Ф. Дьяченко, Т.Ю. Федулова, В.Е. Ажбенов. – М: Центр научно-технической информации пропаганды и рекламы, 1993. – 50 с.
10. Грушева С.Е. Сельскохозяйственная фитопатология / С.Е. Грушева. – М.: Колос, 1995. – 447 с.
11. Кривова К.Г. Устойчивость и выносливость корневой гнили пшеницы к возбудителю Helminthosporium sativum в условиях Кустанайской области / Кривова К.Г.: автореф. дис. канд. с.-х. наук. – Л., 1972. – 28 с.
12. Семенов А.Я., Потлайчук В.И. Болезни семян полевых культур / А.Я. Семенов, В.И. Потлайчук. – Л.: Колос, 1982. – 127 с.
13. Грязнов А.А. Ячмень Карабалыкский (корм, крупа, пиво) / А.А. Грязнов. – Кустанай: Кустанайский печатный двор, 1996. – 446 с.
14. Тупеневич С.М. Корневые гнили яровой пшеницы / С.М. Тупеневич. – Л.: Колос, 1974. – 63 с.
15. Станчева И. Атлас болезней сельскохозяйственных культур. Болезни полевых культур / И. Станчева. – М.: София, 2003. – С. 37–38.
16. Пономарева Л.А. Гельминтоспориозные болезни ячменя и система мероприятий по защите его посевов степной зоне Северо-Западного Казахстана / Пономарева Л.А.: автореф. дис. канд. с.-х. наук. – Алматы, 2000. – 21 с.
17. Чулкина В.И. Корневые гнили хлебных злаков в Сибири / В.И. Чулкина. – Новосибирск: Наука, 1985. – 187 с.
18. Отчеты о работе ФГУ «Федеральная государственная территориальная станция защиты растений в Челябинской области» за 2006 г.
19. Постовалов А.А. Реакция ризосферных микроорганизмов и возбудите лей корневой гнили ячменя на минеральные удобрения и биопрепараты в условиях лесостепи Зауралья / Постовалов А.А.: автореф. дис. канд. с.-х. наук. – Курган, 2004. – 19 с.
20. Ткаченко М.Н. Приемы защиты ярового ячменя от гельминтоспориозной корневой гнили и темно-бурой пятнистости листьев в условиях Курганской области / Ткаченко М.Н.: автореф. дис. канд. с.-х. наук. – Курган, 2004. – 19 с.
21. Пересыпкин В.Ф. Атлас болезней полевых культур / В.Ф. Пересыпкин. – Киев: Урожай, 1981. – 240 с.
22. Шкаликова В.А. Практикум по сельскохозяйственной фитопатологии / В.А. Шкаликова. – М.: КолосС, 2002. – 205 с.
23. Панфилов А.Э. Общая и сельскохозяйственная фитопатология (курс лекций) / А.Э. Панфилов. – Челябинск, ЧГАУ. 2000. – 142 с.
24. Ишкова Т.И. Диагностика основных грибных болезней хлебных злаков / Т.И. Ишкова, Л.И. Берестецкая, Е.Л. Гасич. – Санкт-Петербург, 2002. – 76 с.
25. ГОСТ 12044–93. Семена сельскохозяйственных культур. Методы определения зараженности болезнями. – Минск: ИПК Издательство стандартов, 1995. – 87 с.
26. Безопасность жизнедеятельности на производстве (охрана труда): учебник для вузов. Г.И. Беляков. – СПб.: Лань, 2006. – 512 с: ил.
27. Шкрабак В.С. Безопасность жизнедеятельности в сельскохозяйственном производстве / В.С. Шкрабак, А.В. Луковников, А.К. Тургиев. – М.: КолосС, 2004. – с. 512: ил.
28. Зотов Б.И., Курдюмов В.И. Безопасность жизнедеятельности / Б.И. Зотов, В.И. Курдюмов. – М.: Колос, 2003. – 432 с.
29. Шкрабак В.С., Казлаускас Г.К. Охрана труда / В.С. Шкрабак, Г.К. Казлаускас. – М.: Агропромиздат, 1989. – 480 с.: ил.
Введение
В последние годы вопросы защиты сельскохозяйственных растений в системе возделывания культур выдвигаются на передний план и являются особенно актуальными, так как уровень развития патогенной микрофлоры в почве и на семенном материале достиг критического значения. В семенном фонде большинства хозяйств, практически отсутствует здоровый материал, почти каждая партия семян в той или иной мере заражена различными патогенными микроорганизмами. Данная ситуация усугубляется из года в год, так как не соблюдаются основные элементы технологии возделывания культур [1].
Ежегодно только от болезней растений Россия теряет от 8,5 до 25 млн. т зерна, среднегодовое значение потерь за последние годы составляет 18,3 млн. т [2]. Известно, что через семена передается более половины всех болезней растений. Именно семена являются источником опасных и вредоносных заболеваний, наносящих существенный вред товарному производству. Поэтому во многих странах предпосевная обработка семян средствами защиты растений является не только необходимым, но и законодательно обязательным приемом защиты основных сельскохозяйственных культур от вредных организмов.
Сегодня практически нет незараженных семян и, в зависимости от погодных условий, в период вегетации семена могут быть заражены до 70%. Так, на ячмене преобладают Bipolaris sorokiniana (Sacc.) Shoemaker, виды родов Altemaria, Fusarium. Во влажные годы в общем комплексе грибов на семенах ячменя встречаемость Bipolaris sorokiniana может достигать 47,6%, видов р. А1-ternaria – 31,7%, p. Fusarium – 17,5%; на озимой пшенице – видов p. Alternaria – 51,7%, p. Fusarium – до 15%. Пораженность семян различных сортов яровой пшеницы находится в пределах 47,5 – 62,3%, из них p. Fusarium – 23 – 37,5%, р. Altemaria – 10 – 34,4% [3].
В повышении урожайности зерновых культур важное место принадлежит защите их от болезней, которые приводят не только к значительному снижению сбора зерна, но и к ухудшению его качества, а иногда и к гибели посевов [4].
Пшеница, ячмень, рожь и овес являются основными продовольственными и фуражными культурами нашей страны. Наиболее важной из них является пшеница, это основная продовольственная культура России. Посевы пшеницы занимают более 25 млн. га, ее ежегодные валовые сборы – 40 – 50 млн. т, в том числе товарного зерна – около 20 млн. т [5]. Выращивание этой культуры, в основном, сосредоточено в степной и лесостепной зонах страны с умеренным климатом.
Сдерживающим фактором повышения урожайности пшеницы являются паразитарные заболевания, среди которых особо вредоносны головневые, ржавчинные грибы, корневые гнили и мучнистая роса. В ряде районов с повышенной влажностью отмечается сильное развитие септориоза, фузариоза колоса и оливковой плесени. Нередко большой вред наносят бактериальные, вирусные и микоплазменные болезни. В отдельные годы пшеница страдает от непаразитарных заболеваний, являющихся следствием недостаточной засухоустойчивости и зимостойкости, а также от выпревания и вымокания. Причинами заболевания пшеницы могут также быть избыточная и недостаточная обеспеченность растений элементами питания, низкий уровень агротехники [4].
В нашей стране, в основном, распространены яровые сорта ячменя, поскольку они успевают созревать за короткое лето, хотя урожай ярового ячменя ниже, чем озимого, и составляет в разные годы от 1,2 до 1,8 т/га против 2, – 8 4,5 т/га – у озимого. В России озимый ячмень возделывают только на юге – в предгорьях Кавказа [5]. В 90-х годах прошлого столетия наиболее актуальное значение среди болезней ярового ячменя приобрели гельминтоспориозы, включающие в себя целый комплекс болезней, в частности, темно-бурую и сетчатую пятнистости, корневую гниль, «черный зародыш» зерна, а также ринхоспориоз, фузариоз. Прямые потери зерна ячменя, вызываемые этим патогенным комплексом, оцениваются в 20 – 50% и более [6].
Важным звеном в борьбе с болезнями сельскохозяйственных культур является внедрение в производство иммунных сортов. Однако эта работа в хозяйствах ведется крайне неудовлетворительно и новые сорта часто остаются неиспользованными.
Также неудовлетворительно ведутся работы по подготовке семенного материала. Зачастую посев проводится некондиционными семенами с низкими посевными качествами. Такие семена, попав в почву, очень долго не прорастают и являются источником питания для многих групп патогенов. Сформированный урожай имеет высокий процент обсеменения не только наружной, но и внутренней инфекции. Из-за финансовых затруднений до минимума снижены затраты на обработку семян химическими и биологическими препаратами [1].
Согласно утвержденному в России государственному стандарту, оригинальные и элитные семена не должны содержать головневую инфекцию. Однако из-за отсутствия должного контроля в виде фитоэкспертизы семян нередки случаи, когда даже элитные посевы все же содержат опасную инфекцию. Служба защиты растений осуществляет фитоэкспертизу семян с целью выявления реальной картины поражения семян и необходимости их протравливания. Однако уровень инфицированности семян грибами Bipolaris sorokiniana и Fusarium spp. и особенности их развития таковы, что не позволяют вводить какие-то пороги или ограничения при решении вопроса о целесообразности протравливания – все семена должны подвергаться обеззараживанию [7].
В контексте сказанного, мы, в условиях Челябинской области попытались выявить отдельные аспекты влияния черноты зародышей на хозяйственно – ценные признаки зерновых культур, а также эффективность применения некоторых препаратов.
Обзор литературы
Корневые гнили
Корневые гнили зерновых культур в настоящее время получили повсеместно широкое распространение. Поражаются как озимые, так и яровые культуры в течение всего вегетационного периода [8]. Видовой состав возбудителей корневых гнилей, как правило, приурочен к определенным эколого-географическим районам и чаще носит смешанный характер. Так, фузариозно-гельминтоспориозная корневая гниль с преобладанием видов p. Fusarium встречается в районах возделывания озимой пшеницы (Центрально – Черноземный район, Краснодарский и Ставропольский края, Ростовская область), а гельмин-тоспориозно-фузариозная с преобладанием гриба Bipolaris sorokiniana – на яровых культурах (пшеница, ячмень) – в Нечерноземной зоне (Северо-Западный, Центральный, Волго-Вятский районы) и в зоне преимущественного выращивания яровой пшеницы от Поволжья до Приморского края [3]. Усиление болезни наблюдается в условиях орошаемого земледелия.
Корневые гнили – это группа болезней пшеницы, ржи и ячменя со сходными признаками [9]. К ним относятся поражения всех подземных частей растений и гниль корневой шейки (узла кущения) до первого междоузлия стебля. Возникают они при неблагоприятных условиях для роста и развития растений.
Корневая гниль яровой пшеницы вызывается главным образом различными видами грибов из рода Fusarium и грибом Helminthosporium sativum. На пораженных корнях и корневой шейке встречаются также другие, преимущественно сапрофитные грибы (альтернария, пенициллиум, триходерма, мукоровые и др.), которые следует рассматривать как вторичных спутников болезненного процесса гнили корней. По основным возбудителям эти заболевания называют фузариозно-гельминтоспориозной корневой гнилью [10]. Для этого вида заболеваний характерно неравномерное распространение болезни по отдельным полям, причем сильно зараженные посевы могут граничить с относительно здоровыми. Основной источник инфекции – почва. Однако в годы с обильными осадками или в районах с влажным климатом возможна массовая передача инфекции через семена (гельминтоспориоз и фузариоз). Эпифитотиям корневых гнилей обычно предшествует длительный предэпифитотийный период, в течение которого происходит накопление инфекции в почве. Предпосылкой обычно служит перенасыщение севооборотов зерновыми культурами, восприимчивыми к заболеванию, а также погодные условия, способствующие сохранению почвенной инфекции. В таких условиях эпифитотии могут принимать хронический характер и повторяться ежегодно без существенных колебаний в распространении [9].
Болезнь внешне проявляется в виде побурения корней, подземного междоузлия, узла кущения, основания стебля. Корневые гнили могут вызывать гибель всходов, отставание растений в росте, щуплость колоса или полное отмирание продуктивных стеблей. Как правило, поражение и гибель проростков вызывает семенная инфекция, а отмирание продуктивных стеблей – почвенная [3].
Исследованиями К.Г. Кривовой и А.Н. Нестерова установлено, что основным возбудителем корневой гнили яровой пшеницы и ячменя в Северном Казахстане является гриб Helminthosporium sativum P.K. et. B. [11, 8].
Позднее было установлено, что на пшенице, ржи и ячмене развивается три вида возбудителей гельминтоспориозов – Bipolaris sorokiniana Shoemaker, Drechslera graminea Jto, Drechslera teres Jto (приложение А). Первый вид вызывает корневые гнили, щуплость и почернение зародыша (черный зародыш) всех перечисленных культур. Последующие два вида поражают ячмень, вызывая полосатую и сетчатую пятнистости. Все виды развиваются на семенах и резко снижают их посевные качества [12].
На ячмене это заболевание проявляется в течение всей вегетации. Патогены могут поражать проростки, которые буреют, деформируются и часто гибнут еще под землей. Сильно пораженное зерно теряет всхожесть. У больных растений наблюдается побурение колеоптиля, корневой шейки, первого влагалищного листа. Молодые растения с незначительными поражениями при благоприятных условиях справляются с инфекцией и впоследствии нормально развиваются, а при неблагоприятных условиях и сильном поражении растения могут погибнуть. В фазе трубки возбудители поражают подземное, первое надземное междоузлие и первый узел. В этой фазе вегетации болезнь наиболее опасна в связи с тем, что происходит нарушение взаимосвязи подземной (корни) и надземной части растений. При этом замедляются рост и развитие растений, что приводит к снижению веса зерна в колосе, отмиранию стеблей и белоколосости. По К.Г. Кривовой потери урожая от корневых гнилей в Северном Казахстане, в среднем, составляют 14–15%, что превышает потери от всех болезней, вместе взятых. Порог вредоносности корневой гнили на хлебных злаках составляет 5% в начале вегетации и 30% развития гельминтоспориозной гнили ячменя во время цветения [11, 13].
В ряде районов Алтая и Западной Сибири потери урожая составляют не менее 15%, при этом масса 1000 зерен снижается на 32 – 35%. В среднем вред от заболевания на яровой пшенице оценивается в 1,1 – 1,6% на каждый процент развития болезни после превышения порога вредоносности. На 40% может снижаться всхожесть семян [5].
Многочисленные литературные источники указывают на достаточно широкий спектр возбудителей корневой гнили пшеницы. Ранее в их числе называли представителей рода Helminthosporium, Fusarium, Ophiobolus, Cercosporella [14].
Для условий недостаточного увлажнения К.Г. Кривова и А.Н. Нестерова на пшенице выделили полупаразитарный гриб Helminthosporium sativum и некоторые виды рода Fusarium. Ряд авторов под руководством известного фитопатолога С.М. Тупеневича гриб Helminthosporium sativum называют основным возбудителем корневой гнили пшеницы. В руководстве для полевого определения болезней пшеницы, изданном по линии СИММИТ (2002) возбудителями болезни называют кроме Helminthosporium sativum и Fusarium также гриб Phytium [8, 11, 14].
В отношении ячменя указывается, что в Кустанайской области корневые гнили вызываются грибами родов Bipolaris и Drechslera [15]. По данным В.В. Постовалова в патогенном комплексе болезни ячменя в Курганской области превалируют виды родов Fusarium и Bipolaris sorokiniana. Исследования М.Н. Ткаченко показали еще более широкий состав возбудителей и сопутствующей микрофлоры корневой гнили ячменя в той же Курганской области – виды родов Fusarium, Helminthosporium, Altemaria, Penicillium, Rhizopus, Aspergillus, Tricho-thecium, но основными возбудителями признаются два возбудителя – Bipolaris sorokiniana и грибы рода Fusarium [16, 17].
Как уже отмечалось выше, Челябинская станция защиты растений в 2006 г. находит, что в комплексе патогенов, вызывающих корневые гнили в целом для зерновых культур преобладали грибы родов Alternaria, Helminthosporium, Fusarium, (Приложение А). С учетом этого обстоятельства мы обратили свое внимание на указанные объекты.
Патогенные свойства возбудителей обыкновенной корневой гнили обусловлены их способностью, вырабатывать гидролитические ферменты и токсины, например, Bipolaris sorokiniana – гельминтоспорол, гельминтоспорал, вик-токсин, цитокинин. При этом установлено, что метаболиты грибов оказывают токсическое воздействие на проростки и всходы в период активного роста мицелия при пониженной температуре (10–15 °С) и слабой концентрацией Сахаров в питательной среде (1 – 2%). Токсины Bipolaris sorokiniana можно отнести к регуляторам роста с высокой активностью [18].
Bipolaris sorokiniana развивается при температуре от 5–6 до 35–37 °С, оптимум 20 – 22 °С [14]. А максимальное заражение растений – происходит при температуре 15 °С и относительной влажности воздуха 95 – 98%. [4]. Интенсивное образование конидий начинается при относительной влажности воздуха 90% и температуре 22 – 28 °С.
Конидии при 22 – 24 °С образуются на четвертые сутки, а при 12 – 16 °С – на десятые. В ризосфере растений-хозяев под влиянием их корневых выделений температурные границы для прорастания конидий расширяются. Через 24 ч. 95% конидий проросло при температуре 3 – 5 °С. Конидии не теряют жизнеспособности в течение нескольких месяцев при минус 32 – 43 °С и даже при минус 50 °С поэтому хорошо переносят суровые сибирские зимы [18].
Мицелий и конидии являются основными формами размножения, распространения и перезимовки гриба. Весной мицелий трогается в рост и образует конидии. Заражение происходит внедрением мицелия и ростков прорастающих конидий в ткани корней и стеблей растения, где гриб образует эндогенный мицелий. Влажная погода способствует развитию конидиального спороношения в виде бархатистого налета на корнях, растительных остатках культуры и сорняков. Конидии аэрогенно или с каплями дождя разносятся на другие растения и в том числе, на формирующиеся колосья. Температура оптимум 19 – 26 °С обеспечивает грибу преимущественно более теплые зоны страны и большую вредоносность гриба в случаях более поздних сроков посева яровой пшеницы. Гриб хорошо развивается в почвах с реакцией от слабощелочной до нейтральной при влажности 60 – 80% от полной влагоемкости. Гельминтоспориоз наиболее активен на ослабленных растениях, которые гриб заражает в период прорастания семян и развития всходов. Распространяясь вверх по стеблю, гриб преимущественно локализуется в основании стебля и первом междоузлии. Патоген поражает пшеницу в течение всей вегетации пшеницы, а осенью и весной спороносит на стерне. Зимует гриб в сапрофитном состоянии на растительных остатках в почве. Сохраняется гриб также в виде конидий и хламидоспор в почве. При условии отсутствия минерализации растительных остатков, мицелий гриба способен сохранять свою жизнеспособность в течение 2–3 лет. Если в почве созданы условия для активных микробиологических процессов, то в течение вегетационного периода мицелий гельминтоспориоза почти полностью вытесняется из растительных остатков. Это фунгистатическое действие почвы сдерживает прорастание конидий патогена. Однако это фунгистатическое действие может сниматься воздействием корневых выделений вегетирующих растений, и тогда конидии гельминтоспориоза активно прорастают. Вот почему необходимо соблюдать правильный севооборот для очищения почвы от инфекции [14]. На перезимовавших пораженных остатках растений гриб может образовывать псевдотеции с сумками и сумкоспорами. В этой стадии его называют Cochliobolus sativum Drechsl. Болезнь вызывает нарушение физиолого-биологических функций растений – снижение содержания в листьях хлорофилла, изменение состава аминокислот, длительное содержание роста растений, ослабление минерального питания. Эти нарушения являются причиной снижения зерновой продуктивности растений и ухудшения качества зерна [4]. Helminthosporium sativum – паразит с широкой специализацией. Он поражает более 65 видов растений семейства злаковых, (мятликовых), особенно ячмень, твердые пшеницы, затем мягкую пшеницу. Очень слабо гриб поражает овес и практически не поражает кукурузу, просо, гречиху, подсолнечник, горох, люцерну и эспарцет. Заметим здесь, что в первые годы почвы целины были практически свободны от патогена [14].
В связи с тем, что на одном и том же поле различные растения могут быть поражены с одной стороны конкретными патогенами, а с другой – их комплексом, то и болезнь часто не имеет ярко выраженных симптомов, присущих лишь одному из патогенов. Поэтому симптомы проявления болезни часто даются под общим названием «обыкновенная корневая гниль».
Согласно международной ассоциации селекционных учреждений (СИМ-МИТ 2002 г.) при поражении гельминтоспориозом и фузариозом основание стебля, узловые корни темнеют и становятся коричневыми. Заболевание может выразиться белоколосостью, заметной еще до наступления зрелости зерна. Отдельные пораженные растения полегают. Поражение до или после всходов (раннее поражение) вызывает гибель всходов. В целом полевая идентификация болезни затруднена, так как разные грибы могут поражать различные части растений.
Согласно атласу проявления болезней [15] корневая гниль злаков проявляется в виде слабого кущения, увядания листьев отмирания стеблей. Зерно щуплое. Болезнь развивается очагами. Однако наиболее полно симптоматика поражения яровой пшеницы корневой гнилью описана в более раннем источнике [16]. Так, семенная инфекция поражает проростки, которые приобретают бурую окраску и на 5 – 6-й день могут погибать, не выходя на поверхность почвы. Если же инфекция находится на поверхности семян или гриб перезимовал на растительных остатках в почве, то болезнь всходов проявляется на 15 – 20 день и часто с незначительным поражением первичных (зародышевых) корней и колеоптиле. Один из признаков поражения – изменение окраски узла кущения и основания стебля – в коричневый цвет. Растение может погибнуть. Наиболее опасно, когда болезнь поражает подземное, первое надземное междоузлие и первый узел. В этом случае у растений нарушается связь надземной части с корневой системой. В результате наблюдается невыколашивание, отмирание отдельных стеблей, белоколосица, образование мелкого колоса без зерна. В благоприятных условиях Helmin-thosporium sativum поражает листья (бурая пятнистость) и зерно нового урожая.
Сообщения о крупных эпифитотиях указанных возбудителей отсутствуют. Однако многие источники указывают на значительные потери в результате изреженности стеблестоя, снижения продуктивной кустистости, озерненности колоса и массы зерна. Так, у СМ. Тупеневича мы находим, что коэффициент корреляции между развитием корневой гнили и снижением продуктивной кустистости равен +0,60.
Недобор зерна по разным предшественникам от поражения яровой пшеницы корневой гнилью составлял 4,8 – 6,6%. В 60-х годах прошлого столетия недобор зерна по разным источниками составлял 14,7 – 29,6% от контроля. При сильном развитии базального бактериоза недобор урожая может достигать 20% и более [4, 15].
Часть основных и боковых корней под влиянием B. sorokiniana погибает [17], вследствие чего обеспеченность растений корнями снижалась на 15 -85%.
При поражении эпикоптиля болезнью в слабой степени зерновая продуктивность растений уменьшалась на 11 – 25%, а в средней – на 42 – 67%. Значит, обыкновенная гниль эпикоптиля – самое уязвимое звено в системе растения как организма, существенно снижающее зерновую продуктивность яровой пшеницы. При поражении основания стебля обыкновенной гнилью зерновая продуктивность яровой пшеницы снижалась на 15,2%.
Для яровой пшеницы порог вредоносности варьирует в среднем от 2,5 до 6%, а для ячменя – от 2 до 5, т.е. примерно в тех же пределах [17].
Грибы рода Alternaria – как одна из причин чернозародышевости семян
Зерно пшеницы часто поражается грибами рода Alternaria, которые вызывают так называемую «черноту зародыша», такие семена имеют темно-коричневую окраску зародыша. Иногда эта темная полоса тянется вдоль нижней стороны на бороздке семени до его вершины. Внешне это вполне здоровые семена – хорошо выполнены, гладкие, блестящие. Исследованиями установлено, что грибы этого рода заражают нормально выполненное крупное зерно, часто с высокой массой. Семенные качества такого зерна не снижаются или снижаются незначительно. И далее дается достаточно определенное заключение, что грибы рода Alternaria на зерне пшеницы как фактор развития коневой гнили практически значения не имеют. Здесь же мы находим что побурение зародыша может вызывать также Helminthosporium sativum.
По СМ. Тупеневичу Alternaria наравне с Penicillium и Aspergillus лишь сопутствует основным возбудителям корневой гнили пшеницы, а в патогенезе болезни самостоятельного значения не имеет [15].
Однако данные Челябинской станции защиты растений (СТАЗР) говорят об обратном. Альтернариоз на посевах пшеницы проявляется в период цветения растений и молочной спелости зерна в виде темных пятен на колосковых чешуйках. Позже, во время дозревания зерна, наблюдается почернение зародыша («черный зародыш») [18].
Возбудителем является Alternaria alternata (Fr.) Keissl.
Syn.: Altemaria tenuis Fr., Altemaria botryospora, Altemaria state of Pleo-spora infectoria F., Altemaria grossulariae Jacz., Altemaria lini Dey.
Грибы рода Altemaria образуют на семенах паутинистый мицелий, придающий им темно-серый цвет. Часто на зародышевой части развивается темно-оливковый налет, состоящий из конидиеносцев и конидий. Конидии оливковые или черно-бурые, обратно-булавовидные, а в цепочках, с 3 – 6 поперечными перегородками и с одной или несколькими продольными перегородками, длиной 30–50 мкм и шириной 14–18 мкм, неодинаковой формы, чаще цилиндрические или овальные. Гриб отмечен на семенах всех культур повсеместно [19].
Возбудитель – несовершенный гриб Altemaria tenuis Fr. проникает внутрь семян, а его грибница скапливается преимущественно в плодовой оболочке и только иногда достигает эндосперма. Пораженное зерно, как правило, крупное, хорошо выполненное, чем отличается от пораженного гельминтоспориозом.
Значительной распространение альтернариоза бывает в годы с высокой температурой (выше 24 °С) и влажностью воздуха в период цветения пшеницы и молочной спелости зерна. Семена, пораженные альтернариозом, физиологически недоразвиты. Они имеют низкую энергию прорастания и всхожесть. Растения, выращенные из таких семян, отстают в росте и развитии, вследствие чего понижается урожайность.
Мука из зерна с «черным зародышем» имеет темноватый цвет и низкие хлебопекарные качества [20]. Поэтому вредоносность черноты зародыша может заключаться не только в снижении всхожести семян, но и в снижении закупочных цен на такое зерно.
Кривова К.Г. установила зависимость всхожести семян от степени изменения окраски их зародыша. Семена пшеницы и ячменя она разделила на три фракции:
I – зародыш и зародышевые углубления зерна полностью окрашены – всхожесть снижается на 37%;
II – окрашены половина зародыша и часть зерна за его пределами – всхожесть снижается на 63%;
III – чернота по всему зерну – всхожесть снижается на 84% [11].
СИММИТ (2002 г.) указывает, что черный зародыш зерна сможет быть вызван всеми тремя родами грибов – Alternaria, Helminthosporium sativum, Fusarium. В этом случае симптомы поражения выражены в виде окрашивания околоплодника (перикарпия) созревающего зерна в зародышевой части зерна. При этом, если зерно поражено грибом Alternaria, то темнеет только перикарпий зародыша, а при заражении грибами Helminthosporium и Fusarium погибает весь зародыш.
Причиной черного зародыша могут быть другие патогены. Так, И. Станчева указывает на базальный бактериоз пшеницы, как на причину черного зародыша. Сильно пораженные семена не всходят, при прорастании из них выделяется беловатый экссудат. Возбудителем является бактерия Pseudomonas syringae pv. afrofaciens. Патоген чаще всего сохраняется в семенах, реже в растительных остатках. Во время вегетации растения бактерия переносится каплями воды, насекомыми или контактно между растениями. Развитие их происходит при температуре от 2 до 37 °С (оптимум 25–38 °С), но при 48 – 49 °С они погибают в течении 10 минут. При сильном развитии болезни наблюдаются карликовость стеблей, сухая гниль оберточного листа, побурение колеоптиле, сплошные почернения чешуек колосков, зерна чернеют у основания, а остальная часть их краснеет [20, 21].
Возбудителем может быть комплекс грибов Alternaria alternata Nees et Fr., Alternaria tenuis Nees et Fr., Bipolaris sorokiniana Shoem., Drechslera teres Jto. Наиболее опасно поражение грибами Bipolaris sorokiniana и Drechslera teres.
При поражении колосковых чешуи и главным образом зерновок грибами Bipolaris sorokiniana и Drechslera teres появляются темные, почти черные пятна с темно-оливковым налетом. Зерна в пораженных колосьях щуплые, с потемневшим зародышем. Споры крупные продолговатые, цилиндрические или вере-теновидные, с несколькими поперечными перегородками. Размер их у Bipolaris sorokiniana (50 – 110) х (15 – 31), у Drechslera teres (30 – 175) х (15 – 22) мкм [22]. Грибница Bipolaris sorokiniana проникает в перикарпий, эндосперм и часто в зародыш.
Споры гриба Alternaria alternata темно-оливковые или коричневатые, обратно-булавовидные, расположенные в цепочках, с поперечными (1 – 9) и продольными (0 – 6) перегородками. Размер спор (300 – 50) х (14 – 18) мкм. Кони-диеносцы темно-оливковые или буроватые, прямые, ветвистые или простые, коленчатые [4].
Грибы рода Alternaria зимуют на растительных остатках и в почве в виде мицелия и конидий, массово передаются с семенами. Развитие начинается при температуре 6 °С, максимальное заражение наблюдается при 15 °С. После заражения гриб образует интерцеллюлярный мицелий, на поверхности тканей хозяина формируется конидиальное спороношение, которое служит для распространения патогена в течение вегетации ветром и (реже) с капельной влагой. Иногда на перезимовавших растительных остатках могут формироваться псевдотеции с сумками.
Грибы не требовательны к условиям увлажнения, предпочитают почвы с нейтральной реакцией.
Болезнь вызывает нарушения многих функций растения – фотосинтез, минеральное питание, синтез аминокислот, сдерживает рост и развитие. Потери урожая колеблются от 5 до 15% [23].
Дата: 2019-05-28, просмотров: 306.