Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов
Дипломная работа студентки 5-го курса
Кекало Екатерины Александровны
Руководитель
канд. хим. наук, доцент Н.Н. Горошко
Рецензент
доктор хим. наук,
профессор Е.А. Стрельцов
Дипломник Е.А. Кекало
"Допустить к защите" 04.06.2004
Зав.кафедрой
Доктор хим. наук С.К. Рахманов
г. Минск,
2004г.
Содержание:
Содержание
Введение
1. Обзор литературы
1.1.Магнитные сорбенты
1.1.1. Синтез пористых ферритов с применением выгорающих добавок
1.1.2. Неорганические магнитонаполненные адсорбенты
1.1.3. Углеминеральные магнитные сорбенты
Изотермы адсорбции
1.2.Магнитная жидкость как коллоидная система
1.2.1.Устойчивость магнитных жидкостей
1.2.2.Обзор методов получения магнитных жидкостей
1.2.2.1.Дисперсионные методы получения MЖ
1.2.2.2.Методы конденсации
2. Методика эксперимента
2.1. Синтез магнитного материала
2.1.1. Синтез магнетита
2.1.2. синтез магнетита
2.1.3. Синтез магнитной жидкости с водной дисперсионной средой и стабилизатором олеатом ТЭА
2.1.4.Синтез магнитной жидкости с водной дисперсионной средой и стабилизатором олеатом аммония
2.1.5. Синтез магнитной жидкости с водной дисперсионной средой и минеральными кислотами в качестве стабилизатора
2.1.6. Синтез магнитной жидкости с деканом в качестве дисперсионной среды и стабилизатором олеиновой кислотой
2.1.7. Синтез магнитной жидкости с керосином в качестве дисперсионной среды и стабилизатором олеиновой кислотой
2.2. Синтез магнитного сорбента
2.2.1. Синтез намагниченного сорбента 1
2.2.2. Синтез намагниченного сорбента 2
2.2.3. Синтез намагниченного сорбента 3
2.2.4. Синтез намагниченного сорбента 4
2.2.5. Синтез намагниченного сорбента 5
2.2.6. Синтез намагниченного сорбента 6
2.2.7. Синтез намагниченного сорбента 7
2.3. Методики анализа
2.3.1. Определение содержания Fe(II) при помощи количественного анализа..
2.3.2. Определение содержания Fe(III) при помощи количественного анализа
2.3.3. Определение содержания Fe(II) и Fe(III) в осадке, образующемся при соосаждении гидроксидов при помощи количественного анализа
2.3.4. Упрощенный метод определения поверхности по адсорбции воздуха
2.3.5.Эктронномикроскопическое исследование
2.3.6. Рентгенографическое исследование
2.3.7. Дериватографичеекое исследование
3. Результаты и их обсуждение
3.1. Рентгенофазовое исследование
3.2. Количественный анализ
3.3. Изотермы адсорбции
3.4. Электронная микроскопия
3.5. Удельная поверхность
3.6. Намагниченность
3.7. Дериватографическое исследование
Выводы
Литература
Резюме
Приложение
Введение
Данная дипломная работа посвящена синтезу и изучению магнитных сорбентов, представляющих собой магнитный (либо намагниченный) материал с высокими адсорбционными свойствами.
Преимущество таких адсорбентов по сравнению с обыкновенными (не магнитными) состоит в том, что обладая высокой сорбционной емкостью они могут управляться при помощи магнитного поля. Адсорбенты с магнитными свойствами применяются для контактной очистки веществ, что существенно упрощает адсорбционный процесс и полноту отработки адсорбента, исключает стадию отделения отработанного адсорбента от раствора, являющуюся одной из трудоемких, заменив ее магнитной сепарацией. Магнитные сорбенты уже широко используются для очистки сточных вод, сбора нефти с поверхности водоемов и в медицине (очищают костный мозг и др.) [1-8].
Придание сорбентам магнитных свойств может обеспечить значительное повышение эффективности их использования, поскольку открывается возможность вводить сорбенты в очищаемую среду в виде дисперсной фазы при контролируемой поверхности межфазного контакта и извлекать из среды физическим методом. Известно [8], что придание сорбентам магнитных свойств обычно не снижает емкости и селективности сорбции, а в ряде случаев улучшает эти характеристики, повышая также скорость процесса сорбции – десорбции. Известно также, что магнитные сорбенты способны улучшать ионообменные свойства почв, что указывает на возможность использования материалов данного типа для направленного изменения свойств биологических систем.
Использование данных адсорбентов не ограничивается указанными областями их применения, тем более что они с технологической точки зрения во многих адсорбционных процессах наиболее предпочтительны.
Есть много способов их получения, принципиально отличающихся друг от друга. Большинство из них являются трудоемкими и влекут за собой большие энергетические затраты, что существенно сужает диапазон возможного применения магнитных сорбентов.
На кафедре неорганической химии Белгосуниверситета им. В.И. Ленина в течение нескольких десятков лет проводятся исследования по применению коллоидных систем на основе олова, вольфрама, ванадия, железа и некоторых других металлов для получения пленок и тонких покрытий.
Целью настоящей работы является разработка способа синтеза магнитоуправляемых сорбентов при использовании магнитной жидкости и изучение некоторых их свойств.
Актуальность поставленной в работе задачи подчеркивается потребностью различных областей науки и техники в недорогих магнитоуправляемых сорбентах. Так, магнитоуправляемые сорбенты, используемые для сбора нефти с поверхности водоемов, в медицине и других областях представляют собой дорогостоящие материалы, изготовление которых требует использования сложных технологических процессов и не менее сложного и дорогого оборудования.
Использование именно жидкого материала для пропитки сорбента (и придания ему тем самым магнитных свойств) выгодно отличает предложенный нами способ получения магнитных сорбентов от описанных в литературе [1-7]. Применение различных магнитных жидкостей (в отличие от магнетита определенного состава) позволяет в широких пределах варьировать свойства получаемого сорбента.
Автор считает необходимым выразить признательность к.х.н., научному сотруднику Макс Планк института угольных исследований, Мюлхайм ан дер Рур, Германия, Матусевич Н.П. и к.х.н., научному сотруднику Академии Наук Беларуси Самускевичу В.В. за помощь в выполнении физико-химических исследований а также за ценные замечания и пожелания высказанные в ходе обсуждения результатов.
Обзор литературы.
Магнитные сорбенты
Изотермы адсорбции
Изотермы адсорбции являются одной из важнейших характеристик адсорбентов, т.к. при их анализе можно установить многие характеристики сорбента (удельную поверхность, размер пор, предположить их форму, характер сорбции и т.п.).
Для получения изотерм адсорбции очень важен правильный выбор адсорбтива.
Адсорбтив должен быть химически инертным по отношению к поверхности твердого тела; давление насыщенных паров при температуре опыта должно быть достаточно большим, чтобы его можно было точно измерить в соответствующем, довольно широком интервале относительных давлений (~0,001 < р/ро < ~0,5); однако, чтобы удобнее было проводить эксперимент, р0 не должно превышать 1—2 атм. Кроме того, рабочие температуры должны быть такими, чтобы их можно было легко получить при помощи обычных хладагентов, а именно азота (т. кип. 77 К), кислорода (Ткип. 90 К), охлаждающей смеси на основе диоксида углерода (195 К), тающего льда (273 К) или при помощи подходящих термостатов (в интервале от 253 до 323 К). Наконец, желательно, чтобы форма молекул адсорбата не слишком отличалась от сферической, с тем чтобы свести к минимуму неопределенность в величине ат (площадь, занимаемая молекулой адсорбата в плотном монослое) из-за возможной различной ориентации на поверхности. В первое время кислород часто применялся как адсорбат при определении удельной поверхности по методу БЭТ, причем адсорбция измерялась при температуре его кипения. Однако, когда жидкий азот стал вполне доступным, использование кислорода резко сократилось. Помимо того что жидкий кислород как хладагент небезопасен, при температуре 90 К трудно исключить возможность его хемосорбции.
В литературе [26, 83] приводятся десятки тысяч изотерм адсорбции, полученных для самых различных твердых тел.
Существует также несколько теорий, объясняющих вид изотерм адсорбции. Так, например, если происходит хемосорбция (молекулы адсорбтива связываются с частицами адсорбента при помощи химического взаимодействия), то данный вид взаимодействия хорошо описывает теория мономолекулярной адсорбции Ленгмюра. Согласно этой теории, адсорбция молекул адсорбтива происходит на активных центрах, всегда существующих на поверхности адсорбента. Такими центрами могут быть пики и возвышения, имеющиеся на любой, даже самой гладкой поверхности. В результате большой ненасыщенности силового поля около таких пиков и выступов эти участки обладают способностью удерживать налетающие молекулы газа. Вследствие малого радиуса действия адсорбционных сил, имеющих природу, близкую к химической, и способности их к насыщению, каждый активный центр, адсорбируя молекулу адсорбтива, становится уже неспособным к дальнейшей адсорбции. В результате этого на поверхности адсорбента может образоваться только мономолекулярный слой адсорбтива. И изотерма адсорбции примет следующий вид (рис.1).
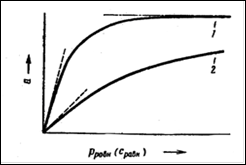
Рис. 1. Обычный вид изотерм адсорбции при различных температурах:
1 — изотерма, отвечающая температуре Т1; 2—изотерма, отвечающая температуре Т2 (Т1< Т2).
Однако, наряду с изотермами адсорбции, вид которых показан на рис. 1, довольно часто на практике встречаются изотермы, не имеющие второго участка, почти параллельного оси давлений и отвечающего насыщению поверхности адсорбента молекулами адсорбтива. Вид таких изотерм изображен на рис.2. Как можно видеть, в точке А изотерма Ленгмюра круто поднимается кверху. Очевидно, связывание адсорбтива адсорбентом не прекращается после образования мономолекулярного слоя, а продолжается дальше. Форму подобных изотерм нельзя объяснить как следствие капиллярной конденсации, так как такая изотерма наблюдается и у непористых адсорбентов, когда капиллярная конденсация невозможна.
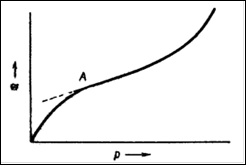
Рис. 2. Вид изотермы, характерной для полимолекулярной адсорбции.
Для объяснения этого явления Поляни предложил теорию полимолекулярной сорбции Рассмотрим кратко исходные положения этой теории, особенно пригодной в случае адсорбции паров на твердом теле:
- Адсорбция обусловливается чисто физическими силами.
- На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи от поверхности адсорбента и образуют около этой поверхности со стороны газовой фазы непрерывное силовое поле.
- Адсорбционные силы действуют на сравнительно большие расстояния, во всяком случае большие, чем размеры отдельных молекул адсорбтива, и поэтому можно говорить о существовании у поверхности адсорбента адсорбционного объема, который заполняется при адсорбции молекулами адсорбтива.
- Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии практически становится равным нулю.
- Притяжение данной молекулы поверхностью адсорбенга не зависит от наличия в адсорбционном пространстве других молекул, вследствие чего возможна полимолекулярная адсорбция.
- Адсорбционные силы не зависят от температуры, и, следовательно, с изменением температуры адсорбционный объем не изменяется. Это не противоречит тому, что с повышением температуры адсорбция уменьшается; в этом случае снижение адсорбции обусловливается не уменьшением адсорбционных сил, а увеличением в результате нагревания интенсивности теплового движения адсорбированных молекул, что приводит к увеличению десорбции.
Большинство изотерм физической адсорбции можно отнести к одному из пяти типов, от I до V, по классификации, впервые предложенной С. Брунауэром, Л. Демингом, У. Демингом. и Э. Теллером, иногда приписываемой Брунауэру, Эммету и Теллеру (БЭТ) или даже одному Брунауэру . Эти типы изотерм показаны на рис. 3.
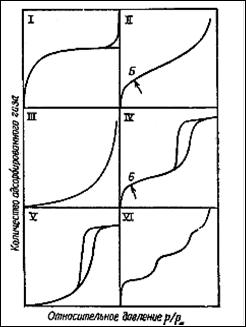
Рис. 3. Пять типов изотерм адсорбции (I—V) по классификации Брунауэра, Деминга, Деминга и Теллера (БДДТ) и ступенчатая изотерма (тип VI).
Как мы уже отмечали, полимолекулярная адсорбция характеризуетея S-образной изотермой адсорбции (тип II). Однако следует иметь в виду, что кривую аналогичной формы можно получить при адсорбции, осложненной капиллярной конденсацией (тип IV). Точка Б, которой соответствует начало прямолинейного участка, соответствует завершению образования монослоя, так что величина адсорбции в точке Б должна быть равна емкости монослоя. Возможность локализации точки Б зависит от формы изгиба изотермы. Если изгиб крутой, точка Б может быть локализована с хорошей точностью, даже если линейный участок изотермы короткий.
Существует много типов пористых систем. И в различных образцах, и в одном и том же образце отдельные поры могут значительно различаться как по форме, так и по размеру. Особый интерес во многих случаях может представлять поперечный размер пор, например диаметр цилиндрических пор или расстояние между стенками щелевидных пор. Удобная классификация пор по размерам принята Международным союзом по теоретической и прикладной химии (IUPAC) :
Таблица 1 ,
Методы конденсации.
Конденсационные методы основаны на соединении отдельных молекул или ионов растворенного вещества в агрегаты коллоидных размеров. Образование коллоидных систем в результате конденсации можно рассматривать как процесс кристаллизации, который протекает в две стадии:
- возникновение зародышей (центров кристаллизации);
- рост зародышей до определенного размера кристаллов. Зародыши кристаллизации, как правило, образуются в результате осаждения растворенного вещества на чужеродных мельчайших пылинках, случайно оказавшихся в системе (гетерогенная конденсация). Необходимо отметить, что вводя определенное количество чужеродных зародышей, можно получить коллоидные системы с заранее заданной дисперсностью.
Рост кристаллов происходит в результате конденсации на них ионов или молекул вещества из раствора. Важно при получении высокодисперсных систем (золей), чтобы скорость образования зародышей была велика, а скорость роста кристалликов мала, так как лишь в этом случае образуется множество кристаллов коллоидных размеров. Если же наоборот скорость образования центров кристаллизации мала, а скорость роста кристаллов велика, то все выделившееся вещество конденсируется на небольшом числе зародышей и в результате образуется небольшое количество крупных кристаллов. Важно отметить, что в первом случае будут образовываться сравнительно монодисперсные системы, а во втором - полидисперсные. Очень существенное значение для получения коллоидов имеют условия реакции, то есть температура, концентрация реагирующих веществ, скорость и порядок смешивания растворов. Используя, например, сильно разбавленные растворы, охлаждая их и осторожно перемешивая можно, в принципе, вырастить монокристалл, а используя концентрированные растворы, интенсивно перемешивая и подогревая их - частицы коллоидных размеров.
Методами конденсации высокодисперсные частицы магнетиков могут быть получены в результате химических реакций почти всех известных типов: реакций обмена, восстановления, окисления, гидролиза и т.д.
Примерами методов конденсации являются: термическое разложение карбонилов металлов, электролиз металлов из растворов их солей, соосаждение солей под действием щелочи [55-63] и другие методы.
Примером конденсационных способов может служить метод получения магнитных жидкостей на углеводородной и кремнийорганической основе с металлами, разработанный авторами работ [64-70]. Метод основан на термическом разложении карбонилов металлов непосредственно в жидкости-носителе в атмосфере инертного газа и в присутствии стабилизатора. Это позволяет защитить образующиеся высоко дисперсные частички металлов от окисления, полностью сохранить их магнитные свойства и предотвратить коагуляцию, для успешного приготовления коллоидных растворов ферромагнетиков этим методом необходимо очень точно соблюдать баланс между жидкостью-носителем, стабилизатором и металлическими частицами. Изменяя режим получения (температуру, состав и процентное соотношение исходных компонентов) можно получить коллоиды, содержащие частицы металла размером от 20 до 300Å.
Разложением пентокарбонила железа Fe(CO)5 и дикобальтоктокарбонила Cо2(CO)8 Томасом были получены устойчивые коллоиды железа и кобальта в толуоле и хлорбензоле [66-68].
Аналогично авторами [65] получены магнитные жидкости на кремний-органических соединениях с железом. При разложении карбонилов металлов образуются высокодисперсные частички чистых металлов
Fe(CO)5 ↔ Fe + 5CO
Этот метод позволяет получать магнитные жидкости на чистых металлах. Недостатком этого способа является обильное выделение токсичного оксида углерода(II), а также большая реакционная способность получаемых чистых частиц металлов, что требует особых мер предосторожности. К тому же процесс должен протекать в герметичном реакторе, в атмосфере инертного газа и при высоких температурах, что создает свои сложности.
М.А.Луниной совместно с сотрудниками усовершенствован и успешно используется для получения металлических органозолей электроконденсационный метод [40, 71]. Преимуществом ЭК-метода является возможность получения практически любых металлов в виде золей, содержащих сферические частицы со средним радиусом от 1 до 30 нм. В основе ЭК-метода лежит принцип конденсации пересыщенного пара металла, возникающего при искровом разряде высокочастотного переменного тока между грубыми частицами металла, погруженными в жидкость.
Мозговой и Блум [72] для получения коллоидной суспензии железа в толуоле также использовали электроконденсационный метод. Ими была получена довольно устойчивая коллоидная система, однако весовая концентрация железа в ней составляла лишь около 3 %.
Большой интерес представляют собой электропроводящие жидкости. В качестве жидкости-носителя используют обычно ртуть, олово, легкоплавкие металлы и их сплавы (индий, галлий и др.). Способы получения таких жидкостей основан на методе термической конденсации и электролизе [73-77].
Авторами [75] для получения коллоидных растворов гадолиния в ртути использовался термический метод конденсации. Сплав железо-гадолиний испарялся в атмосфере аргона при пониженном давлении. Образующиеся аэрозольные частицы переводились в ртуть. Концентрирование взвеси проводили испарением ртути при механическом встряхивании суспензии с целью предотвращения роста частиц. В последующих работах [76] эти авторы использовали в качестве феррофазы сплав Fe-Ni. Электролиз проводился в электролизной ванне при рН = 9,25-9,5. Катодом служила свободная поверхность ртути. Для перевода образующихся частиц во взвесь ванна подвергалась вибрации с частотой 200 Гц. Полученные магнитные жидкости имели размер частиц 30-1000Å и как указывают авторы, обладали "хорошей намагниченностью и устойчивостью" в зависимости от процентного соотношения железа и никеля. Эмерсон получил электропроводные жидкости на основе железа в ртути совмещая методы электролиза, химического замещения и термической конденсации [77]. В нескольких других работах имеются лишь краткие сообщения о полученных электропроводных жидкостей на легкоплавких металлах и их сплавах, без описания методики получения и подробных характеристик. Основная трудность на пути создания таких жидкостей состоит в отсутствии эффективных методов их стабилизации.
Обычно получение устойчивых магнитных жидкостей ведется при совокупности методов конденсации, диспергирования и пептизации.
Эти методы широко используются в технике для получения красок, пигментов, магнитных лент и т.д. Использование этих методов для производства магнитных жидкостей будет обусловлено рядом дополнительных требований, таких как:
- возможность получения ферромагнетиков с размерами частиц 50-200Å;
- возможно больший выход частиц ферромагнетиков без загрязнения и разложения,
- простота технической реализации метода,
- высокие адсорбционные свойства частиц ферромагнетика и хорошо развитая поверхность;
- хорошая устойчивость получаемых коллоидов.
Среди этих методов нужно прежде всего выделить метод получения МЖ на основе магнетита путем соосаждения его избытком щелочи из растворов солей двух- и трехвалентного железа и последующей пептизации в жидкости-носителе.
Принципиальная схема процесса представлена на рис. 5. В реакторе I соли двух- и трехвалентного железа осаждаются избытком аммиака, затем в реакторе 2 к полученному осадку магнетита при постоянном перемешивании и нагревании до 70-90°С добавляют раствор олеиновой кислоты в керосине. В реакторах 3 и 4 происходит разделение полученной магнитной жидкости от воды и растворимых солей. Для более полного отделения магнитной жидкости от воды и примесей использован магнит 4.
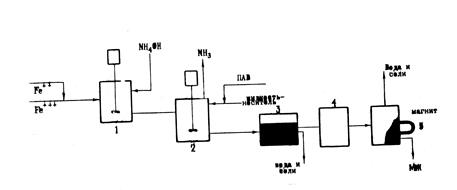
Рис.5. Технологическая схема процесса получения МЖ.
Описанный способ получения МЖ прост, производителен, позволяет получать магнетит размером 30-100Å, а магнитные жидкости - хорошей устойчивости и высокой намагниченности.
Выше рассмотрены наиболее изученные и отработанные методы получения МЖ. Но нужно отметить, что не всегда эти методы позволяют получить МЖ с широким диапазоном свойств на требуемой основе. Весьма перспективным в этом отношении является способ замены в МЖ одной жидкости-носителя другой, предложенный Р.Розенцвайгом [78] и основанный на методе пептизации. Суть этого способа состоит в том, что в МЖ вводят полярный флокулирующий агент или полимер, вызывающий флокуляцию частиц с адсорбированным на них ПАВом. В дальнейшем стабилизированные частицы выделяют из раствора и пептизируют в другой жидкости-носителе. Механизм действия флокулирующего агента приведен на рис. 6. Нa этом рисунке изображены две соседние частицы с адсорбированным на их поверхности ПАВом, взвешенные в неполярной жидкости-носителе. Когда две частицы сближаются, адсорбированные слои за счет стерического отталкивания препятствуют их укрупнению, и, естественно, и коагуляции. В силу этого частицы равномерно распределены в жидкости-носителе. При введении в систему полярного флокулирующего агента уменьшается взаимодействие ПАВ с жидкостью-носителем. Это приводит к вытеснению жидкости-носителя из зазоров между частицами и коагуляции последних с адсорбированным на них ПАВом. Скоагулировавшиеся частицы могут быть диспергированы в другой жидкости-носителе, имеющей средство к адсорбированному на них ПАВу.
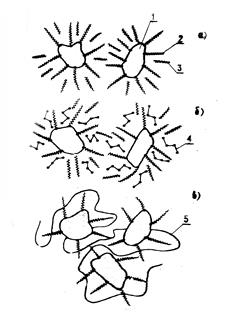
Рис.6. Механизм действия флокулирующего агента.
Флокуляция частиц полимером обусловлена большими размерами молекул полимера и их разветвленной структурой. Взаимодействуя с несколькими частицами сразу, молекула полимера обеспечивает укрупнение и коагуляцию частиц. В качестве полярного флокулирующего агента используют ацетон, этиловый спирт, этилацетат и др., а в качестве полимерных флокулянтов - полистирол, полиизобутилен, полимеры диметилсилоксана и др. Важными требованиями к полимерным флокулянтам являются их хорошая смешиваемость с жидкостью-носителем и чтобы длина молекулы в несколько раз превышала размер частиц феррофазы.
Описанный способ позволяет получать магнитные жидкости на других основах. Однако, нужно учесть, что таким образом можно производить замену сред только одного класса, например, один углеводород на другой. В дальнейшем этот способ был усовершенствован, что позволило производить замену различных по классу жидкостей-носителей [79]. Это достигается за счет подбора такого флокулирующего агента, который вызывает флокуляцию магнитных частиц без адсорбированного на них стабилизатора. Затем сфлокупировавшиеся магнитные частицы с помощью другого стабилизатора диспергируют в другой жидкости-носителе.
Замена жидкости-носителя в МЖ не только схожей с ней по свойствам, но и другими жидкостями, открывает возможность, получив предварительно МЖ наиболее простым и технологичным методом, в дальнейшем получать МЖ практически на любых основах и даже на таких, на которых прямым путем их получить очень трудно или вообще не удается. Например, можно, получив МЖ на воде, затем заменить воду углеводеродами, силиконовыми маслами, фторированными углеводородам или другими жидкостями-носителями. Кроме того, используя при повторном диспергировании другой стабилизатор, этим способом можно получить МЖ на той же основе, но с гораздо лучшими характеристиками и более широким спектром свойств.
В 80-90х гг в дипломных работах, выполненных на кафедре неорганической химии Белгосуниверситета им. В.И. Ленина дипломниками Витенчик Т.М, Омелюсик Л.С., Бурш В.В., Касперович Т.И. и др. были изучены закономерности процесса формирования пленок оксидов железа из стабильных коллоидных систем на основе магнитных оксидов железа с водной и неводной дисперсионной средой. Также было разработано несколько новых способов синтеза магнитных жидкостей. Так, например, в качестве стабилизатора были использованы олеат триэтаноламина (олеат ТЭА) и минеральные кислоты (HClO4, HNO3 и др.)
Из приведенного обзора видно, что наиболее простым и перспективным методом получения магнитных жидкостей является метод пептизации, хотя для получения МЖ с заранее заданными свойствами он требует усовершенствования.
Методика эксперимента
Синтез магнитного материала
2.1.1. Синтез магнетита
В данной работе был использован метод синтеза магнетита путем соосаждения солей двух- и трехвалентного железа избытком щелочи [80].
Готовилась смесь 25,5г FeSO4·7Н2О (марки чда) и 45г FeCl3·6Н2О, взятых в виде их 10%-ных водных растворов (т.о. отношение Fe(II):Fe(III) составляло 1,1:2, т.е. количество Fe(II) бралось в 10%-ном избытке по сравнению со стехиометрическим). Для предотвращения заметного окисления Fe(II) кислородом воздуха вода для приготовления раствора сульфата железа (II) подкислялась небольшим количеством (1-2 капли) концентрированной H2SO4.
Смесь растворов добавлялась быстро тонкой струей к 180-200мл 25%-ного раствора аммиака при интенсивном перемешивании механической мешалкой, которое продолжалось еще 20-25 мин после окончания реакции. Осаждение проводилось при рН=10.Образующийся черный осадок отмывался дистиллированной водой методом магнитной декантации до рН=8,5.
Из литературных данных известно, что целесообразно использовать 10%-е растворы солей (FeSO4·7H2O и FeCl3·6H2O) и их вливать в раствор щелочи или же проводить быструю нейтрализацию солей избытком щелочи, так как при медленном сливании разбавленных растворов образуются крупные частицы. Предотвратить образование гидрооксида железа и другие нежелательные побочные процессы можно используя предпочтительно хлорид и сульфат железа, а вместо едкого натра - водный раствор аммиака. Происходящая при этом химическая реакция может быть выражена следующим уравнением:
FeSO4·7H2O + 2FeCl3·6H2O + 8NH3·H2O ↔ Fe3O4 + 6NH4Cl + (NH4)2SO4 + 20H2O
Использование аммиака позволяет создать мягкие условия соосаждения оксидов, что благоприятствует протеканию реакции с образованием именно высоко дисперсного магнетита состава Fe3O4 или Fe2O3∙ FeO, который обладает лучшими магнитными характеристиками по сравнению с другими магнетитами, например mFe2O3∙nFeO (где n≠m), а образовавшаяся при этом соль аммония NH4Cl при нагревании легко разлагается с выделением газообразного аммиака. Ионы Сl- и растворимые соли удалялись многократной промывкой дистиллированной водой. В результате уменьшается число разноименных ионов в растворе, вызывающих коагуляцию частиц магнетита или препятствующих их пептизации в жидкости-носителе, а также снижающих впоследствии устойчивость получаемых МЖ.
Магнетит, полученный по данной методике, отличается монодисперсностью частиц, высокими магнитными свойствами, хорошей адсорбционной способностью, что является важными факторами при создании устойчивых высокомагнитных жидкостей.
2.1.2. синтез магнетита
То же что и 2.1, только соотношение Fe(II):Fe(III) =2:1
2.1.3. Синтез магнитной жидкости с водной дисперсионной средой и стабилизатором олеатом ТЭА.[81]

Рис. 7. Установка для синтеза магнитной жидкости. 1- штатив, 2 – лапка, 3 – мотор, 4 – стеклянная мешалка, 5 – пробка с отверстием, 6 – контактный термометр, 7 – стакан, 8 – водяная баня, 9 – плитка, 10 – реле, 11 – ротор.
Отдельно от магнетита, полученного по методике 2.1.1. готовился стабилизатор (смесь 9мл олеиновой кислоты и 11мл триэтаноламина). Готовый стабилизатор – олеат ТЭА – добавлялся по каплям к нагретому на водяной бане до температуры 50-60ºС осадку магнетита в воде, оставшейся после последней декантации, количество которой могло варьироваться для получения коллоидных систем с различным содержание магнетита. Нагрев и перемешивание продолжалось в течение 2х часов, затем система оставлялась для удаления пены ПАВ, образующейся в результате интенсивного перемешивания, на 0,5 -1 сутки, после чего проводилось центрифугирование для отделения фракции более крупных частиц (F = 4000g).
2.1.4. Синтез магнитной жидкости с водной дисперсионной средой и стабилизатором олеатом аммония.
Отмыв осадка, полученного аналогичным методике 2.1.1. способом, проводился до рН=9,5, после чего к дисперсии магнетита в воде (150мл), нагретой до 60ºС на водяной бане, добавлялось для стабилизации системы 20мл 25%-ного раствора аммиака, а затем 10мл олеиновой кислоты. Нагрев при 60-70ºС продолжался 1,5 часа, после чего коллоид центрифугировался и помещался в емкость из темного стекла.
2.1.5. Синтез магнитной жидкости с водной дисперсионной средой и минеральными кислотами в качестве стабилизатора
К магнетиту, приготовленному по методике 2.1.1. по каплям добавлялся очень разбавленный (0,01М) раствор азотной либо хлорной кислот до пептизации осадка, после чего проводилось центрифугирование для отделения фракции более крупных частиц (F = 4000g).
2.1.6. Синтез магнитной жидкости с деканом в качестве дисперсионной среды и стабилизатором олеиновой кислотой.[82]
Образующийся черный осадок, полученный по методике 2.1.1. после отмывания переносился в узкий стеклянный стакан. К осадку добавлялась смесь 80-100мл декана и 8-9,5 мл олеиновой кислоты, содержимое стакана перемешивалось вручную и оставлялось для расслаивания (на 1-1,5 часа) в темноте. После этого верхний органический слой (50-60мл) переносился в делительную воронку и еще раз оставлялся на 1-1,5 часа для более полного расслоения. Затем отделенный органический слой переносился в стакан емкостью 80-100мл, помещался на песчаную баню и нагревался в течение 4-5 часов при 80-90ºС при постоянном перемешивании для удаления остатка воды. Затем образец центрифугировался для удаления фракции более крупных частиц (F = 3400g) в течение 15-20 мин и помещался в емкость из темного стекла.
2.1.7. Синтез магнитной жидкости с керосином в качестве дисперсионной среды и стабилизатором олеиновой кислотой.
То же, что и 2.1.6., только вместо декана был использован керосин.
Синтез магнитного сорбента
2.2.1. Синтез намагниченного сорбента 1.
Немагнитный сорбент (активированный уголь, гранулированный активированный уголь либо ионообменный сорбент) механически смешивался с отмытым до рН=8,5 магнетитом. Далее сорбент помещался в воду и намагниченная его часть экстрагировалась при помощи постоянного магнита. Затем он высушивался при комнатной температуре и анализировался.
2.2.2. Синтез намагниченного сорбента 2.
Соосаждение смеси солей Fe(II) и Fe(III) проводилось при рН=10 в присутствии немагнитного сорбента. Отмывание магнитного сорбента проводилось при помощи магнитной декантации до рН=8,5-9. Затем намагниченная часть сорбента извлекалась при помощи постоянного магнита и высушивалась.
2.2.3. Синтез намагниченного сорбента 3.
Немагнитный сорбент (гидроксиаппатиты, активированный уголь) пропитывался различными приготовленными заранее магнитными жидкостями (с водной и неводной дисперсионной средой; отличающихся природой стабилизатора и магнитного материала (магнетит, Со)).
2.2.4. Синтез намагниченного сорбента 4.
Синтез магнетита (методика 2.1.1.) проводился в присутствии сорбента. То есть, немагнитный сорбент помещался в раствор аммиака перед соосаждением солей железа для более равномерного распределения частиц магнетита около поверхности сорбента.
2.2.5. Синтез намагниченного сорбента 5.
Соединенный с сорбентом магнетит (2.2.4.) стабилизировался по методикам 2.1.4 и 2.1.6.
2.2.6. Синтез намагниченного сорбента 6.
К полученному по методике 2.1.1. магнетиту добавлялся вместе со стабилизатором (методика 2.1.3. и 2.1.6.) сорбент.
2.2.7. Синтез намагниченного сорбента 7.









 Немагнитный легкий материал (пенопласт) пропитывался магнитной жидкостью (мет. 2.1.3.-2.1.6.) и становился магнитоуправляемым, далее наносился связующий материал (силикатный клей) и потом уже сорбент.
Немагнитный легкий материал (пенопласт) пропитывался магнитной жидкостью (мет. 2.1.3.-2.1.6.) и становился магнитоуправляемым, далее наносился связующий материал (силикатный клей) и потом уже сорбент.
|
|
|
Или:
 |  |  | |||||||
 |  | ||||||||
Методики анализа
2.3.1. Определение содержания Fe(II) при помощи количественного анализа.[81, 82]
К 1г ФМЖ прибавлялся 1мл толуола, 2мл концентрированной HCl и смесь нагревалась на кипящей водяной бане в течение 5 мин, после чего к ней добавлялось 10мл воды, 0,5 мл концентрированной H2SO4 и нагревание продолжалось еще 5 мин. Затем к смеси добавлялись 1мл концентрированной H3PO4, 4мл 5%-ного раствора MnSO4, 1мл толуола и 10мл гексана. Содержимое стакана переносилось в делительную воронку, в которой находилось 20мл воды, и после взбалтывания и отстаивания смеси нижний слой сливался в коническую колбу емкостью 100мл. В воронку повторно добавлялось 10мл воды и после встряхивания и отстаивания нижний водный слой добавлялся к полученному ранее.
Раствор в колбе титровался 0,1н раствором KMnO4 до появления розовой окраски. Параллельно проводился контрольный опыт. 1мл 0,1н раствора KMnO4 соответствует 0,005585г Fe2+.
2.3.2. Определение содержания Fe/III/ при помощи количественного анализа.[81, 82]
К 1г ФМЖ прибавлялся 1мл толуола, 2мл концентрированной HCl и смесь нагревалась на кипящей водяной бане в течение 5 мин, после чего к ней добавлялось 10мл воды, 0,5 мл концентрированной H2SO4 и нагревание продолжалось еще 5 мин. Затем к смеси добавлялись 4мл 5%-ного раствора MnSO4, 1мл толуола и 10мл гексана. Содержимое стакана переносилось в делительную воронку, в которой находилось 20мл воды, и после взбалтывания и отстаивания смеси нижний слой сливался в коническую колбу емкостью 100мл. В воронку повторно добавлялось 10мл воды и после встряхивания и отстаивания нижний водный слой добавлялся к полученному ранее. К пробе перед титрованием добавлялось 2г твердого KJ.
Раствор в колбе титровался 0,1н раствором Na2S2O3, в качестве индикатора использовался крахмал. Параллельно проводился контрольный опыт. 1мл 0,1н раствора Na2S2O3 соответствует 0,005585г Fe3+.
2.3.3. Определение содержания Fe/II/ и Fe/III/ в осадке, образующемся при соосаждении гидроксидов при помощи количественного анализа.[81, 82]
К 1г осадка, просушенного на воздухе при комнатной температуре или отжатого на фильтровальной бумаге, прибавлялось последовательно 2мл концентрированной HCl, 10мл воды, 0,5 мл концентрированной H2SO4, 4мл 5%-ного раствора MnSO4, а для определения Fe/II/ еще и 1мл концентрированной H3PO4. После растворения осадка раствор для определения Fe/II/ титровался 0,1н раствором KMnO4 до появления розовой окраски; к раствору для определения Fe/III/ добавлялось 2г твердого KJ и он оттитровывался 0,1н раствором Na2S2O3 с использованием крахмала в качестве индикатора.
Таким же образом анализировались образцы, стабилизированные минеральными кислотами.
2.3.4. Упрощенный метод определения поверхности по адсорбции воздуха.[84]
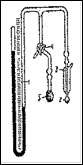
Рис.8. Прибор для определения удельной поверхности.
Прибор для определения удельной поверхности (рис.8) состоит из ртутного манометра 1 со шкалой, длина которого больше 80 см. Одна трубка манометра запаивается под вакуумом, а к другой присоединяется на шлифе ампула 2 с навеской образца. Трубка между шлифом и ампулой заключена в вакуумную рубашку 3, которая позволяет поддерживать постоянным охлаждаемый объем при погружении ампулы в жидкий азот. От трубки, соединяющей ампулу с манометром, сделан отвод с трехходовым краном 4. Вторая трубка от крана сообщается с атмосферой, а к третьей присоединена на шлифе ампула 5, содержащая несколько граммов активного угля.
Для определения удельной поверхности навеска образца помещается в ампулу, которая присоединяется к прибору. Ампула с углем соединяется с манометром и погружается в жидкий азот. После того, как весь воздух из прибора адсорбируется на угле, жидкий азот убирается и начинается десорбция газов в объем. Когда давление в манометре достигает 100—250 мм, поворотом крана ампула с углем отключается от манометра и соединяется с атмосферой. Давление газа в манометре измеряется по шкале с точностью ±0.5 мм. Ампула с образцом погружается в жидкий азот и через несколько минут определяется новое установившееся давление. Поверхность образца определяется по формуле:
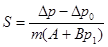 , где
, где
S – удельная поверхность,
Δp = p0 - p1
Δp0 = a0 + b0p1 (определяется по коллибровочному графику)
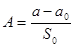
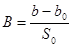
p0 и p1 – показания манометра до и после адсорбции на образце.
a, a0, b, b0, S0 – константы прибора.
Измерение адсорбции предлагаемым упрошенным методом связано с некоторыми допущениями, вносящими ошибки. Не учитывается изменение температуры жидкого азота; расчет поверхности проводится в предположении, что адсорбируется чистый азот. Между тем в воздухе неизбежно присутствует кислород. Поверхность измеряется без предварительной откачки образцов. Во многих случаях это не имеет значения, но для некоторых веществ требуется предварительный прогрев образцов для удаления адсорбированной воды.
2.3.5.Электронномикроскопическое исследование.
Препарирование образцов проводилось 2мя способами:
а) нанесения стеклянной палочкой порошка на медные опорные сеточки, расположенные на поверхности стекла и покрытые тонкой коллодиевой пленкой.
б) методом нанесения капли очень разбавленной жидкости на медные опорные сеточки, расположенные на поверхности стекла и покрытые тонкой коллодиевой пленкой.
На поверхность образцов, полученных обоими способами напылялась пленка спектрально чистого углерода толщиной 150-200 Å (вакуумный пост ВУП-4, вакуум 10-4 мм), служащая в качестве подложки при просмотре образца в электронном микроскопе.
Просмотр образцов проводился в электронном микроскопе ЭВМ – 100ЛМ. Количественная обработка результатов выполнялась по полученным ЭМ-снимкам путем определения среднего размера частиц и анализа поверхностных концентраций наблюдаемых частиц. Для количественного анализа подбирались сходные по структуре участки образцов, исследовались не менее трех участков каждого образца.
2.3.6. Рентгенографическое исследование.
Рентгенограммы образцов записывали на рентгеновском дифрактометре HZG-4A (CoKα – излучение). Расшифровка рентгенограмм велась по стандартной методике и идентифицировалась по набору межплоскостных расстояний.
2.3.7. Дериватографичеекое исследование.
Исследование проводилось на приборе "ОД-102" в воздушной атмосфере в интервале температур 25-1000°С при скорости нагрева 5 град/мин. Скорость протяжки 1 мм/мин, ДТА 1/5, ДТГ 1/15 . Дериватографическому исследованию подвергались активированный уголь, активированный уголь смешанный с магнетитом и активированный уголь пропитанный магнитной жидкостью (водн., олеат ТЭА).
Результаты и их обсуждение.
В настоящей работе представлены новые методы получения магнитных сорбентов, основанные на использовании различных магнитных жидкостей. Использование именно жидкого материала для пропитки сорбента (и придания ему тем самым магнитных свойств) выгодно отличает предложенный нами способ от описанных в литературе. Применение различных магнитных жидкостей (в отличие от магнетита определенного состава) позволяет в широких пределах варьировать свойства получаемого сорбента.
Также был проведен анализ полученных нами магнитных жидкостей и магнитных сорбентов на их основе.
3.1. Рентгенофазовое исследование.
Известно [31], что свежеосажденная смесь оксидов соответствует составу Fe3O4. Через некоторое время двухвалентное железо окисляется и Fe3O4 переходит в γ-Fe2O3. Магнетит и γ-оксид железа очень похожи по структурным характеристикам. Разница в плотности упаковки. Так, упаковка γ-оксида более плотная чем у магнетита. Разницу между ними можно обнаружить на рентгенограмме лишь в области 74-75˚ угла 2θ. У Fe3O4 межплоскостное расстояние соответствует значению 74,105˚, а у γ-Fe2O3 – 74,723˚.
Анализируя полученные нами рентгенограммы (рис.9.) можно сделать вывод, что в слабощелочной среде окисление идет быстрее, чем при рН=10. А также с течением времени магнетит стехиометрического состава переходит в nFeO·mFe2O3 где m>n, и затем уже в γ-Fe2O3.
|
| а б в | ||||||
| 80 | 75 | 70 | 65 | 60 | 55 | 50 | 2θ |
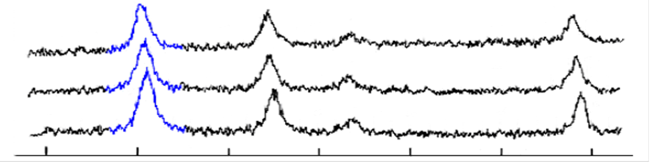
Рис. 9. Рентгенограммы образцов магнетита,
а) спустя 2 недели после синтеза, б) свежеосажденный, отмытый до рН=8,5, в) свежеосажденный, отмытый до рН=10.
|
| а б | ||||||
| 80 | 75 | 70 | 65 | 60 | 55 | 50 | 2θ |
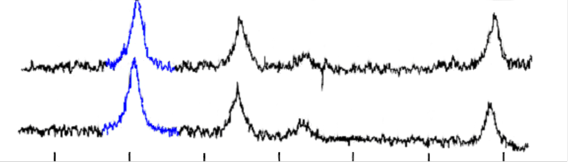
Рис. 10. Рентгенограммы образцов магнитных жидкостей в водной дисперсионной средой и смесью оксидов железа в качестве магнитного материала,
а) стабилизатор – олеат натрия, б) стабилизатор – олеат ТЭА.
Из анализа рентгенограмм (рис 10.) и данных количественного анализа следует, что в жидкостях, стабилизированных олеатом натрия, окисление двухвалентного железа идет медленнее по сравнению с жидкостями, стабилизированными олеатом ТЭА.
Что же касается концентрата магнитной жидкости на декане, то в нем, в отличие от водных МЖ и разбавленных МЖ на декане, окисление хоть и происходит, но в значительно меньшей степени.
|
| а б в | ||||||
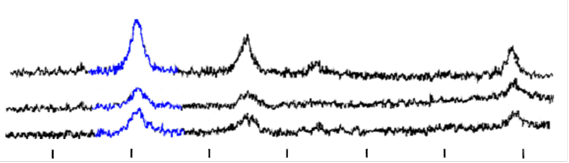
| 80 | 75 | 70 | 65 | 60 | 55 | 50 | 2θ |
Рис. 11. Рентгенограммы а) магнетит, б) угольный магнитный сорбент, в) ионообменный магнитный сорбент
Рентгеноструктурный анализ образцов на основе магнетита (полученного путем соосаждения солей 2х- и 3х- валентного железа в аммиаке и отмытого методом магнитной декантации до рН=8,5) (рис.11) показал, что Fe2+ окисляется и со временем Fe3O4 переходит в g-Fe2O3. Это происходит примерно одинаково интенсивно в свежеосажденной смеси оксидов и магнитном сорбенте с активированным углем. В этих образцах состав магнитного материала представляет собой смесь Fe3O4 и g-Fe2O3.
При рентгеноструктурном анализе образцов магнитных сорбентов на основе магнитных жидкостей с органической и водной дисперсионной средой выяснилось, что в магнитном сорбенте на водной основе окисление происходит быстрее, чем в магнитных сорбентах, синтезированных из неводных магнитных жидкостей. А в целом, ситуация похожа на описанную выше.
3.6. Количественный анализ.
Количественный анализ проводился методами перманганато- и иодометрии. Данные представлены в табл.2 и на рис.12:
Таблица 2.
Удельная поверхность.
Исследования удельной поверхности при помощи методики 2.3.4. показали, что удельная поверхность активированных углей уменьшается при пропитке их магнитной жидкостью. Причем при использовании магнитной жидкости с водной дисперсионной средой поверхность углей с очень развитой поверхностью (около 2500 м2/г) уменьшается в 1,5 – 2 раза, а при использовании магнитной жидкости с неводной дисперсионной средой – в 10 раз. Концентрация магнитной жидкости в обоих случаях одинакова – 12 массовых процентов Fe. При использовании углей с меньшей удельной поверхностью (около 1000 м2/г) присутствие магнитной компоненты сказывается уже в меньшей степени (водные – уменьшается в 1,1 – 1,2 раза; неводные – в 2 раза). Однако относительно небольшая удельная поверхность некоторых гидроксоапатитов (около 30-40 м2/г) после пропитки увеличивается. Это вероятно связано с тем, что магнетит сам имеет высокоразвитую поверхность.
Таблица 3.
Данные об удельной поверхности сорбентов (по адсорбции воздуха)
Тип
Сорбент
Магнитная жидкость
S уд , м2/г
Активированные угли
гидроксоапатиты
Магнитные сорбенты
Однако, данные об удельной поверхности нескольких образцов, полученные по адсорбции азота, сильно расходятся с вышеописанными. Так, Sуд(СКТ) = 563,76м2/г, Sуд(СКТ + МЖ (водн., олеат ТЭА)) = 489,32 м2/г.
Это расхождение можно объяснить тем, что при адсорбции воздуха большой вклад внесла адсорбция кислорода, которая методикой 2.3.4 не учитывается. В связи с этим, полученные данные о величине удельной поверхности по адсорбции воздуха оказались сомнительными.
На рис.20 представлено распределение объема пор по значению эффективных радиусов. Площадь под кривой равна общему объему пор.
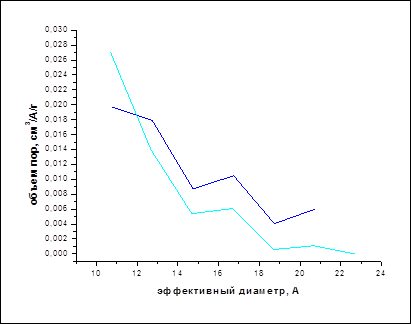
Рис. 20. Дифференциальная структурная кривая
● – активированный уголь (СКТ), ■ – активированный уголь (СКТ), пропитанный МЖ (водн., олеат ТЭА)
3.5. Намагниченность.
Данным методом анализа исследовались образцы различных МЖ (дисперсионная среда, стабилизатор, возраст) и магнитные сорбенты.
Из данных о намагниченности насыщения была установлена линейная зависимость намагниченности насыщения от концентрации магнитного материала, т.е. чем больше массовая доля магнитного компонента в образце, тем выше намагниченность насыщения. Намагниченность насыщения сорбентов, полученных пропиткой сорбента магнитной жидкостью, оказалась выше, чем сорбентов, полученных механическим смешением с магнетитом. Увеличение концентрации магнитного материала (а, следовательно, и намагниченности насыщения) при прочих одинаковых условиях у пропитанных жидкостью образцов по сравнению с полученными механическим смешением с магнетитом можно объяснить тем, что за счет капиллярных сил жидкость, несущая магнитный материал, увлекается в объем сорбента.
Анализируя рис.21 можно подтвердить данные количественного анализа о том, что присутствие сорбента несколько замедляет переход Fe3O4 в γ-Fe2O3, обладающий меньшими магнитными свойствами.
| Намагниченность, эмю/г(образца) | 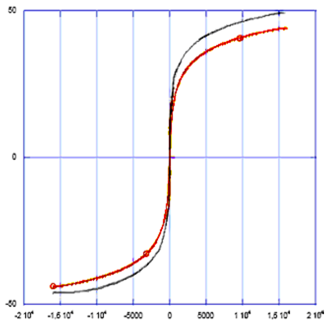
|
| Напряженность магнитного поля, эрстеды |
|
Таблица 4.
| № | образец | w(Ме) | намагниченность μs(σ) эксперим. | Намагниченность насыщения μs ( экстрап. на ось у) |
| 1 | магнетит | 71 | 42,1 | 44,5 |
| 2 | Уголь + МЖ (водн., олеат ТЭА) | 25 | 44,3 | 45,6 |
| 3 | Уголь + магнетит | 21 | 30,69 | 32,0 |
| 4 | Уголь + магнетит | 23 | 32,89 | 34,1 |
| 5 | Уголь + магнетит (прокаленный при 500ºС 1 час) | 23 | 6,2 | 6,3 |
| 6 | МЖ на основе Со | 18 | 76,99 | 77,4 |
| 7 | МЖ (водн., олеат ТЭА) | 1,62 | 3,308 | 3,38 |
| 8 | МЖ (водн., олеат ТЭА), 7 лет | 3,5 | 5,421 | 5,56 |
| 9 | МЖ (декан, олеиновая кислота) | 13,4 | 29,78 | 30,16 |
| 10 | МЖ (декан, олеиновая кислота), 2 года | 12,2 | 23,55 | 23,78 |
Небольшое значение намагниченности насыщения у 5го образца (рис.22) обусловливается тем, что при прокаливании магнитный γ-Fe2O3 переходит в немагнитный α-Fe2O3. Реализацию этого перехода подтверждает так же рентгенофазовый анализ. На кривой этого же образца можно наблюдать слабо выраженную петлю гистерезиса, что говорит о неоднородности материала.
| Намагниченность, эмю/г(образца) | 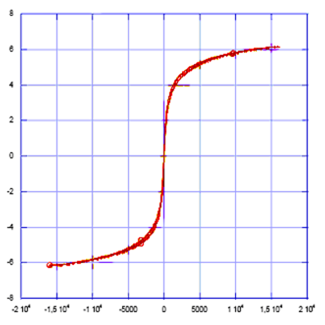
|
| Напряженность магнитного поля, эрстеды |
Рис.22. Кривая намагниченности насыщения образца №5.
Кривая намагниченности насыщения 6го образца отличается от остальных резкостью (рис.23). Этот факт говорит о мономерности частиц.
| Намагниченность, эмю/г(образца) | 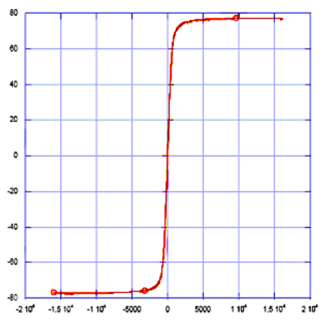
|
| Напряженность магнитного поля, эрстеды |
Рис.23. Кривая намагниченности насыщения образца №6.
3.7. Дериватографическое исследование.
Дериватографическому исследованию подвергались активированный уголь, активированный уголь смешанный с магнетитом и активированный уголь пропитанный магнитной жидкостью (водн., олеат ТЭА).
Термическое разложение образцов начинается при температуре около 100ºС и заканчивается при температуре 600ºС. Основная потеря массы образцов происходит в интервале 300-500ºС, где наблюдается сильный экзоэффект с максимумом вблизи 400ºС. Данный экзоэффект может соответствовать возгоранию угля. Кроме того, в этом же интервале температур расположен и экзоэффект, соответствующий разложению олеиновой кислоты (325-330ºС), и процессу перехода γ-Fe2O3 в α-Fe2O3 (460-510ºС). В связи с этим мы не наблюдаем на рисунках 24-26 острого пика, а видим лишь результат наложения нескольких пиков. Кроме этого экзоэффекта мы наблюдаем еще один слабый эндоэффект около 120-150ºС на рисунках 25 и 26. Этот эффект, сопровождающийся небольшой потерей массы может быть связан с потерей сорбированной воды.
Выводы.
ü Предложен новый метод получения магнитных сорбентов, основанный на использовании полученных в ходе выполнения настоящей работы магнитных жидкостей (с магнитными оксидами железа в качестве дисперсионной фазы). Применение магнитных жидкостей позволяет варьировать свойства данных сорбентов в широких пределах.
ü Методом электронно-микроскопического исследования показано, что разработанный способ получения магнитных сорбентов обеспечивает равномерное распределение частиц магнитного материала по поверхности сорбента, что свидетельствует о преимуществе предложенного способа перед используемыми ранее.
ü Изучение изотерм адсорбции позволяет сделать предположение о капиллярном механизме взаимодействия сорбента и магнитной жидкости.
ü Измерения удельной поверхности по адсорбции азота показали, что при пропитке сорбента магнитной жидкостью он приобретает ценные магнитные свойства без существенного изменения удельной поверхности.
Литература.
1. Павел Иванов, Радий Махлин, Николай Мошечков, Костный мозг очищают сепараторы // http://science.ng.ru/high/2000-09-20/4_brain.html (17.03.04)/
2. В. А. Румянцев, А.Б. Левченко, Нефтяные разливы в Балтийском море или почему авария танкера “TERN” в 2001 году привела к тем же печальным результатам, что и авария танкера “АНТОНИО ГРАМШИ” в 1987 году // http://www.limno.org.ru/win/eco.htm (17.03.04)/
3. А.П.Красавин, Н.М.Веснин. - Проблемы борьбы с аварийными нефтяными разливами нефти. - Топливно-энергетический комплекс. № 3, 2000, с. 102-103.
4. В.А. Никашина, И.Б. Серова, Б.А. Руденко. Ферритизированный магнитоактивный ионообменник для извлечения тяжелых металлов и радионуклидов из объектов окружающей среды // http://sciteclibrary.ru/rus/catalog/pages/1561.html (26.04.01)/ Патент РФ №2081846.
5. А.М. Тузова, В.В. Фадеев, Л.Д. Раснецов, Б.Е. Раснецова. Магнитоактивные сорбенты на основе природных и синтетических цеолитов // http://sciteclibrary.ru/rus/catalog/pages/1559.html (26.04.01)/ . Патент-РФ № 2061540; заявка, положительное решение 5038283/26(007478).
6. Подойницын Сергей Николаевич Разработка метода детоксикации организма путём гемосорбции с использованием магнитных сорбентов // http://www.tech-db.ru/istc/db/projects.nsf/webr/2614 (21.09.03)/
7. Macášek F. Bartoš P. A Magnetic Sorbent for Radiocesium and Radiostrontium Removal from Clay and Soil Suspensions / Journal of Radioanalytical and Nuclear Chemistry 246 (3) p.565-569 December 2000
8. Мечковский С. А., Лесникович А.И., Воробьева С.А., Заневская Ю.В., Козыревская А.Л., Молоток Е.В. Высокодисперсные магнитоизвлекаемые сорбенты // Вестн. Белорус. Гос. Ун-та. Сер.2 1998 №3 с. 13-16, 79
9. Комаров В. С., Репина Н. С., Степанова Е. А. // Весцi. АН Беларусi. Сер. хiм. навук. 1996. N1. С26-28.
10. Комаров В. С., Репина Н. С., Бондаренко С. Н. // Весцi. АН Беларусi. Cep. хiм. навук. 1996 . N2. С25.-29.
11. Овчаренко Ф. Д., Чубарь Г. В., Высоцкая В. Н., Хомченко Ю. И. //Докл. АН СССР. 1976. Т.229, N1,2,3. С.199.
12. Чубарь Т. В., Овчареню Ф. Д., Высоцкая В. Я. // Коллоид, журн. 1979.T.4,N 1. С.196-199.
13. Чубарь Т. В., Хворое М. М., Высоцкая В. Н. // Коллоид. журн. 1978. Т.40, N3. С.586-589.
14. Пастушенко О. Н., ШкловашяН. И. //Журн. физ. химик 1993. Т.67, N 10. С.2073-2077.
15. Способ получения магнитного сорбента: А.с. 1808370 СССР: МКИВ 01 J 20/20, . С 01 В 31/08.
16. Вольфарт Э. Магнитно-твердые материалы, М.; Л.: Госэнергоиздат, 1963. 232с.
17. Кондорский Е. И. // Докл. АН СССР. 1951. Т. 80, N 2. С.197-200.
18. Комаров В.С., Репина Н.С., Скурко О.Ф.//Весцi Ан БССР. Сер. хiм. навук. 1991. №2. С. 3-7
19. Чубарь Т. В., Хворое М. М., Овчаренко Ф. Д., Химченко Ю.И. // Коллоид, журн. 1981. Т.43. N 3. С.535-539.
20. В.С. Комаров, Адсорбенты. Вопросы теории, синтеза и структуры, Мн., «Беларуская навука», 1997
21. Комаров В.С., Романчик Е.Е., Репина Н.С., Скурко О.Ф.//Весцi Ан БССР. Сер. хiм. навук. 1993. №2. С. 12-18
22. Комаров В.С., Репина Н.С., Романчик Е.Е., Скурко О.Ф.//Весцi Ан БССР. Сер. хiм. навук. 1993. №4. С. 8-11
23. Комаров В.С., Репина Н.С., Скурко О.Ф.//Весцi Ан БССР. Сер. хiм. навук. 1995. №4. С. 23-28
24. Матусевич Н.П. Разработка методик получения магнитных жидкостей целевого назначения.// дисс. АН БССР. Мн, 1988
25. Ребиндер П.А. Современные проблемы коллоидной химии // Коллоидный журнал, 1958. - Т.ХХ, 4. - С.527-529.
26. Воюцкий С.С. Курс коллоидной химии. - М.: Химия, 1975. -512 с.
27. Overbuk J. Recent Developments in the Understanding of Sta-bulity // J.Coll. and Interf. Science. -1977. Vol.58, 2.-P.4o8-422.
28. Бибик E.E., Лавров И.Г. Об устойчивости дисперсии ферромагнетиков // Коллоидный журнал, 1965. - Т.ХХУII. - I 5, - С.652-655.
29. Фролов Ю.Г. Коллоидная химия. - М.: Химия, I982,
30. Napper D. Steric Stabilization // J.Colloid and Interf. Science.-1977.-Vol.8, 2.-P.390-407.
31. Stefan Odenbach “ Magnetoviscous Effects in Ferrofluids”/ Max Planck Institut for kohlenforschung; Mulheim a.d. Ruhr; Sprinder, 2002
32. Berkovsky, B. M., Medvedev, V. F. and Krakov, M. S. (1993) Magnetic Fluids, Engineering Applications. Oxford University Press, Oxford, New York, Tokyo
33. Berkovsky, B. M. and Bashtovoy, V. (1996) Magnetic fluids and applications handbook, begell house, inc.. New York, Wallingford (UK)
34. Зонтаг Г., Штренге К, Коагуляция и устойчивость дисперсных систем / Пер. с нем., под ред. О.Г.Усьярова. - Л., Химия, 1973. - 152 с.
35. Бибик Е.Е., Бузунов О.В., Гермашев В. Г. Исследование устойчивости коллоидных растворов ферромагнетиков в неполярных жидкостях по дифракции света на пермаллоевых пленках // Коллоидный журнал. 1976. - Т.ХХХУIII, №5. - С.966-969.
36. Sholten P.S. Colloid Cemistry of Magnetic Fluids // In:Thermomechanics of magnetic fluid, B.Berkovsky Ed Washington D.C., Hemiephere.-1977-P.1-2.
37. Парфит Г. Адсорбция из растворов на поверхностях твердых тел / Под ред.Рочестера К. - M.
38. Мителл К. Мицеллообразованне, солюбилиэация и микроэмульсии. - М.: Мир, 1980.
39. Михайлов Н.В., Ребиндер П. А. О структурно-механических свойствах дисперсных и высокомолекулярных систем // Коллоидный журнал, 1955. - Т.17. - С.107
40. Лунина Н.А. и др. Коллоидно-химические основы получения устойчивых золей ферромагнетиков в различных средах // Гидродинамика и теплофиэика магнитных жидкостей: Всесоюзный симпозиум (Юрмала, 30 сентября - 2 октября 1980), тез.докл. -Саласпилс: 1980. - C.I3-20.
41. Кроит Г.Р. Наука о коллоидах / Под ред. В. П.Мишина - М.: Из-датинлит, 1955. - 538 с,
42. Caslmir H.B.G., Polder D. The Influence of Retardation on the London-Van der Waals Forces // Physical Review, 1948 Vol.73,N4.-P.360-372.
43. Pat.3215572, Int.kl. H01F/1/10 Low Viscosity Magnetic Fluid Obtalneddb - the colloidal Suspension of Magnetic Particles / US. Papell /USA/.
44. Pat.3700595, Int.kl. H01F 1/10 Ferrofluid Composition / Kaiser R./USA/.
45. Проспект фирмы."Ferrofluids Corporation". 144 Middlesex Turnpuke, Burlington, Masaachuset, 01803, 1972.
46. Проспект фирмы "ВАКО КОЕКИ" МАРПОМАГНА - магнитная текучая среда. 1977.
47. Moskowitz R. Ferrofluids Liquid Magnetics // JEEE, Spektrum. 1975-12/3-P.53-57.
48. Пат. 3784471 США Int.kl. C10M 3/02, Solid Addatives Dispersed in Perfluorinated Liquids with Perfluoalkil Ether Dispersants / R. Kaiser /USA/.
49. Пат. 77-95095 Япония. Magnetik Fluids / A. Taketoni. Japan/.
50. Kaiser R., Miskolczy G/ Magnetic Properties of stable Dispersions of Subdomain Magnetic Particles // J. of Appl. Phisics- 1970-Vol.40, 3-P. 1064-1072.
51. Пат. 4604222 США. Int.kl. H01F ½, Stable ferrofluid composition and its use / L.Bordu, K.Raj /USA/.
52. Пат. 3764540 США. Int.kl. H01F 1/28. Magnetofluids and theer Manufacture / S.E.Khalafalla, G.W.Reimers /USA/.
53. Khalafalla S.E. Magnetic flalds / Chem. Technol.-1975-Vol.5, Nº19-P.540-546.
54. Пат. 3843540 США. int.kl. H01F 1/28, Production of Magnetic Fluids by Peptissation Techniques / G.W. Reimers, B. and S.E. Khalafalla /USA/.
55. Натансон Э.М. и др. Образование на катоде высокодисперсного кобальта // Порошковая металлургия. - 1969. - № 6. - С.18-23.
56. Матусевич Н.П., Орлов Л.П., Самойлов В.Б., Фертман В.Е. препринт №12/ИТМО АН БССР, 1985г «Получение и свойства магнитных жидкостей».
57. А. с. СССР № 988047 «Магнитная жидкость на воде» - Матусевич Н.П., Пахубо В.К., Самойлов В.Б. (СССР)
58. Пат. 8673305 Япония. МКИ H01F 1/28, Magnetic fluid / Wakajama Katsuhiko, Harada Hiroshi /Japan/.
59. Бибик Е.E. Приготовление феррожидкости // Коллоидный журнал.-1973. - Т.36. № 6. - C.1141-1142.
60. А. с. 457666 СССР, МКИ C01G 49/08. Способ получения феррожидкости / Е.Е.Бибик, И.С.Лавров.
61. Пат. 4430239 США, МКИ HOIF 10/10. Ferrofluids composition / J.E.Wyman /USA/.
62. Lefebure, S., Dubois, E., Cabuil, V., Neveu, S. and Massart, R (1998) Monodisperse magnetic nanoparticles: Preperation and dispersion in water and oils. Journal of Materials Research, 13, 10 p. 2975
63. Kekalo Katsiaryna Aleksandrovna, Goroshko Nikolaj Nikolaevich "Development of method of preparation of stable and cheap magnetic fluids" proc. ECIS 2002 (XVIth Conference of the European Colloid and Interface Society), 22- 27 Sept. 2002, Paris, p. 202.
64. Wagener, M., Gunther, B. and Blums, E. (1999) Preparation of oxidation resistant cobalt oil colloids. J. Magn. and Magn. Mat., 201, p. 18
65. А. с. 516861 СССР, Ферромагнитная жидкость для магнитожидкостных уплотнений /Д.В.Орлов, В.Г.Курбатов, В.А.Силаев, А.В.Сизов.
66. Пат. 3228881 США, Dispersions of Discrete Particles of Ferromagnetic Metals / J.R.Thomas /USA/.
67. Пат. 3228882 США, -| Dispersions of Ferromagnetic Cobalt Particles / O.L.Harle, B. and J.Thomas /USA/.
68. Пат. 3281344. США. Colloidal suspension of Ferromagnetic Iron Particles / J.R.Thomas /USA/.
69. R. Brinkmann, H. Bönnemann, W. Brijoux, N. Matoussevitch, B. Günther, V. Kempter Stabilization of magnetic Co(0) particles (10 nm) by “Smooth Air Oxidation” proc. ECIS 2002 (XVIth Conference of the European Colloid and Interface Society), 22- 27 Sept. 2002, Paris
70. H. Bönnemann, W. Brijoux, R. Brinkmann, N. Matoussevitch, N. Waldöfner, N. Palina, H. Modrow A size-selective Synthesis of air stable colloidal Magnetic Cobalt Nanoparticles proc. ECIS 2002 (XVIth Conference of the European Colloid and Interface Society), 22- 27 Sept. 2002, Paris
71. Лунина М.А., Новожилов Ю.А. Электрический конденсационньй способ получения органозолей металлов // Коллоидный журнал. -1969. - Т.З1, NºЗ,- С.467-470.
72. Мозговой Е.Н., Блум Э.Я. Магнитные свойства мелкодисперсных ферросуспензий, синтезируемых электроконденсационным способом // Магнитная гидродинамика. - I971. - Т. 18, Nº44. -С.18-23.
73. Каган И.Я., Рыков В.Г., Янтовский Е.И. Магнитная гидоодина-мика. - 1970. - Т.17. № 2. - С.155.
74. Федоненко А. И. Температурная зависимость вязкости электропроводной магнитной жидкости. - В кн. Ш Всесоюзн.совещ. по физике МЖ. Тез.докл. - Ставрополь. - 1986. - С. 108-109.
75. Shepherd P.J., J.Phys.D.Appl.Pys.-1970-Vol.3, Nº12-P.1925.
76. Shepherd P.J., Popplewell J., Charles S.W,, J.Phys.D.Appl.Phys. 1972-Vol.5, Nº 12-P. 2273.
77. Пат. 3130044 США, Magnetic Mercury / Emerson S.T. /USA/.
78. Пат. 3531413 CША, МКИ H01F 1/28. Method of Substituting One Ferrofluid Solvent for Another / Rosenszweig R.E. /USA/.
79. Пат. 3917538 США. МКИ H01F 1/28 Ferrofluid Composition and Process of Mahing Same / Rosenazweig R.E. /USA/.
80. Пат. 4430239 США, ISM H01F 10/10, Ferrofluid composition / Wyman J.E. /USA/.
81. Касперович Т.И. «Изучение процесса формирования пленок оксидов железа из коллоидных систем с водной дисперсионной средой»/ дипл., БГУ, Минск, 1988г.
82. Бурш В.В. «Изучение процесса формирования пленок оксида железа из коллоидных систем с неводной дисперсионной средой»/дипл., БГУ, Минск, 1988г.
83. С. Грег, К. Синг. Адсорбция. Удельная поверхность. Пористость. Пер. с англ. А.П. Карнаухова, М., Мир, 1984г.
84. А.Л. Клячко-Гуревич. Упрощенный метод определения поверхности по адсорбции воздуха. Изв. Акад. Наук, 1961, №10, с.1884-1886.
85. Магнитный собиратель-адсорбент для удаления нефтяных разливов с поверхности воды и с твердых поверхностей «Нефтеклин» // SciTecLibrary.ru http://sciteclibrary.ru/rus/catalog/pages/5777.html. 06.08.2003г.//
Резюме
Данная работа посвящена изучению возможности применения магнитных жидкостей для синтеза магнитных сорбентов.
В настоящей работе представлены новые методы получения магнитных сорбентов, основанные на использовании различных магнитных жидкостей. Использование именно жидкого материала для пропитки сорбента (и придания ему тем самым магнитных свойств) выгодно отличает предложенный нами способ от описанных в литературе. Применение различных магнитных жидкостей (в отличие от магнетита определенного состава) позволяет в широких пределах варьировать свойства получаемого сорбента.
Исследования показали, что при намагничивании сорбента при помощи магнитных жидкостей его удельная поверхность уменьшается незначительно. Таким образом, сорбент приобретает ценные магнитные свойства не утрачивая своих индивидуальных свойств.
Данная работа прысвечана вывучэнню магчымасцi выкарыстання магнiтных вадкасцей для сiнтэзу магнiтных сарбентаỹ.
Ỹ рабоце прадстаỹлены новыя метады атрымання магнiтных сарбентаỹ, заснаваныя на выкарыстаннi розных магнiтных вадкасцей. Выкарыстанне менавiта вадкага матэрыялу для прапiткi сарбента (i дадання тым самым магнiтных уласцiвасцей) выгадна адрознiвае прапанаваный намi спосаб ад апiсанных у лiтаратуры. Выкарыстанне розных магнiтных вадкасцей (у адрозненне ад магнетыту пэỹнага складу) дазваляе ỹ шырокiх межах вар’iраваць уласцiвасцi атрыманага сарбента.
Даследваннi паказалi, што пры намагнiчваннi сарбента пры дапамозе магнiтных вадкасцей яго удзельная паверхнасць змяньшаецца нязначна. Такiм чынам, сарбент атрымоỹвае карысныя магнтныя ỹласцiвасцi i не губляе сваiх асабiстых ỹласцiвасцей.
This work devotes to study the possibility of use the ferrofluids for magnetic sorbents syntheses.
In the present work new methods of reception of the magnetic sorbents, based on use of various magnetic liquids are submitted Use of a liquid material for impregnation of a sorbent (and giving to it thus magnetic properties) favourably distinguishes the way offered by us from described in the literature. Application of various magnetic liquids (as against magnetite the certain structure) allows to vary properties of a received sorbent over a wide range.
Researches have shown, that at magnetization of a sorbent by means of magnetic liquids its specific surface decreases a little bit. Thus, the sorbent gets valuable magnetic properties not losing the individual properties.
.
Приложение
|
|
|
|
|
|
|
|
|
|
|
|

Рис.24 Результат термического анализа активированного угля
| |
| |
|
|
|
|
|
|
|
|
|
|

Рис.25 Результат термического анализа активированного угля с магнетитом
| |
| |
|
|
|
|
|
|
|
|
|
|
|

Рис.26 Результат термического анализа активированного угля, пропитанного МЖ (водн, олеат ТЭА)
| |
| |
Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов
Дипломная работа студентки 5-го курса
Кекало Екатерины Александровны
Руководитель
канд. хим. наук, доцент Н.Н. Горошко
Рецензент
доктор хим. наук,
профессор Е.А. Стрельцов
Дипломник Е.А. Кекало
"Допустить к защите" 04.06.2004
Зав.кафедрой
Доктор хим. наук С.К. Рахманов
г. Минск,
2004г.
Содержание:
Содержание
Введение
1. Обзор литературы
1.1.Магнитные сорбенты
1.1.1. Синтез пористых ферритов с применением выгорающих добавок
1.1.2. Неорганические магнитонаполненные адсорбенты
1.1.3. Углеминеральные магнитные сорбенты
Изотермы адсорбции
1.2.Магнитная жидкость как коллоидная система
1.2.1.Устойчивость магнитных жидкостей
1.2.2.Обзор методов получения магнитных жидкостей
1.2.2.1.Дисперсионные методы получения MЖ
1.2.2.2.Методы конденсации
2. Методика эксперимента
2.1. Синтез магнитного материала
2.1.1. Синтез магнетита
2.1.2. синтез магнетита
2.1.3. Синтез магнитной жидкости с водной дисперсионной средой и стабилизатором олеатом ТЭА
2.1.4.Синтез магнитной жидкости с водной дисперсионной средой и стабилизатором олеатом аммония
2.1.5. Синтез магнитной жидкости с водной дисперсионной средой и минеральными кислотами в качестве стабилизатора
2.1.6. Синтез магнитной жидкости с деканом в качестве дисперсионной среды и стабилизатором олеиновой кислотой
2.1.7. Синтез магнитной жидкости с керосином в качестве дисперсионной среды и стабилизатором олеиновой кислотой
2.2. Синтез магнитного сорбента
2.2.1. Синтез намагниченного сорбента 1
2.2.2. Синтез намагниченного сорбента 2
2.2.3. Синтез намагниченного сорбента 3
2.2.4. Синтез намагниченного сорбента 4
2.2.5. Синтез намагниченного сорбента 5
2.2.6. Синтез намагниченного сорбента 6
2.2.7. Синтез намагниченного сорбента 7
2.3. Методики анализа
2.3.1. Определение содержания Fe(II) при помощи количественного анализа..
2.3.2. Определение содержания Fe(III) при помощи количественного анализа
2.3.3. Определение содержания Fe(II) и Fe(III) в осадке, образующемся при соосаждении гидроксидов при помощи количественного анализа
2.3.4. Упрощенный метод определения поверхности по адсорбции воздуха
2.3.5.Эктронномикроскопическое исследование
2.3.6. Рентгенографическое исследование
2.3.7. Дериватографичеекое исследование
3. Результаты и их обсуждение
3.1. Рентгенофазовое исследование
3.2. Количественный анализ
3.3. Изотермы адсорбции
3.4. Электронная микроскопия
3.5. Удельная поверхность
3.6. Намагниченность
3.7. Дериватографическое исследование
Выводы
Литература
Резюме
Приложение
Введение
Данная дипломная работа посвящена синтезу и изучению магнитных сорбентов, представляющих собой магнитный (либо намагниченный) материал с высокими адсорбционными свойствами.
Преимущество таких адсорбентов по сравнению с обыкновенными (не магнитными) состоит в том, что обладая высокой сорбционной емкостью они могут управляться при помощи магнитного поля. Адсорбенты с магнитными свойствами применяются для контактной очистки веществ, что существенно упрощает адсорбционный процесс и полноту отработки адсорбента, исключает стадию отделения отработанного адсорбента от раствора, являющуюся одной из трудоемких, заменив ее магнитной сепарацией. Магнитные сорбенты уже широко используются для очистки сточных вод, сбора нефти с поверхности водоемов и в медицине (очищают костный мозг и др.) [1-8].
Придание сорбентам магнитных свойств может обеспечить значительное повышение эффективности их использования, поскольку открывается возможность вводить сорбенты в очищаемую среду в виде дисперсной фазы при контролируемой поверхности межфазного контакта и извлекать из среды физическим методом. Известно [8], что придание сорбентам магнитных свойств обычно не снижает емкости и селективности сорбции, а в ряде случаев улучшает эти характеристики, повышая также скорость процесса сорбции – десорбции. Известно также, что магнитные сорбенты способны улучшать ионообменные свойства почв, что указывает на возможность использования материалов данного типа для направленного изменения свойств биологических систем.
Использование данных адсорбентов не ограничивается указанными областями их применения, тем более что они с технологической точки зрения во многих адсорбционных процессах наиболее предпочтительны.
Есть много способов их получения, принципиально отличающихся друг от друга. Большинство из них являются трудоемкими и влекут за собой большие энергетические затраты, что существенно сужает диапазон возможного применения магнитных сорбентов.
На кафедре неорганической химии Белгосуниверситета им. В.И. Ленина в течение нескольких десятков лет проводятся исследования по применению коллоидных систем на основе олова, вольфрама, ванадия, железа и некоторых других металлов для получения пленок и тонких покрытий.
Целью настоящей работы является разработка способа синтеза магнитоуправляемых сорбентов при использовании магнитной жидкости и изучение некоторых их свойств.
Актуальность поставленной в работе задачи подчеркивается потребностью различных областей науки и техники в недорогих магнитоуправляемых сорбентах. Так, магнитоуправляемые сорбенты, используемые для сбора нефти с поверхности водоемов, в медицине и других областях представляют собой дорогостоящие материалы, изготовление которых требует использования сложных технологических процессов и не менее сложного и дорогого оборудования.
Использование именно жидкого материала для пропитки сорбента (и придания ему тем самым магнитных свойств) выгодно отличает предложенный нами способ получения магнитных сорбентов от описанных в литературе [1-7]. Применение различных магнитных жидкостей (в отличие от магнетита определенного состава) позволяет в широких пределах варьировать свойства получаемого сорбента.
Автор считает необходимым выразить признательность к.х.н., научному сотруднику Макс Планк института угольных исследований, Мюлхайм ан дер Рур, Германия, Матусевич Н.П. и к.х.н., научному сотруднику Академии Наук Беларуси Самускевичу В.В. за помощь в выполнении физико-химических исследований а также за ценные замечания и пожелания высказанные в ходе обсуждения результатов.
Обзор литературы.
Магнитные сорбенты
Дата: 2019-05-28, просмотров: 314.