Химизм процесса
Образование формальдегида происходит при прохождении метаноло -воздушной смеси через слой катализатора "серебро на носителе" при температуре в зоне контактирования:(550 - 600)°С при работе в "мягком" режиме, (660 - 700)°С при работе в "жестком" режиме.
Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола:
СН3 ОН → СН2 О + Н2 - 93,4 кДж/моль (3.1)
СН3 ОН + 1/2 О2 → СН2 О + Н2 О + 147,4 кДж/моль (3.2)
Наряду с этими реакциями в системе протекает целый комплекс побочных превращений.
СН3 ОН + 2/3 О2 → СО2 + 575,1 кДж/моль(3.3)
СН2 О + 1/2 О2 → НСООН + 270,4 кДж/моль(3.4)
НСООН + 1/2 О2 → СО2 + Н2 О + 14,5 кДж/моль(3.5)
НСООН → СО + Н2О - 53,7 кДж/моль(3.6)
СН2 О → СО + Н2 + 1,9 кДж/моль (3.7)
2 СН2 О + Н2 О → СН3 ОН + НСООН + 122,0 кДж/моль(3.8)
Н2+ 1/2 О2 → Н2 О + 241,8 кДж/моль(3.9)
2 СН3 ОН → СН2 (ОСН3 )2 + Н2 О + 131,0 кДж/моль(3.10)
СО + 1/2 О2 → СО2 + 283,0 кДж/моль(3.11)
2 СО → СО2 + С + 172,5 кДж/моль (3.12)
Реакции (3.3) и (3.4) являются равновесными. Доля метанола израсходованного по реакции (3.4) составляет около 60 %, а остальное, по реакции (3.3).
Превращение метанола в формальдегид происходит в результате контакта молекул спирта с кислородом, хемосорбированным на атомах серебра, т.е. активными центрами катализатора являются поверхностные окислы серебра. Процесс получения формальдегида в целом сопровождается выделением тепла, за счет которого поддерживается необходимая температура в зоне контактирования и равновесие реакции дегидрирования смещается вправо.
Побочные реакции снижают выход формальдегида и определяют состав выхлопных газов (абгазов).
Механизм процесса
Ключевые превращения осуществляются на поверхности катализатора. Метанол адсорбируется на поверхности окисленного серебра. На поверхности свободного неокисленного серебра метанол адсорбируется очень слабо, причем с ростом температуры, количество поглощенного продукта уменьшается. Превращение поглощенного продукта уменьшается молекул спирта с кислородом, химсорбированным на атомах серебра, т.е. активными центрами катализатора являются поверхностные окислы серебра. В процессе хемосорбции кислорода на атомах серебра на адсорбированный кислород, происходит его диссоциация на атомные ионы (атомарная адсорбция). Выделяют 3 типа (области) адсорбции в зависимости от степени окисления серебра. При степени окисления до 0,1 - 0,12 см3 О2/м2 Ag, т.е. в пределах покрытия поверхности монослоем кислорода, один атом кислорода связан с двумя поверхностными атомами серебра (Ag2SО):
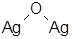 (3.14)
(3.14)
С увеличением степени окисления до (0,22-0,26) см3 О2/м2Ag преобладает соединение, в котором атом кислорода связан с одним атомом поверхностного серебра (AgSO или Ag2SO2):
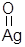 или
или 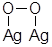 (3.15)
(3.15)
При дальнейшем окислении возникает структура с большим содержанием кислорода на атом серебра:
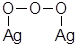 (3.16)
(3.16)
Каталитическая специфичность серебра обуславливается особым состоянием кислорода на серебре. В то время как на других металлах при активированной адсорбции кислорода образуется только атомные ионы О- или О2-, вызывающие сгорание исходного продукта до углекислого газа, на серебре образуются поверхностные молекулярные ионы типа О2- или О22-. Поверхностный ион в состав поверхностного оксида Ag2+O2-. Атомные ионы, образующие с серебром активные центры при адсорбции метанола на них ослабляют или полностью разрывают химические связи в адсорбированной молекуле. Дальнейшие взаимодействия протекают между двумя хемосорбированными частицами, находящихся на соседних активных центрах или между хемосорбированной частицей и физически адсорбированной или налетающей из объема молекулой.
Термодинамика реакций
Реакции окислительного дегидрирования имеют тепловой эффект, зависящий от доли реакций окисления и особенно дегидрирования. Так как окисление протекает с выделением тепла, введением тех или иных количеств кислорода, можно широко вальировать эффект суммарного превращения. Это является одним из преимуществ окислительного дегидрирования – устраняется эндотермичность процесса и необходимость в постоянном подогреве реакционной массы. Практически для получения формальдегида для поддержания необходимой температуры в зоне контактирования, с учетом возмещения потерь тепла в окружающую среду. Необходимо, чтобы процесс шел на 55% через окисление и на 45% через дегидрирование. Тогда процесс можно осуществлять в реакторе адиабатического типа, не имеющего поверхности теплообмена. При таком соотношении реакций дегидрирования и окисления исходная паро-воздушная смесь должна содержать около 40% (объемные доли) метанола, что находится за верхним пределом взрываемости метанола в воздухе [36,5%].
Смещения равновесия реакций окислительного дегидрирования вправо обусловлено связыванием части водорода в воду, которая не принимает участия в равновесии реакций гидрирования – дегидрирования.
|
+0,5О2
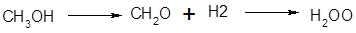 (3.17)
(3.17)
Разбавление метанола на 10 - 12% водой также смещает равновесие в сторону выхода формальдегида, за счет подавления побочных реакций. Образованию побочных реакций препятствует недостаток кислорода в процессе, т.к. глубокое окисление не получает значительного развития. Выход формальдегида на пропущенное сырье достигает 80-85% при степени конверсии метанола 85-90%. При дегидрировании ввиду отщепления водорода всегда происходит увеличение объемов газа, поэтому повышение степени конверсии благоприятствует низкое давление. Поэтому для процессов дегидрирования выбирают давление, близкое к атмосферному, а в некоторых случаях процесс осуществляют в вакууме. В места вакуума можно применять разбавление реакционной массы водяным паром.
В производстве формалина метанол разбавляют на 10 - 12% водяным паром.
Наличие водяных паров в реакционной массе ведет к снижению парциальных давлений реагентов и росту равновесной степени конверсии.
Кинетика реакций
При температуре 600 - 700°С скорость превращения метанола в формальдегид лимитируется подводом реагентов к поверхности катализатора, т.е. процесс протекает во внедиффузионной области. Кинетическая область протекания реализуется при температуре ниже 300°С. Признаки превращения метанола в формальдегид наблюдается уже при температуре 200 - 240°С. Выход формальдегида формальдегида в этих условиях составляет примерно 1% при конверсии метанола 1,5 - 2%.
При температуре 200°С выход формальдегида 3,6% при конверсии метанола 4,6%. Реакции протекают в этом случае по окислительному механизму. При температуре 290 - 300°С реакция смещается в переходную область. При 300°С происходит «зажигание» катализатора. Температура самопроизвольно повышается до 600 - 700°С, соответствующей заданному соотношению О2:СН3ОН. Обратному переходу процесса в кинетическую область способствует снижению температуры до 350°С за счет увеличения скорости потока реагентов. В этом случае формальдегид является промежуточным продуктом реакции: при времени контакта (5 - 10)*10-3 секунд происходит накапливание его, а при дальнейшем времени контакта наблюдается его расходование. Конечный продукт реакции – углекислый газ. При 370 - 400°С процесс перемещается в область внешней диффузии. Протекание процесса в диффузионной области обуславливается значительной разности концентраций реагентов и продуктов реакции на поверхности серебра и в потоке. Само химическое взаимодействие между молекулами метанола и кислорода происходит очень быстро и разогрев катализатора настолько велик, что он оказывается достаточным для поддержания высокой температуры реакции. Конверсия кислорода резко возрастает. На промышленных установках при (600 - 700)°С селективность достигает значений 91 - 93%. Объемное содержание водорода в газообразных продуктах 18 - 20%. То есть проведение реакции в диффузионной области преимущественней, т.к. резко возрастает активность и селективность катализатора, что приводит к значительному повышению производительности катализатора (на 1,5-2,0 порядка) и исключает необходимость подвода тепла из вне для поддержания температуры в реакторе. Максимальная селективность образования формальдегида 90% происходит при значении соотношения О2:СН3ОН в пределах 0,68:0,7. При движении горячей реакционной смеси от слоя катализатора происходит нарастание количества углекислого газа и водорода с одновременным уменьшением формальдегида. Для снижения этого процесса необходимо охлаждение реакционной смеси поверхностью с температурой не выше 170°С. Это осуществляется в подконтактном холодильнике.
Дата: 2019-05-28, просмотров: 340.