Учащиеся, которые работали около доски, отчитываются о выполненном задании.
Давайте посмотрим на доску, где изображен дипептид, состоящий из остатков одной и той же аминокислоты - глицина. Также на доске вы видите две отдельные формулы аминокислот – аланина и валина.
Скажите, на ваш взгляд, может ли образоваться дипептид из разных по составу аминокислот? Для того, чтобы ответить на этот вопрос, обратите внимание на место пептидной связи в дипептиде.
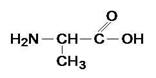
Глицин
 -аминоуксусная кислота
-аминоуксусная кислота
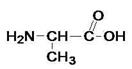
Аланин
 -аминопропионовая кислота
-аминопропионовая кислота
Да, так как в образовании пептидной связи принимают участие аминогруппа одной аминокислоты и карбоксильная группа другой аминокислоты, углеводородные радикалы не принимают участия в образовании пептидных связей.
Как вы думаете, возможно ли дальнейшее присоединение аминокислот к этому веществу? Ответ обоснуйте.
Да, возможно присоединение, так как у молекулы дипептида имеются свободные карбоксильная группа (С – конец) и аминогруппа (N - конец). Цепь может расти с двух сторон.
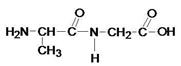
Ала-гли
Сколько вариантов соединения вы можете предложить?
Два. Когда аминокислота глицин стоит на первом месте и когда аминокислота глицин стоит на втором месте?
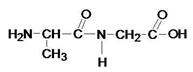
Ала-гли
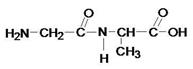
Гли-ала
В клетках и тканях живых организмов обнаружено свыше 170 различных аминокислот, и из них 20 альфа-аминокислот входят в состав важнейших биологических веществ, называемых белками.
Итак, тема нашего урока “Белки. Строение и свойства”.
Давайте попробуем дать определение белков.
Белки - это биологические полимеры, состоящие из альфа-аминокислот.
Очень хорошо. Запишите это определение в свои рабочие листки.
Перед нами две полипептидные цепочки. Какой из пептидов, на ваш взгляд, может являться белком и почему?
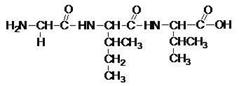
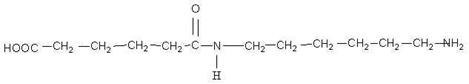
Первая. Потому что образована альфа-аминокислотами.
Верно. Данная полипептидная цепочка представляет собой первичную структуру белка. Итак, за счет каких связей возникает первичная структура белка?
Первичная структура возникает за счет пептидных связей.
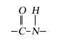
Верно. Давайте запишем это в таблицу.
Но белок гораздо более сложная система, чем полипептидная цепочка. Помимо первичной структуры белка необходимо рассматривать вторичную, третичную, а в некоторых случаях и четвертичную структуры.
В образовании вторичной структуры белка огромную роль играют водородные связи. В начале урока мы вспомнили с вами о том, какие атомы могут участвовать в образовании этого вида связи.
Водород и кислород, азот.
Существуют два типа вторичной структуры ( 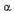 -спираль и
-спираль и 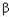 -структура), но в основе каждого из них лежат водородные связи.
-структура), но в основе каждого из них лежат водородные связи.
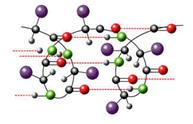
 -спираль
-спираль
Заполним рабочие листки.
Третичная структура белка – это способ расположения  -спирали и
-спирали и  -слоя в пространстве. Осуществляется за счет нескольких типов связей, а именно:
-слоя в пространстве. Осуществляется за счет нескольких типов связей, а именно:
1. Ковалентные связи между атомами серы различных аминокислот (дисульфидные мостики S – S).
2. Гидрофильно-гидрофобные взаимодействия
Гидро – вода
Филос – любовь
Фобос – ненависть
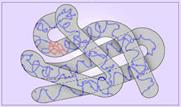
Третичная структура белка.
Заполним рабочие листки.
Некоторые белки образуют четвертичную структуру, осуществляемую за счет все тех же водородных связей и сил электростатического притяжения.
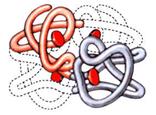
Четвертичная структура белка гемоглобина.
Заполним рабочие листки.
Следует отметить, что белки “работают” правильно только в третичной или четвертичной структурах (если таковая имеется).
Мы рассмотрели строение и теперь переходим к свойствам белков. Ведь, как известно, свойства веществ основываются на их строении. Сначала рассмотрим физические свойства белков.
1. Белки – высокомолекулярные соединения, т.е. это вещества с высокой молекулярной массой от 5 тыс. до миллионов а.е.м. (6500 - инсулин; 32 млн. - белок вируса гриппа).
2. Растворимость белков в воде зависит от их функций. Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это основной строительный материал для тканей: сухожилий, мускульных и покровных. Такие белки в воде не растворимы. Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными видами стали. Пучок волос площадью 1 см2 выдерживает вес в 5 тонн, а на женской косе в 200 тыс. волосинок можно поднять груженый КамАз весом 20 тонн.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд биологических функций, требующих их подвижности, т.е. растворимости. Поэтому глобулярные белки растворимы в воде либо в растворах солей, кислот или оснований. Из-за большого размера молекул образуются растворы, называемые коллоидными.
Демонстрация растворения альбумина в воде.
Теперь переходим к химическим свойствам белков. И опять мы здесь увидим не совсем обычные химические реакции, так как белки являются полимерными молекулами. Посмотрите в свои рабочие карточки и ответьте на следующие вопросы:
1. Какие связи, по Вашему мнению, являются наиболее прочными: пептидные или водородные?
Пептидные, т. к. эта связь относится к ковалентной химической связи.
2. Какие структуры белков будут разрушаться быстрее и легче?
Четвертичная (если таковая имеется), третичная и вторичная. Первичная структура будет сохраняться дольше других, т.к. она образована более прочными связями.
Денатурация – это разрушение белка до первичной структуры (пептидные связи сохраняются).
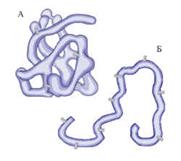
Демонстрация опыта. В 5 небольших пробирок налить по 4 мл раствора альбумина. Первую пробирку нагреть в течении 6 – 10 с (до помутнения). Во вторую пробирку добавить 2 мл 3М HCl. В третью - 2 мл 3М NaOH. В четвертую – 5 капель 0,1 М AgNO3. В пятую – 5 капедь 0.1 М NaNO3.
После проведения опыта на рабочих листках учащиеся заполняют пробелы в следующей фразе:
Денатурация – это разрушение белка до структуры под действием , а также под действием растворов различных химических веществ ( , , солей) и радиации.
Будут ли белки после денатурации проявлять свои специфические свойства?
Большинство белков при денатурации утрачивают биологическую активность, т.к. белки проявляют свои специфические свойства только в высших структурах, т.е. третичной и четвертичной.
Как вы полагаете, можно ли разрушить первичную структуру белка?
Наверное, можно.
Это происходит в вашем организме каждый раз, когда в него поступает белковая пища! Сейчас мы будем рассматривать одно из самых важных свойств белков, а именно – гидролиз.
Гидролиз белка. При гидролизе белка происходит разрушение первичной структуры.
Какие вещества будут образовываться при гидролизе?
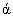 -аминокислоты.
-аминокислоты.
Дата: 2019-04-23, просмотров: 333.