Изучение этой темы основывается на знании учащихся, полученных при изучении курса в 7-8 классах и курса химии в 8-9 классах.
Центральное понятие этой темы – понятие молекулы; сложность его усвоения школьниками связана с тем, что молекула – объект, непосредственно ненаблюдаемый. Поэтому учитель должен убедить 9-ков в реальности микромира, в возможности его познания. В связи с этим большое внимание уделяют рассмотрению экспериментов, доказывающих существование и движение молекул и позволяющих вычислить их основные характеристики. Кроме этого, целесообразно ознакомить учащихся с расчетными методами определения характеристик молекул.
Положения МКТ:
1. Все вещества состоят из молекул. 2. Эти молекулы хаотично и непрерывно движутся. 3. Молекулы взаимодействуют между собой.
Правильное объяснение броуновского движения было дано Эйнштейном спустя 80 лет Сухомлинский построил, а Перрен экспериментально подтвердил теорию броуновского движения. При рассмотрении броуновского движения необходимо сделать следующие выводы: 1. Движение броуновских частиц вызывается ударами молекул вещества о стенки сосуда, в котором они взвешены. 2. Броуновское движение непрерывно и бесконечно. Оно зависит от свойств вещества, в котором эти частицы взвешены. 3. Движение броуновской частицы позволяет судить о движении молекулы среды, в котором частицы находятся. 4. Броуновское движение доказывают существование молнии, их движение которое носит непрерывный и хаотичный характер этого движения.
Вопрос о взаимодействии молекул школьники уже изучали в 10 классе, знания поэтому нужно углубить. Необходимо подчеркнуть следующие моменты: межмолекулярные взаимодействия имеют электромагнитную природу; межмолекулярные взаимодействие характеризуется силами притяжения и отталкивания; силы межмолекулярного взаимодействия действуют на расстояниях не больше 2-3 диаметров молекул. На этом расстоянии заметна лишь сила притяжения, силы отталкивания практически равны нулю; по мере уменьшения расстояния между молекулами силы взаимодействия увеличиваются. Сила отталкивания растет быстрее, чем сила притяжения.
Вводят ряд понятий: Относительной молекулярной (атомной) массой называется отношение массы молекулы данного вещества к 1/12 массы атома углерода.  . Количество вещества – это отношение числа молекул, содержащихся в данном теле к числу атомов, которое содержится в 0,012 кг углерода.
. Количество вещества – это отношение числа молекул, содержащихся в данном теле к числу атомов, которое содержится в 0,012 кг углерода.  ,
,  . Моль – это количество вещества, содержащее в себе столько структурных элементов, сколько атомов содержится в 0,012 кг углерода. Молярная масса – масса 1 моля вещества
. Моль – это количество вещества, содержащее в себе столько структурных элементов, сколько атомов содержится в 0,012 кг углерода. Молярная масса – масса 1 моля вещества  .
.
Если найдем связь между количеством вещества, массой вещества и молекулярной массой, получим: 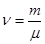 .
.
Идеальный газ. Основное уравнение МКТ. Существует два определения понятия идеальный газ: термодинамическое и молекулярно-кинетическое. В термодинамике под идеальным газом понимают газ, у которого при изотермическом процессе при постоянной массе, давление обратно пропорционально его объему. Другое определение: Идеальный газ – это газ состоящий из большого количества молекул, которые представляют собой материальные точки, не взаимодействующие друг с другом, на расстоянии, но взаимодействуют при столкновении по закону абсолютно упругого удара.
Принимая молекулу газа за материальную точку, исходят из того, что суммарный объем меньше объема сосуда и его можно не учитывать.
Следует отметить, что принятая модель идеального газа работает только тогда, когда газ находится в равновесном состоянии. Эта модель не применима при высоких давлениях и низких температурах.
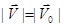 . Доказательство уравнения можно разбить на 4 этапа: 1. Найдем импульс, приобретенный стенкой при ударе одной молекулы газа. mo – масса одной молекулы. Разложим силы на составляющие:
. Доказательство уравнения можно разбить на 4 этапа: 1. Найдем импульс, приобретенный стенкой при ударе одной молекулы газа. mo – масса одной молекулы. Разложим силы на составляющие: 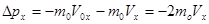 ,
,  . 2. Найдем число молекул, которое возможно дойдут до стенки dC. Число молекул в объеме – половина -
. 2. Найдем число молекул, которое возможно дойдут до стенки dC. Число молекул в объеме – половина - 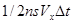 . 3. Общий импульс, полученный стенками сосуда будет
. 3. Общий импульс, полученный стенками сосуда будет 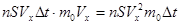 . Из механики известно, что импульс силы равен изменению импульса тела
. Из механики известно, что импульс силы равен изменению импульса тела 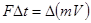 ,
, 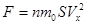 . 4.
. 4. 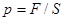 ,
,  ,
, 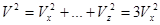 , проекции скорости на оси равны, так как все направления равноправны.
, проекции скорости на оси равны, так как все направления равноправны. 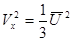 ,
, 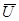 - средняя квадратичная скорость.
- средняя квадратичная скорость. 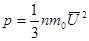 - основное уравнение МКТ.
- основное уравнение МКТ. 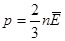 .
.
Следующим шагом в изучении этого вопроса – введение понятия температура. Температура характеризует внутреннее состояние изолированной системы тел, находящихся в состоянии термодинамического равновесия. Можно встретить следующее определение температуры: Температурой называют скалярную физическую величину, характеризующую интенсивность теплового движения молекул изолированной системы в условиях термодинамического равновесия пропорциональную средней кинетической энергии поступательного движения молекул.
Предельная температура, при которой давление идеального газа становится равным нулю, при постоянном объеме или объем газа становится равным нулю при определенном давлении, называется абсолютным нулем температур.
Учитывая, что 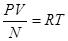 ,
,  ,
, 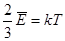 ,
, 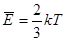 , то есть температура является мерой средней кинетической энергии движения молекул.
, то есть температура является мерой средней кинетической энергии движения молекул.
Дата: 2019-05-28, просмотров: 348.