Лабораторная работа №5
Подготовка к сдаче коллоквиума №5
Лабораторная работа №6
Подготовка к сдаче коллоквиума №6
Лабораторная работа №7
Подготовка к итоговой контрольной работе
Лабораторная работа №8
Подготовка к бланковому тестированию, тестирование:
1. тест по лабораторным работам
2. тест по коллоидным терминам
3. тест-зачет
Зачетное занятие
II . Тестовые задания
Тестовые задания для проверки знаний по дисциплине «Коллоидная химия»
Обведите кружком номер правильного ответа
1. Дисперсные системы состоят из
1) двух дисперсных фаз
2) двух дисперсных сред
3) дисперсной фазы и дисперсионной среды
2. Дисперсная фаза является
1) раздробленной
2) нераздробленной
3. Дисперсные системы
1) гомогенны
2) гетерогенны
4. Дисперсность – величина, обратная
1) размеру частиц
2) удельной поверхности
3) объему частиц
5. Удельная поверхность Sуд – это межфазная поверхность (S1,2), приходящаяся на единицу
1) поперечного размера частиц дисперсной фазы (d) или их массы (m)
2) объема дисперсной фазы (V) или ее массы (m)
3) поперечного размера частиц дисперсной фазы (d) или объема дисперсной фазы (V)
6. зависимость Удельной поверхности сферических частиц от дисперсности
1) Sуд=6D/r
2) Sуд=r/6D
3) Sуд=6Dr
7. Единица измерения удельной поверхности
1) м2/кг
2) м/с
3) м/с2
4) моль/л
8. класс дисперсных систем, к которому можно отнести дисперсную систему, если размер частиц дисперсной фазы равен 10-6 м
1) высокодисперсные
2) среднедисперсные
3) грубодисперсные
9. Лиофобные дисперсные системы термодинамически
1) устойчивы
2) неустойчивы
10. величина поверхностного натяжения σ – это энергия, расчитанная на единицу
1) массы
2) поверхности раздела фаз
3) длины контура
11. взаимодействия между дисперсной фазой и дисперсионной средой в лиофобных дисперсных системах являются
1) слабыми
2) сильными
12. дисперсные системы, образование которых отвечает условию T∆S>∆H, называются
1) лиофильными
2) лиофобными
13. значения межфазового поверхностного натяжения для лиофильных дисперсных систем
1) низкие
2) высокие
14. краевой угол q смачивания лиофильной поверхности удовлетворяет условию
1) 0 < q < 900
2) 900 < q < 1800
3) q = 900
4) q = 00
15. Поверхностное натяжение (σ) равно силе, стремящейся уменьшить поверхность раздела и отнесенной к единице …….. контура, ограничивающего поверхность
1) площади
2) объема
3) длины
16. схема образования поверхностного натяжения σ на примере трех молекул, расположенных на поверхности раздела фаз жидкость – газ
| σ |
| 1 |
| 2 |
| 3 |
| σ |
| F |
| σ |
| σ |
| F |
| газ |
| жидкость |
| F |
| σ |
| газ |
| жидкость |
| газ |
| жидкость |
| 1 |
| 2 |
| 3 |
| 1 |
| 2 |
| 2 |
| 1 |
| 3 |
| 3 |
1) 1
2) 2
3) 3
17. Единица измерения поверхностного натяжения
1) кал/моль
2) Дж/м
3) н/м
4) н/м2
18. Поверхностно-активные вещества межфазовое поверхностное натяжение
1) снижают
2) увеличивают
3) никак не меняют
19. Адгезия –
1) связь между молекулами (атомами, ионами) внутри тела в пределах одной фазы
2) связь между разнородными конденсированными телами при их молекулярном контакте
3) сила, действующая тангенциально на поверхности раздела жидкости (или другого тела) и отнесенная к единице длины контура, ограничивающего поверхность раздела фаз
20. Аутогезия – частный случай адгезии, проявляющийся при соприкосновении тел
1) разнородных
2) однородных
21. Контактное смачивание протекает с участием
1) одной фазы
2) двух фаз
3) трех фаз
22. Количественной мерой смачивания может служить
1) величина работы адгезии
2) краевой угол смачивания
3) инверсия смачивания
23. Краевой угол смачивания - угол между поверхностью и касательной к контуру капли, вершина которого лежит в точке контакта
1) трех фаз (твердого тела, жидкости и газа) и отсчитывается в сторону твердого тела
2) двух фаз (твердого тела, жидкости) и отсчитывается в сторону жидкости
3) трех фаз (твердого тела, жидкости и газа) и отсчитывается в сторону жидкости
24. Закон Юнга
1) о закономерности диффузии
2) об адсорбции, пропорциональной концентрации адсорбтива
3) о равновесии капли жидкости на твердой поверхности
25. Формула для определения равновесной работы адгезии жидкости
1) Wа=sжг(1+cos q)
2) Wа=sжг+cos q
3) Wа= cos q (1+sжг)
26. Адсорбция
1) слипание частиц дисперсных систем при их контакте и образование агрегатов из слипшихся частиц с сохранением границы раздела между частицами
2) взаимодействие, возникающие в водной среде между неполярными частицами, молекулами или неполярными радикалами сложных молекул
3) обратимый процесс эквивалентного обмена между раствором электролита и твердым телом
4) концентрирование веществ на поверхности раздела фаз
27. Адсорбируемое вещество на поверхности раздела фаз
1) адсорбент
2) адсорбат
3) адсорбтив
28. Адсорбат – адсорбируемое вещество
1) на поверхности раздела фаз
2) находящееся в объеме и способное адсорбироваться
3) на которое адсорбируется другое вещество
29. Избыток растворенного вещества в поверхностном слое, отнесенный к единице поверхности, называют удельной
1) поверхностью
2) адсорбцией
3) вязкостью
30. Формула для определения поверхностного натяжения исследуемой жидкости
1) sх=s0×DРх/DР0
2) sх=s0×DР0/DРх
3) sх=DР0×DРх/s0
31. Метод максимального давления в пузырьке основан на
1) измерении объема или веса капли жидкости, медленно отрывающейся от кончика капилляра
2) измерении давления, при котором происходит отрыв пузырька газа (воздуха), выдуваемого в жидкость через капилляр
3) зависимости высоты поднятия жидкости в узком капилляре от ее поверхностного натяжения
32. Удельную адсорбцию на границах раздела жидкость – газ находят по изменению
1) концентрации ПАВ
2) поверхностного натяжения
3) вязкости раствора
33. Размерность адсорбции
1) моль/м2
2) моль/л
3) м2/кг
34. Уравнение адсорбции Гиббса
1) Г = С/RT × ds/dС 2) Г = - ds/dС × RTС 3) Г = - С/RT × ds/dС
35. ряд растворенных веществ, которому соответствуют обозначения кривых на графике зависимостей σ = f(C)
| σ |
| С |
| 2 |
| 3 |
| 1 |
1) 1 – ПИВ, 2 – ПАВ, 3 – ПНВ
2) 1 – ПАВ, 2 – ПНВ, 3 – ПИВ
3) 1 – ПИВ, 2 – ПНВ, 3 – ПАВ
36. Отрицательное значение гиббсовской адсорбции для поверхностно-инактивных веществ означает, что растворенного вещества в объеме находится
1) больше, чем в адсорбционном поверхностном слое
2) меньше, чем в адсорбционном поверхностном слое
3) столько, сколько в адсорбционном поверхностном слое
37. Анализ уравнения адсорбции Гиббса: адсорбция положительна, если
1) ds/dС > 0
2) ds/dС < 0
3) ds/dС = 0
38. Уравнение Фрейндлиха
1) Г = k C1/n 2) Г = k1/n C 3) Г = (kC)1/n
38. Уравнение Ленгмюра
1) Г = Г¥/(1+вС) 2) Г = (1+вС) / Г¥вС 3) Г = Г¥вС/(1+вС)
40. Анализ уравнения Ленгмюра: Г = Г¥, если
1) С ® 0, вС >> 1
2) С ® ¥, вС << 1
3) С ® ¥, вС >> 1
41. Снижение поверхностного натяжения ∆σ в результате адсорбции ПАВ на границе раздела жидкость – газ можно определить при помощи уравнения Шишковского
1) ∆σ = -аln(1+bc)
2) ∆σ = аln(1-bc)
3) ∆σ = аln(1+bc)
4) ∆σ = аln(bc -1)
42. Адсорбенты с диаметром пор 4,1 нм являются
1) микропористыми
2) мезопористыми
3) макропористыми
43. Правило Дюкло - Траубе
1) об уравнивании полярности за счет адсорбированных молекул ПАВ
2) о зависимости поверхностной активности от длины углеводородного радикала адсорбированных молекул ПАВ
3) о зависимости адсорбции от концентрации адсорбтива
44. Зависимость поверхностного натяжения от концентрации растворенного поверхностно-активного вещества
| 1 |
| 2 |
| 3 |
| σ |
| σ |
| σ |
| с |
| с |
| с |
1) 1 2) 2 3) 3
45. Изотерма адсорбции ПАВ представляет собой зависимость
1) s=f(С)
2) Г=f(С)
3) h=f(С)
46. Изотерма адсорбции проходит круче и быстрее достигается предельная адсорбция для
1) С2Н5ОН
2) С3Н7ОН
3) С4Н9ОН
47. Поверхностная активность в гомологическом ряду спиртов С2Н5ОН, С3Н7ОН и С4Н9ОН
1) уменьшается
2) увеличивается
4) величина постоянная
48. ряд спиртов, которому соответствуют обозначения Изотерм поверхностного натяжения на графике
| σ |
| С |
| б |
| в |
| а |
1) а - С2Н5ОН, б - С4Н9ОН, в - С3Н7ОН
2) а - С4Н9ОН, б - С3Н7ОН, в - С2Н5ОН
3) а - С2Н5ОН, б - С3Н7ОН, в - С4Н9ОН
49. Уравнение для определения поверхностной активности G
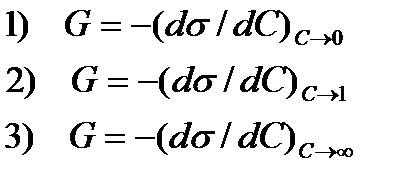
1) 1
2) 2
3) 3
50. Правильная ориентация молекул ПАВ на границе раздела масло/вода
| масло |
| вода |
| 1 |
| вода |
| масло |
| 2 |
| вода |
| масло |
| 3 |
1) 1
2) 2
3) 3
51. Размерность поверхностной активности G
1) Дж/м∙моль
2) Дж∙м/моль
3) Н∙м/моль
4) н/м
52. Предельная адсорбция Г∞ – адсорбция в момент образования
1) монослоя адсорбата
2) бислоя адсорбата
3) полислоя адсорбата
53. Графическое определение предельной адсорбции Г∞
| 1 |
| 2 |
| 3 |
| Г |
| 1/Г |
| С/Г |
| 1/С |
| 1/С |
| 1/С |
| 1/Г∞ |
| 1/Г∞ |
| 1/Г∞b |
1) 1
2) 2
3) 3
54. Адсорбционная способность ионов находится в прямой зависимости от
1) вязкости растворов
2) размеров гидратной оболочки и ее экранирующего действия
3) поверхностного натяжения растворов
55. Для ионов одинакового заряда чем больше порядковый номер элемента, тем его способность к адсорбции
1) ниже
2) выше
56. Катионит имеет закрепленные
1) анионогенные группы и катионы, способные к обмену с окружающей средой
2) катионогенные группы и анионы, способные к обмену с окружающей средой
57. лиотропный ряд Для одновалентных катионов
1) Li+ < Na+ < K+ < Rb+ < Cs+
2) Li+ > Na+ > K+ > Rb+ > Cs+
58. Индифферентный электролит
1) не имеет ионы, способные достраивать кристаллическую решетку коллоидной частицы
2) имеет ионы, способные достраивать кристаллическую решетку коллоидной частицы
59. ДЭС – двойной электрический слой, который образуется на границе раздела фаз из пространственно разделенных электрических зарядов ………………….. знака.
1) одинакового
2) отрицательного
3) положительного
4) противоположного
60. Термодинамически x-потенциал можно определить как работу, необходимую для переноса единичного заряда из бесконечно удаленного элемента объема на
1) поверхность твердой фазы
2) поверхность скольжения
3) границу раздела фаз
61. Мицелла – это коллоидная частица
1) электрически нейтральная
2) положительно заряженная
3) отрицательно заряженная
62. Явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле называется
1) электроосмосом
2) электрокоагуляцией
3) электрофорезом
4) электродиализом
63. Для измерения скорости электрофореза используют
1) прибор Догадкина
2) прибор Ребиндера
3) сталагмометр
4) прибор Рабиновича-Фодиман
64. Величину x-потенциала вычисляют по формуле
1) x=phUэф/e
2) x=eКph/Uэф
3) x=КpUэф/e
4) x=КphUэф/e
5) x=КhUэф/e
65. Градиент потенциала рассчитывают по формуле
1) Н=V/L
2) Н= L/V
3) Н=VL
66. Электрофоретическую подвижность вычисляют по формуле
1) Uэф=Н/tS
2) Uэф=SН/t
3) Uэф=S/tН
67. Весовая модификация седиментационного анализа заключается в определении скорости
1) накопления осадка на чашке весов
2) движения частиц суспензии
3) полного осаждения частиц
68. Для проведения седиментационного анализа суспензии используют седиментационные весы
1) Фигуровского
2) Догадкина
3) Рабиновича-Фодиман
69. К седиментационному анализу приступают в случае
1) применимости закона Гука
2) наличия остаточной деформации коромысла после снятия нагрузки
3) выполнения правила фаз
70. Радиус частиц в седиментационном анализе рассчитывают по формуле
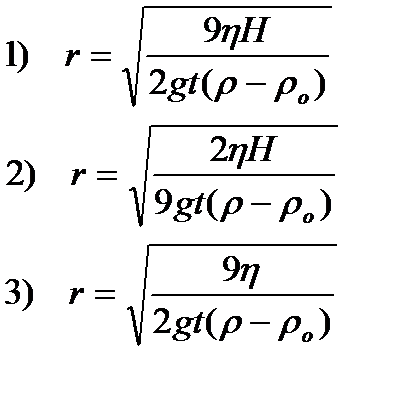
1) 1
2) 2
3) 3
71. Согласно результатам Седиментационного анализа, суспензия мела в воде является системой
1) монодисперсной
2) бидисперсной
3) полидисперсной
72. Вывод о процентном содержании частиц определенного размера в суспензии делается на основании
1) зависимости массы осадка суспензий от времени
2) дифференциальной кривой распределения частиц по радиусам
3) интегральной кривой распределения частиц по радиусам
4) зависимости деформации коромысла от нагрузки
73. Электрофорез – движение
1) частиц дисперсной фазы под действием внешнего электрического поля
2) растворителя или дисперсионной среды через мембрану под действием внешнего давления
3) дисперсионной среды под действием внешнего электрического поля
74. В изоэлектрической точке x-потенциал
1) x > 0
2) x < 0
3) x = 0
75. Определение ξ-потенциала
| А |
| φ |
| r |
| ξ |
| А' |
| А |
| φ |
| r |
| ξ |
| А |
| φ |
| r |
| ξ |
| А' |
| А' |
| 1 |
| 2 |
| 3 |
1) 1
2) 2
3) 3
76. Минимальная концентрация электролита, при которой начинается быстрая коагуляция, называют
1) коагулирующей способностью
2) порогом коагуляции
3) коллоидной защитой
77. рекомендованное вещество, которое является наиболее экономичным коагулятором для золя {m AgI n Ag+ (n - х) NO3-}х+ х NO3-
1) NaF
2) K3PO4
3) Ca(NO3)2
4) K2SO4
5) Al(NO3)3
6) TiCl4
78. рекомендованное вещество, являющееся наиболее экономичным коагулятором для золя {m AgI n I- (n - х)K+}х- х K+
1) NaF
2) Ca(NO3)2
3) K2SO4
4) Al(NO3)3
5) K3PO4
6) TiCl4
79. Порог коагуляции
1) прямо пропорционален шестой степени валентности иона электролита
2) обратно пропорционален шестой степени валентности иона электролита
3) не зависит от валентности иона электролита
80. в формуле мицеллы {mAgI nI- (n-x) K+}x- xK+
1) mAgI - потенциалопределяющие ионы, nI- - агрегат, (n-x) K+ - противоионы адсорбционного слоя, xK+ - противоионы диффузного слоя.
2) mAgI - потенциалопределяющие ионы, nI- - агрегат, (n-x) K+ - противоионы диффузного слоя, xK+ - противоионы адсорбционного слоя.
3) mAgI - агрегат, nI- - потенциалопределяющие ионы, (n-x) K+ - противоионы адсорбционного слоя, xK+ - противоионы диффузного слоя.
81. Формула мицеллы ионостабилизированного золя гидроксида железа
2) {m[Fe(OH)3]nFe3+3(n – x)Cl-}3х+ 3xCl-
3) {m[Fe(OH)3] 3nCl-(n – x)Fe3+ }3х- xFe3+
4) {m[Fe(OH)3]nFe3+(n – x)Cl-}х- 3xCl-
5) {m[Fe(OH)3]nFe3+3(n – x)Cl-}3х- 3xCl-
82. каков заряд частиц золя, если пороги коагуляции сК для следующих электролитов (моль/л) равны: NaCl=50; Al(NO3)3=0,099; К2SO4=49; MgCl2=0,81
1) положительный
2) отрицательный
3) нейтральный
83. Явление синергизма при совместном коагулирующем действии двух электролитов
| С1 |
| С2 |
| 1 |
| 2 |
| 3 |
| 100 |
| 100 |
1) 1 2) 2 3) 3
84. согласно Правилу Шульце-Гарди, коагулирующим действием обладает тот ион электролита, который имеет заряд
1) совпадающий по знаку с зарядом гранулы
2) противоположный заряду гранулы
85. согласно Правилу Шульце-Гарди, коагулирующее действие тем сильнее
1) чем выше заряд иона-коагулятора 2) чем ниже заряд иона-коагулятора
86. Расклинивающее давление – избыточное по сравнению с ……………. фазой давление в тонком слое жидкости, вызванное перекрытием поверхностных сил
1) объемной
2) с поверхностной
87. Положительное расклинивающее давление ……… сближению частиц
1) препятствует 2) способствует
88. После коагуляции золя платины хлорным железом частица платины при электрофорезе
1) не движется 2) движется к аноду 3) движется к катоду
89. Коагулирующая способность P
1) P=1/2Ck 2) P=2Ck 3) P=1/Ck
90. условие медленной коагуляции
1) кэкс<Ктеор 2) кэкс>Ктеор 3) кэкс=Ктеор
91. Влияние индифферентных электролитов на строение двойного электрического слоя
| А |
| +φ0 |
| r |
| +ξ |
| А' |
| 1 |
| А |
| +φ0 |
| r |
| -ξ |
| А' |
| 2 |
| +ξ |
| +φ0 |
| r |
| ξ=0 |
| А' |
| 3 |
| +ξ |
| А |
| -ξ |
| -φ0 |
1) 1 2) 2 3) 3
92. Явление повышения порогов коагуляции при добавлении ВМС называют
1) сенсибилизацией
2) коллоидной защитой
3) коагулирующей способностью
93. Устойчивость – способность дисперсных систем сохранять …………………, если концентрация дисперсной фазы и распределение частиц по размерам остаются постоянными во времени.
1) состав неизменным
2) объем постоянным
3) минимальный размер частиц
94. Пептизация –
1) оседание частиц дисперсной фазы в жидкой или газовой дисперсионной среде
2) процесс, обратный адсорбции
3) процесс, обратный коагуляции, т.е. переход осадка золя во взвешенное состояние с одновременным дроблением агрегатов на отдельные частицы
4) самопроизвольный процесс переноса растворителя (дисперсионной среды) через мембрану из растворителя (менее концентрированного истинного или коллоидного раствора ) в раствор (или в более концентрированный раствор)
95. Суммирование коагулирующего действия электролитов называется
1) аддитивностью
2) синергизмом
3) антагонизмом
96. Способность защищать золи от коагуляции количественно выражают защитным числом, равным числу миллиграммов сухого ВМС, защищающего
1) 10 мл золя от коагуляции при приливании к золю 100 мл 1 %-ного раствора NaCl
2) 10 мл золя от коагуляции при приливании к золю 1 мл 10 %-ного раствора NaCl
3) 1 мл золя от коагуляции при приливании к золю 10 мл 1 %-ного раствора NaCl
97. Явление неправильных рядов – это чередование зон устойчивого и неустойчивого состояний золей, когда нельзя сделать однозначного заключения о том, что с увеличением концентрации электролита стабильность золя
1) повышается
2) снижается
98. Диспергирование
1) определение размеров, формы и концентрации частиц дисперсной фазы
2) оседание частиц дисперсной фазы в жидкой или газовой дисперсионной среде
3) получение частиц дисперсной фазы из сплошного и более крупного по размерам тела
99. получить золь серы в воде
1) нельзя, так как сера практически нерастворима в воде
2) можно, используя метод замены растворителя
100. Химическая пептизация применяется в том случае, когда электролит-пептизатор
1) отсутствует в готовом виде
2) находится в избытке
101. Размерность коэффициента диффузии
1) м / с
2) м2/ с
3) Дж/(К×моль)
102. Самопроизвольное выделение жидкости из студней и гелей, уменьшение их объема за счет упрочения каркаса, состоящего из макромолекул ВМС или высокодисперсных частиц –
1) солюбилизация
2) синерезис
3) синергизм
103. Дисперсные системы, дисперсная фаза и дисперсионная среда которых состоят из взаимонерастворимых или слаборастворимых жидкостей –
1) суспензии
2) эмульсии
3) золи
104. Аэрозоли – дисперсные системы, в ………………… дисперсионной среде которых находятся твердые во взвешенном состоянии и (или) жидкие частицы дисперсной фазы
1) жидкой
2) твердой
3) газовой
105. Слияние капель или пузырьков внутри подвижной дисперсионной среды и образование частиц большего размера по сравнению с исходным –
1) когезия
2) коагуляция
3) адсорбция
4) коалесценция
5) адгезия
106. Высаливание –
1) увеличение массы и объема ВМС в результате поглощения низкомолекулярной жидкости или ее пара
2) совокупность коллоидно-химических процессов, которые приводят к удалению загрязнений с различных поверхностей, удержанию этих загрязнений с растворенными молекулами ПАВ и сообщающие объемные свойства раствору ПАВ
3) разрушение электролитами сольватной оболочки макромолекул ВМС, в результате чего они теряют растворимость и выпадают в осадок
107. Поверхностно-активные вещества –
1) вещества дифильного строения, молекулы которых имеют гидрофильную часть и гидрофобный радикал, способные самопроизвольно адсорбироваться на границе раздела фаз и снижать поверхностное натяжение
2) вещества, растворение которых вызывает повышение поверхностного натяжения жидкостей
3) состоят из макромолекул, размеры которых соответствуют высокодисперсным системам, а их масса изменяется от нескольких тысяч до миллионов
108. Гидрофильно-липофильный баланс –
1) связь между молекулами (атомами, ионами) в пределах одной фазы внутри тела
2) взаимодействия, возникающие в водной среде между неполярными частицами, молекулами или неполярными радикалами сложных молекул
3) баланс гидрофильного и лиофильного взаимодействия на границе вода-масло
109. Лиофильные эмульгаторы способны стабилизировать эмульсию
1) прямую
2) обратную
3) прямую и обратную
110. Солюбилизацией называют
1) включение нерастворимых и слаборастворимых веществ в состав мицелл коллоидных ПАВ
2) способность структурированных систем восстанавливаться после разрушения
3) оседание частиц дисперсной фазы в жидкой или газовой дисперсионной среде под действием гравитации
111. Золи –
1) седиментационно-неустойчивые средне- и грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой
2) седиментационно-устойчивые высокодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой
3) седиментационно-устойчивые средне- и грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой
112. Диализ –
1) самопроизвольный процесс перехода примесей через мембрану, применяемый для очистки коллоидных растворов и растворов ВМС
2) фильтрование коллоидного раствора через полупроницаемую мембрану, пропускающую дисперсионную среду с низкомолекулярными примесями и задерживающую частицы дисперсной фазы или макромолекулы
113. Прямая эмульсия – это дисперсии
1) масла в воде
2) воды в масле
114. Повышение агрегативной устойчивости эмульсии можно достигнуть введением веществ, называемых
1) коагуляторами
2) эмульгаторами
3) пептизаторами
115. Кратность пены b показывает во сколько раз
1) объем пены превышает объем жидкости, необходимый для ее формирования
2) объем жидкости превышает объем пены, необходимый для ее формирования
116. Смог это
1) Т, Ж / Г
2) Т, Г / Г
3) Т / Г
117. Пены – высококонцентрированные и концентрированные дисперсные системы типа ………….., в которых пузырьки газа, образующие дисперсную фазу, находятся между слоями жидкости, из которой формируется дисперсионная среда
1) Т/Ж
2) Г/Ж
3) Ж/Г
4) Г/Т
118. Треугольник Плато
| 1 |
| 2 |
1) 1 – пленки жидкости, 2 - канал
2) 1 – канал, 2 – пленки жидкости
3) 1 и 2 – каналы
4) 1 и 2 – пленки
119. Суспензии – седиментационно-неустойчивые ……………………… системы с твердой дисперсной фазой и жидкой дисперсионной средой
1) средне- и высокодисперсные
2) высоко- и грубодисперсные
3) средне- и грубодисперсные
120. Синерезис – самопроизвольное
1) выделение жидкости из студней и гелей, уменьшение их объема за счет уплотнения каркаса
2) поглощение жидкости студнями и гелями, увеличение их объема за счет набухания каркаса
121. Студни, которые содержат небольшое количество сухого вещества, называют
1) лиогелями
2) ксерогелями
122. Гели – структурированные высокодисперсные системы с жидкой дисперсионной средой, состоящие из заполненного жидкостью каркаса, который образует структуру из частиц
1) дисперсионной среды
2) дисперсной системы
3) дисперсной фазы
123. При помощи рН среды изменить ионизационную способность макромолекул белков
1) можно
2) нельзя
124. При высаливании белков и других ВМС иногда наблюдается образование капель новой жидкой фазы, называемой
1) коацерватом
2) мицеллой
3) гелем
125. Схема различных состояний молекул коллоидных ПАВ
1) поверхность раздела фаз Û истинный раствор Û коллоидный раствор, мицеллы
2) поверхность раздела фаз Û коллоидный раствор, мицеллы
3) истинный раствор Û коллоидный раствор, мицеллы
126. Коллоидные ПАВ можно классифицировать в зависимости от их способности к диссоциации на
1) ионогенные и неионогенные
2) ионогенные и амфолитные
3) неиногенные и катионные
127. Концентрация коллоидных ПАВ, при которой в растворе возникают мицеллы, находящиеся в термодинамическом равновесии с молекулами (ионами) ПАВ –
1) порог коагуляции
2) критическая концентрация мицеллообразования
3) солюбилизат
128. Мицеллы в неводных растворах коллоидных пав
| 1 |
| 2 |
| 3 |
1) 1
2) 2
3) 3
129. Критическая концентрация мицелообразования –
1) наименьшая концентрация коллоидных ПАВ, при которой начинается слипание частиц
2) такая концентрация коллоидных ПАВ, при которой в растворе возникают мицеллы, находящиеся в термодинамическом равновесии с молекулами ПАВ раствора
3) такая концентрация коллоидных ПАВ, при которой в растворе возникают мицеллы и формируется граница раздела
130. Набухание – увеличение …………….. макромолекул ВМС в результате поглощения низкомолекулярной жидкости или ее пара
1) давления и молекулярной массы
2) массы и объема
3) массы и плотности
4) объема и молекулярной массы
131. Кинетика коагуляции идет по механизму реакции ………. порядка
1) нулевого
2) первого
3) второго
132. Единица измерения вязкости
1) Па×с
2) н/м
3) Дж/м2
4) пуаз×с
133. Графическое определение константы скорости набухания
| ln(α∞/α∞-ατ) |
| τ |
| tgα=kн |
| 1 |
| ln(α∞/α∞-ατ) |
| τ |
| tgα=kн |
| 2 |
| ln(α∞/α∞-ατ) |
| τ |
| tgα=kн |
| 3 |
1) 1
2) 2
3) 3
134. Характеристическая вязкость раствора
1) lim (hуд/С)с®¥=[h]
2) lim (hуд/С)с®0=[h]
3) lim (hот/С)с®0=[h]
135. Молекулярную массу вещества можно рассчитать, пользуясь формулой
1) [h]=КaМ
2) М=[h]Кa
3) [h]=КМa
136. Относительная вязкость – это отношение вязкости
1) раствора к вязкости растворителя
2) растворителя к вязкости раствора
3) раствора к сумме вязкостей раствора и растворителя
137. Удельная вязкость показывает, насколько увеличилась вязкость
1) раствора ВМС по сравнению с вязкостью растворителя
2) растворителя по сравнению с вязкостью раствора ВМС
3) раствора ВМС при охлаждении
138. Молекулярную массу полимера определяют на основании
1) t0, tх ® hотн ® hуд ® hпривед ® [h] ® (a, k) М
2) t0, tх ® [h] ® hуд ® hпривед ® hотн ® М
3) t0, tх ® [h] ® hуд ® hпривед ® hотн ® (a, k) М
4) t0, tх ® hотн ® hуд ® [h] ® (a, k) М
139. Степень набухания определяется по формуле
1) a=(m0/mж) ×100%
2) a=(mж/m0) ×100%
3) a=(mж/100%) × m0
140. Изменение скорости набухания во времени идет по механизму реакции ……. порядка
1) нулевого
2) первого
3) второго
141. Константа скорости набухания определяется по формуле
1) Кн=1/t × lg (a¥/a¥- at)
2) Кн=1/t × ln(a¥/a¥- at)
3) Кн= ln 1/t × (a¥/a¥- at)
4) Кн=1/t × a¥/a¥- lnat
142. Для исследования кинетики набухания полимера используют
1) вискозиметр
2) прибор Догадкина
3) прибор Ребиндера
4) прибор для определения межфазного натяжения
143. Единица измерения константы скорости набухания
1) м/с
2) мин-2
3) мин-1
144. Набухание является процессом
1) экзотермическим
2) эндотермическим
3) протекающим без изменения теплоты
145. Тиксотропия – способность структурированных систем ……………… после разрушения.
1) свертываться
2) восстанавливаться
3) кристаллизоваться
4) набухать
146. Студни могут образовываться в результате
1) неограниченного набухания и застудневания
2) ограниченного набухания и застудневания
3) только в результате застудневания
147. Скорость коагуляции – это изменение во времени ……….. концентрации дисперсной фазы
1) объемной
2) численной
3) массовой
148. зависимость степени набухания от времени при Ограниченном набухании
| α |
| τ |
| 2 |
| 1 |
| 3 |
1) 1
2) 2
3) 3
149.Солюбилизация сферическими мицеллами неполярных веществ в водном растворе пав
| 1 |
| 2 |
| 4 |
| 3 |
1) 1
2) 2
3) 3
4) 4
150. Сыпучие материалы – дисперсные системы типа …….., в которых имеется непосредственный контакт между частицами дисперсной фазы
1) Г/Т
2) Т/Г
3) Ж/Т
4) Т/Ж

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Дальневосточный федеральный университет»
(ДВФУ)
Дата: 2019-03-05, просмотров: 428.