Массовая доля (w) показывает отношение массы растворенного вещества к общей массе анализируемой пробы и выражается в долях единицы или в процентах, изменяясь от 0 до 1 или от 0% до 100% соответственно. Этот способ главным образом используют при описании состава обычно твердых объектов или иногда жидких (например, стандартная жирность молока равна 3.2%). В последнее время при использовании этой величины для описания содержания примесных компонентов используют меньшие величины ppm (частей на миллион) или ppb (частей на миллиард). Эти величины являются производными от % (частей на сто).
Единицы концентрации используют как при описании состава жидких и газообразных анализируемых объектов, так и для твердых объектов.
Молярная концентрация С(Х) показывает какое количество (моль) растворенного вещества Х содержится в 1 литре раствора и выражается в единицах моль/л или сокращенно – М.
Нормальная (эквивалентная) концентрация C ( f экв X ) или молярная концентрация эквивалентов показывает, сколько моль эквивалентов растворенного вещества Х находится в 1 литре раствора. Выражается в единицах {моль/л} (иногда моль экв/л) или сокращенно – н.
Эквивалентом называется реальная или условная частица вещества (формульная единица), которая может присоединять, отдавать или быть каким-либо другим образом быть эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Один моль эквивалентов вещества, как и моль любых частиц, содержит 6.02×1023 эквивалентов, а молярная масса эквивалента численно равна сумме атомных масс, входящих в него атомов.
Эквивалент одного и того же вещества может быть различным в зависимости от реакции, поэтому при использовании термина "эквивалент" необходимо указывать к какой конкретно реакции он относится.
Символ записи эквивалента вещества Х: fэкв Х, где fэкв – фактор эквивалентности.
Пример: 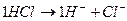
эквивалент HCl соответствует 1/1 молекулы HCl и записывается 1/1HCl, фактор эквивалентности fэкв = 1/1;
нормальная концентрация записывается С(1/1 HCl), моль/л,
молярная концентрация – С(HCl), моль/л.
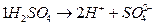
эквивалент H2SO4 соответствует 1/2 молекулы H2SO4 и записывается 1/2H2SO4, фактор эквивалентности fэкв = 1/2;
нормальная концентрация записывается С(1/2 H2SO4),
молярная концентрация – С(H2SO4), моль/л.
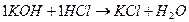
эквивалент КОН соответствует 1/1 молекулы КОН и записывается 1/1 КОН, фактор эквивалентности fэкв = 1/1;
нормальная концентрация записывается С(1/1 КОН), моль/л,
молярная концентрация – С(КОН) , моль/л.
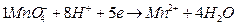
эквивалент KMnO4 соответствует 1/5 молекулы KMnO4 и записывается 1/5KMnO4, фактор эквивалентности fэкв = 1/5;
нормальная концентрация записывается С(1/5 KMnO4), , моль/л,
молярная концентрация – С(KMnO4) , моль/л.
Толкование термина "эквивалент" в отношении реакций комплексообразования неоднозначно и поэтому многие химики избегают применять этот термин к реакциям такого типа и пользуются молярными концентрациями. Однако в литературе могут встретиться случаи, когда для веществ, участвующих в реакциях комплексообразования указаны нормальные концентрации. В этом случае fэкв принимают равным 1/2.
Титр (ТХ) показывает массу вещества Х (г), растворенного в 1 мл раствора {г/мл}.
Дата: 2019-03-05, просмотров: 325.