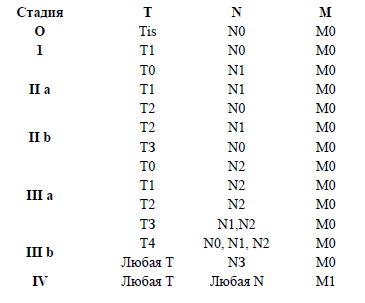
· Nx: недостаточно данных для оценки состояния регионарных лимфатических узлов (например, если они были удалены ранее).
· N0: регионарные лимфатические узлы не поражены метастазами.
· N1: метастазы в подвижные (смещаемые) лимфатические узлы (узел) подмышечной области на стороне поражения.
· N2: метастазы в фиксированные (несмещаемые) или слившиеся в конгломерат лимфатические узлы подмышечной области на стороне поражения, или клинически* выявляемое поражение внутригрудных лимфатических узлов (узла) при условии отсутствия клинических* признаков поражения подмышечных лимфатических узлов
· N2a: метастазы в подмышечные лимфатические узлы, фиксированные друг к другу или к другим структурам;
· N2b: метастазы в клинически выявляемые внутригрудные лимфатические узлы (узел) при условии отсутствия клинических* признаков поражения подмышечных лимфатических узлов;
· N3: метастазы в ипсилатеральные подключичные лимфатические узлы (узел) независимо от вовлечения подмышечных лимфатических узлов, или метастазы в клинически выявляемые внутригрудные лимфатические узлы (узел) при условии наличия клинических* признаков поражения подмышечных лимфатических узлов (узла), или метастазы в ипсилатеральные надключичные лимфатические узлы (узел) независимо от статуса подмышечных и внутригрудных лимфатических узлов;
· N3a: метастазы в ипсилатеральные подключичные лимфатические узлы (узел);
· N3b: метастазы в ипсилатеральные внутригрудные и подмышечные лимфатические узлы (узел);
· N3c: метастазы в ипсилатеральные надключичные лимфатические узлы (узел).
* Клинически выявляемое поражение — диагностируемое с помощью осмотра или инструментальных методов исследования (за исключением
лимфосцинтиграфии).
Патологическая (постхирургическая) классификация (pN)*
· pNx: недостаточно данных для оценки состояния регионарных лимфатических узлов (например, если они не были удалены для патогистологического исследования или были удалены ранее).
· pN0: регионарные лимфатические узлы не поражены метастазами при гистологическом исследовании и при отсутствии дополнительного исследования на наличие изолированных опухолевых клеток (ITC — isolated tumor cell(s)).
Замечание: ITC представляет собой единичную опухолевую клетку или кластер клеток размерами не более 0,2 мм, выявляемый только на основании иммуногистохимического исследования или молекулярных методов. ITC не обнаруживает признаков злокачественности, т.е. пролиферации или стромальной реакции.
· pN0(I-): отсутствие метастазов в регионарных лимфатических узлах при гистологическом и иммуногистохимическом исследовании;
· pN0(I+): отсутствие метастазов в регионарных лимфатических узлах при гистологическом исследовании, при иммуногистохимическом исследованииразмер кластера не превышает 0,2 мм;
· pN0(mol-): отсутствие метастазов в регионарных лимфатических узлах при гистологическом и молекулярном (ОТ-ПЦР)** исследовании;
· pN0(mol+): отсутствие метастазов в регионарных лимфатических узлах при гистологическом исследовании, положительный результат при молекулярном исследовании (ОТ-ПЦР).**
* Классификация основана на исследовании подмышечных лимфатических узлов и/или сентинельного (сторожевого) лимфатического узла. Классификация, основанная на исследовании сторожевого лимфатического узла (если на этапе хирургического лечения не выполнялась лимфодиссекция подмышечных лимфатических узлов), должна обозначаться аббревиатурой (sn), например, pN0(I+) (sn).
** ОТ-ПЦР — обратная транскриптазно-полимеразная цепная реакция.
· pN1: метастазы в 1—3 подмышечных лимфатических узлах и/или внутригрудных лимфатических узлах с микроскопическим поражением, выявленным при исследовании сторожевого лимфатического узла, но не определяемым клинически**
· pN1mi: микрометастазы (размерами более 0,2 мм, но не более 2,0 мм);
· pN1a: метастазы в 1Р3 подмышечных лимфатических узлах;
· pN1b: метастазы во внутригрудных лимфатических узлах с микроскопическим поражением, выявленным при исследовании сторожевого лимфатического узла, но не определяемым клинически;**
· pN1c: метастазы в 1—3 подмышечных лимфатических узлах и внутригрудных лимфатических узлах с микроскопическим поражением, выявленным при исследовании сторожевого лимфатического узла, но не определяемым клинически.** При метастатическом поражении более трех подмышечных лимфатических узлов поражение внутригрудных лимфатических узлов классифицируется как pN3b.
· pN2: метастазы в 4—9 подмышечных лимфатических узлах или клинически* выявляемое поражение внутригрудных лимфатических узлов при условии отсутствия метастазов в подмышечных лимфатических узлах
· pN2a: метастазы в 4—9 подмышечных лимфатических узлах (при размере как минимум одного кластера более 2,0 мм);
· pN2b: клинически* выявляемое поражение внутригрудных лимфатических узлов при условии отсутствия метастазов в подмышечных лимфатических узлах.
· pN3: метастазы в 10 и более подмышечных лимфатических узлах, или в подключичных лимфатических узлах, или в клинически* выявляемых ипсилатеральных внутригрудных лимфатических узлах (узле) при условии наличия одного или более пораженных метастазами подмышечных лимфатических узлов, или при наличии более трех пораженных метастазами подмышечных лимфатических узлов при условии микроскопического метастатического поражения (выявленного при исследовании сторожевого лимфатического узла) в клинически интактных внутригрудных лимфатических узлах, или в ипсилатеральных надключичных лимфатических узлах
· pN3a: метастазы в 10 и более подмышечных лимфатических узлах (при размере как минимум одного кластера более 2,0 мм) или метастазы в подключичных лимфатических узлах;
· pN3b: метастазы в клинически* выявляемых ипсилатеральных внутригрудных лимфатических узлах (узле) при условии наличия одного или более пораженных метастазами подмышечных лимфатических узлов; или при наличии более трех пораженных метастазами подмышечных лимфатических узлов при условии микроскопического метастатического поражения (выявленного при исследовании сторожевого лимфатического узла) в клинически интактных внутригрудных лимфатических узлах;
·  pN3c: метастазы в ипсилатеральных надключичных лимфатических узлах.
pN3c: метастазы в ипсилатеральных надключичных лимфатических узлах.
* Клинически выявляемое поражение — диагностируемое с помощью осмотра или инструментальных методов исследования (за исключением лимфосцинтиграфии).
** Клинически не выявляемое поражение означает не диагностируемое с помощью осмотра или инструментальных методов исследования (за исключением лимфосцинтиграфии).
Отдаленные метастазы (M)
· Mx: недостаточно данных для оценки отдаленных метастазов.
· M0: отдаленные метастазы отсутствуют.
· M1: отдаленные метастазы.
Лечение.
Хирургическое лечение. Операция — ведущий метод в лечении больных раком молочной железы. С развитием лучевой и химиотерапии, разработкой новых технологий диагностики опухоли на ранних стаднях удалось добиться улучшения отдалённых результатов лечения, и появились основания для пересмотра необходимого объёма операции при этом заболевании.
Мастэктомия
Мастэктомия остаётся методом выбора при лечении большого числа больных раком молочной железы из-за распространённости процесса или противопоказаний к органосохраняющим операциям.
Радикальную мастэктомию (операция Холстеда) в настоящее время выполняют только при прорастании опухоли в большую грудную мышцу. При этом используют различные виды разрезов кожи в зависимости от локализации и размеров опухоли, требований к закрытию раневого дефекта. Кожные лоскуты отсепаровывают кверху до ключицы, медиально до грудины, книзу до верхней трети прямой мышцы живота, латерально — до широчайшей мышцы спины. Удаляют единым блоком молочную железу, большую и малую грудные мышцы и жировую клетчатку подмышечно-подлопаточной области с лимфатическими узлами.
Модифицированная радикальная мастэктомия (операция Пейти) отличается сохранением большой грудной мышцы, но при этом удаляют малую грудную мышцу для облегчения доступа к лимфатическим узлам II —III уровней. Сохранение большой грудной мышцы снижает инвалидизацию больных, улучшает условия для последующего протезирования или реконструкции молочной железы.
Операция Маддена предусматривает сохранение как большой, так и малой грудной мышцы. При этом необходимо выполнение в полном объёме подключично-подмышечной лимфаденэктомии и удаление межмышечной клетчатки. Эту операцию в настоящее время считают оптимальным вариантом радикальной мастэктомии при узловых формах рака молочной железы, так как она носит щадящий характер и не увеличивает частоту местных рецидивов по сравнению с операциями Холстеда и Пейти.
Простая мастэктомия (абляция) показана при распространённом раке с распадом и кровотечением (санационная операция). Цель её — только улучшение качества жизни. В этом случае железу удаляют без фасции большой грудной мышцы. Подмышечную лимфодиссекцию не выполняют, так как это повышает риск осложнений.
Органосохраняющие резекции
Под туморэктомией (лампэктомией) понимают удаление только первичного очага без обширного иссечения неизменённых тканей с гистологическим подтверждением полного удаления опухоли (оценка краёв резекции). Остальные виды операций предполагают удаление не менее 2 см здоровой ткани по краям от опухоли.
Органосохраняющие операции обязательно дополняют лучевой терапией. Объём удаляемой ткани определяется размерами опухоли, её гистологической характеристикой и результатами интраоперационного исследования, подтверждающими отсутствие опухоли по краю резекции. В тех случаях, когда необходимо удалить более 1/3 части железы, большинство хирургов-онкологов считают целесообразным проводить мастэктомию и реконструкцию железы, особенно при локализации в верхневнутреннем квадранте, где нарушение формы наиболее заметно.
Как самостоятельный метод хирургического лечения лампэктомию применяют только у пожилых больных при карциномах in situ и небольших опухолях, выявленных при скрининговой маммографии.
Реконструктивные операции при раке молочной железы
Реконструкция молочной железы может быть проведена как одновременно с радикальной операцией на железе, так и в отсроченном варианте.
Общеизвестные методики одномоментной и отсроченной реконструкции после радикатьных мастэктомий заключаются в перемещении кожно-мышечного лоскута спины, передней брюшной стенки, ягодицы или имплантации протеза.
Возможность выполнения реконструктивных операций с хорошими результатами способствует быстрому восстановлению психосоматического статуса больных.
Радикальная секторальная резекция
Сам термин определяет, что удаляемый объём ткани соответствует сектору ткани молочной железы (как правило, несколько долей) с опухолью и магистральными протоками.
Подмышечная лимфодиссекция
При лимфодиссекции преследуют не только лечебные, но и диагностические цели — определение показаний к адъювантной химиотерапии и прогноза заболевания. Для исследования следует удалить и гистологически изучить не менее 10 лимфатических узлов.
Для уменьшения осложнений, связанных с лимфаденэктомией,
предложена методика выявления и удаления для анализа первого от опухоли лимфатического узла — ≪исследование сигнального лимфатического узла≫.
Клинические группы: первично операбельный рак молочной железы (0, I, IIA,IIB, IIIA стадии), местно-распространенный (первично не операбельный) рак молочной железы (IIIВ, IIIС стадии), метастатический рак молочной железы или рецидив болезни.
Алгоритм лечебно-диагностических мероприятий при различных стадиях рака молочной железы представлен на рис. 2.
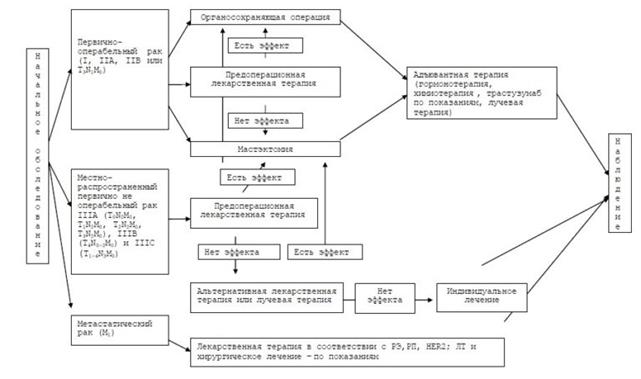 Рис.2. Алгоритм лечебно-диагностических мероприятий при различных стадиях рака молочной железы.
Рис.2. Алгоритм лечебно-диагностических мероприятий при различных стадиях рака молочной железы.
РАННИЙ (ПЕРВИЧНО ОПЕРАБЕЛЬНЫЙ) РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Общие принципы адъювантной лекарственной терапии
Адъювантная лекарственная терапия проводится в дополнение к локальным (хирургическому и лучевому) методам лечения и позволяет снизить риск рецидива болезни и смерти. При планировании адъювантной лекарственной терапии необходимо оценить прогноз, ожидаемую пользу адъювантного лечения, возможные побочные эффекты и сопутствующую патологию, а также учесть предпочтения больной. Возраст сам по себе не является ограничением для лекарственной терапии при отсутствии сопутствующей патологии.
При опухолях небольших размеров (< 0,5 см) в сочетании c N0, являющихся прогностически благоприятными, адъювантная лекарственная терапия обладает минимальной эффективностью. Назначение адъювантной гормонотерапии (при гормонозависимых опухолях) в такой ситуации имеет целью профилактику вторых (контралатеральных) гормонозависимых опухолей.
План адъювантной лекарственной терапии основывается на принадлежности опухоли к одному из молекулярно-биологических подтипов (табл. 3). Адъювантная лекарственная терапия должна начинаться с химиотерапии, если таковая показана.
Химиотерапия (таксаны) может проводиться одновременно с анти-HER2-терапией, если таковая показана. Гормонотерапия, если таковая показана, должна начинаться после завершения химиотерапии и проводиться одновременно с анти-HER2-терапией. Лучевая терапия, если таковая показана, должна начинаться после завершения химиотерапии и может проводиться одновременно с гормонотерапией и анти-HER2-терапией.
| Молекулярно-биологический подтип | Клинико-патологическое (суррогатное) определение подтипа |
| Люминальный А | Наличие всех факторов: • РЭ положительные • HER2 отрицательный • Ki67 низкий (< 20 %) • РП высокие (> 20 %) |
| Люминальный В ( HER2 отрицательный) | • РЭ положительные • HER2 отрицательный и наличие одного из следующих факторов: • Ki67 высокий (> 30 %) • РП низкие (< 20 %) |
| Люминальный В ( HER2 положительный) | • РЭ положительные • HER2 положительный • Ki67 любой • РП любые |
| HER2 положительный (не люминальный) | • HER2 положительный • РЭ и РП отрицательные |
| Базальноподобный | • отрицательные РЭ, РП, HER2 (тройной негативный протоковый) |
| Молекулярно-биологический подтип | Рекомендуемая адъювантная системная терапия | Примечания |
| Люминальный тип А | Только гормонотерапия в большинстве случаев | Назначение адъювантной химиотерапии (в дополнение к гормонотерапии) должно быть рассмотрено при наличии одного из следующих факторов: • большая степень распространения болезни: - ≥ 4 пораженных метастазами регионарных лимфатических узлов; - ≥ Т3; • III степень злокачественности. Если принято решение о назначении химиотерапии (в дополнение к гормонотерапии), то в большин- стве случаев можно ограничиться режимами АС или CMF (без таксанов) |
| Люминальный тип В (HER2 отрицательный) | Гормонотерапия + химиотерапия в большинстве случаев | При T1a (≤ 5 мм) и N0: только адъювантная гормонотерапия. Остальные больные: химиотерапия антрациклинами и таксанами в дополнение к гормонотерапии |
| Люминальный тип В (HER2 положительный) | Химиотерапия + анти-HER2 терапия + гормонотерапия | При T1a (≤ 5 мм) и N0: только адъювантная гормонотерапия; химиотерапия и трастузумаб не показаны. При T1b, с (> 5 мм, но ≤ 20 мм) и N0: возможна химиотерапия паклитакселом (без антрациклинов) в сочетании с трастузумабом (с последующей гормонотерапией). При Т2-Т4 (> 20 мм) или N+: антрациклины → таксаны + трастузумаб (с последующей гормонотерапией). При противопоказаниях к назначению антрациклинов может быть рекомендован режим DСН. |
| HER2 положительный (не люминальный) | Химиотерапия + анти-HER2 терапия | При T1a (≤ 5 мм) и N0: системная терапия не показана. При T1b (> 5 мм, но ≤ 10 мм) и N0: возможна химиотерапия паклитакселом (без антрациклинов) в сочетании с трастузумабом. При Т1с-Т4 (> 10 мм) или N+: антрациклины → таксаны + трастузумаб. При противопоказаниях к назначению антрациклинов может быть рекомендован режим DСН. |
| Тройной негативный (протоковый) | Химиотерапия с включением антрациклинов и таксанов | При T1a (≤ 5 мм) и N0: системная терапия не показана; Производные платины могут быть включены в режим адъювантной химиотерапии у больных с доказанными мутациями гена BRCА. |
РМЖ относится к опухолям, для которых характерна высокая частота гематогенного и лимфогенного метастазирования. Использование адъювантной химиотерапии позволяет значительно сократить риск рецидива и смерти у больных операбельным РМЖ. Цели лекарственной терапии: излечение, продление жизни, уменьшение стадии опухолевого процесса, улучшение качества жизни и контроль симптомов болезни, повышение результатов хирургического и лучевого лечения, отказ от калечащих операций, уменьшение объема вмешательств. Каждый химиопрепарат действует только на те клетки, которые находятся в определенной фазе клеточного цикла. Поэтому монохимиотерапия менее эффективна, чем полихимиотерапия (ПХТ) - сочетание нескольких препаратов с различными фазовоспецифичностью и механизмом действия. Клинический опыт показал, что при РМЖ наиболее эффективны в качестве дополнения к операции (адъювантная терапия) химиопрепараты циклофофосфамид, тиотепа, фторурацил, метотрексат, доксорубицин и некоторые другие, противоопухолевое действие которых потенцируется при их сочетании.
Альтернативой хирургической или лучевой кастрации у менструирующих и находящихся в пременопаузе женщин является использование гонадотропин-рилизинггормона (ГтРГ) и агониста ГтРГ гозерелин или его отечественного аналога - бусерелина. Комбинация агониста ГтРГ и тамоксифена (метаанализ четырех рандомизированных исследований) превосходит по эффективности монотерапию агонистом ГтРГ у женщин в пременопаузальном периоде, больных распространенным РМЖ.
Все шире применяются физиологически неактивные антиэстрогенные препараты (нестероидные антигормоны), непосредственно воздействующие на опухолевую клетку и не затрагивающие центральные механизмы гормонообразования. Большую роль играет тамоксифен у больных в менопаузе при гормональнозависимых опухолях с метастазами в подмышечные лимфатические узлы.
Современные достижения в гормонотерапии РМЖ связаны с появлением новых препаратов, в том числе «чистых» антиэстрогенов, селективных модуляторов эстрогеновых рецепторов, включая ралоксифен, а также новых ингибиторов ароматазы 3-го поколения, включающих нестероидные препараты анастрозол, летрозол, фулвестрант (фазлодекс) и стероидный ингибитор экземестан.
Для уточнения показаний к гормонотерапии, в частности овариэктомии, следует пользоваться определением гормональных рецепторов удаленной опухоли или ее кусочка, взятого при трепанобиопсии до начала лечения. После овариэктомии больным назначают тамоксифен (по 20 мг в день на срок 2 года) для блокады надпочечниковых эстрогенов.
Иммунотерапия
Показанием для иммунотерапии является нарушенная реактивность организма, обусловленная наличием самой опухоли и иммунодепрессивными методами химиолучевого и хирургического лечения. До начала и в процессе лечения необходимо определение иммунологического статуса, в частности показателей клеточного и гуморального иммунитета. По данным Н.И. Переводчиковой (2000), к иммуномодуляторам относятся: цитокины (интерлейкины, интерфероны, колониестимулирующие факторы), моноклональные антитела, дифференцирующие агенты, антиангиогенезные факторы.
Прогноз.
На основании данных о стадии опухолевого процесса и с учетом биологических характеристик опухоли необходимо оценить прогноз заболевания и выработать оптимальный план лечения конкретной пациентки. Различают большое количество прогностических факторов: размер опухоли, состояние регионарных лимфатических узлов, степень дифференцировки опухоли, рецепторы эстрогенов, HER2/neu-статус. Предсказывающие факторы освещают связь между биологией опухоли и эффективностью лечения, коррелируют с частотой объективного ответа независимо от прогноза, разделяют больных по чувствительности к различным видам лечения. Таких факторов немного: рецепторы эстрогенов и оценка гормональной терапии, HER2/neu-статус и оценка ответа на трастузумаб и т.д.
Наиболее важными прогностическими признаками являются: распространенность процесса, количество метастазов в подмышечных лимфатических узлах, отек молочной железы, наличие инвазивных свойств протоковой карциномы, степень злокачественности опухоли.
Отдаленные результаты лечения принято оценивать по 5-летней выживаемости. Выживаемость больных во многом зависит от стадии заболевания, при которой начато лечение. Современные методы лечения позволяют достичь 5-летней выживаемости при I стадии рака у 96 %, IIA - у 90 %, IIB - у 80 %, IIIA - у 87 %, IIIB - у 67 % больных.
Заключение.
Рак молочной железы является одной из наиболее актуальных проблем современной онкологии с многовековой историей изучения. Это обусловлено клинической и социальной значимостью заболевания. Интересно отметить, что именно панцирная форма рака молочной железы породила термин «cancer — рак». В течение последних десятилетий проводятся разнообразные многоцентровые исследования биологических и клинических особенностей рака молочной железы. На основании полученных сведений совершенствуются диагностические и лечебные методы. В то же время динамика эпидемиологических показателей позволяет прогнозировать значительный рост заболеваемости. По данным специалистов в течение XXI в. каждая 10-я женщина заболеет раком молочной железы. Это определяет высокий уровень ответственности врачей клинических специальностей при выявлении опухолевой патологии молочных желез и соответствующие требования к теоретической подготовке.
Список использованной литературы.
1. Онкология : учебник с компакт-диском / под ред. В.И. Чиссова, С.Л. Дарьяловой. - М. : ГЭОТАР-Медиа, 2007. - 560 с.
2. Онкология [Электронный ресурс]: учебник / Давыдов М.И., Ганцев Ш.Х. - М. : ГЭОТАР-Медиа, 2013.
3. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ИНВАЗИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. Коллектив авторов: Стенина М.Б., Жукова Л.Г., Королева И.А., Пароконная А.А., Семиглазова Т.Ю., Тюляндин С.А., Фролова М.А.
4. Клинические рекомендации по диагностике и лечению больных раком молочной железы. Утверждено на Заседании правления Ассоциации онкологов России. Москва, 2014 год.
5. Рак молочной железы: учеб.-метод. пособие для студентов старших курсов медицинских вузов, врачей-стажеров, клинических ординато- ров, практических врачей / С. А. Иванов, И. К. Кривенчук, В. А. Кри- венчук. — Гомель: учреждение образования «Гомельский государст- венный медицинский университет», 2012. — 36 с.
Дата: 2019-03-05, просмотров: 315.