Моносахариды. Химические свойства
Свойства моноз обусловлены наличием в составе молекулы карбонила и гидроксильных групп, для них характерны реакции как альдегидов и кетонов, так и спиртов.
Целесообразно рассмотреть химические свойства в названном порядке.
Реакции карбонильной группы
1) Окисление
Все моносахариды, как типичные альдегиды или кетоны, окисляются сравнительно легко под действием перекисей природного происхождения, кислорода воздуха и других органических окислителей, присутствующих в живой клетке.
В качестве инициаторов окисления (здесь необходимо употреблять именно этот термин, т.к. окисление идет по радикальному механизму!) могут выступать оксидоредуктазы (ферменты), ионы металлов, температура, световые кванты, другие соединения. В технике используют более жесткие окислители: кислоты, оксиды, гидроксиды тяжелых металлов и другие окислители.
Реакция идет по схеме:
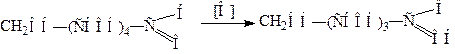
При более энергичном окислении в кислой среде одновременно с альдегидной группой окисляется и первичная спиртовая группа до карбоксильной группы:

В технике для этой цели используется азотная кислота. Для альдоз характерна и реакция альдегидов: "реакция серебренного зеркала" и восстановления меди (реактив Фелинга).
2) Восстановление
При восстановлении моносахариды переходят в многоатомные спирты. В природе за эту реакцию ответственны ферменты. В технике применяют амальгаму натрия или гидрид лития:
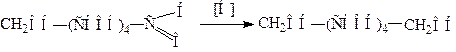
Реакция широко используется для производства пищевого сорбита – заменителя сахара для диабетиков.
3) Взаимодействие с аминами
Альдозы и кетозы вступают в реакцию с аммиаком и его производными (аминокислоты; полипептиды, белки, витамины, содержащие свободные аминогруппы; алифатические и ароматические амины биогенного происхождения и др.) образуя азометины, которые в дальнейшем легко циклизуются в гетеросистемы, и вторичные амины, по схеме:
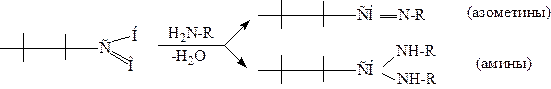 ,
,
где R – остатки аминокислот, пептидов, белков, аминов, витаминов и др.
Последующие многочисленные реакции, носящие окислительно-восстановительный характер и идущие параллельно, приводят к образованию темно-окрашенных продуктов – меланоидов. Строение красителя(лей) и механизм практически не изучены.
Образующиеся в ходе реакции промежуточные и побочные продукты (фурфурол, оксиметилфурфурол, уксусный альдегид, изовалериановый альдегид, диацетил и др.) принимают участие в формировании аромата и вкуса готовых продуктов.
Эта реакция играет большую роль в процессах, происходящих при переработке пищевого сырья.
Особенно интенсивно эти процессы идут при повышенной температуре: выпечка хлеба, сушка овощей, фруктов, получение сухого молока.
С реакцией меланоизации связано: потемнение сахарного сиропа при упаривании; образование цвета и аромата при "томлении" красного солода; образование вкусной, хрустящей, золотисто-коричневой корочки хлеба и его вкуса и аромата; цвет, вкус и аромат вин, шампанского, коньяка; потемнение фруктовых соков при хранении; внешний вид, вкус и запах готовых мясных изделий.
4) Превращение моноз в щелочной среде
4а) Эпимеризация моносахаридов
Изменение конфигурации у второго атома углерода альдоз называется эпимеризацией. Моносахариды крайне легко изменяются под действием щелочей. Так, уже на холоду разбавленные щелочи (например, водный раствор пищевой соды!) вызывают частичное превращение глюкозы во фруктозу и маннозу. Аналогично фруктоза превращается в глюкозу и маннозу, а манноза - в глюкозу и фруктозу, по уравнению:
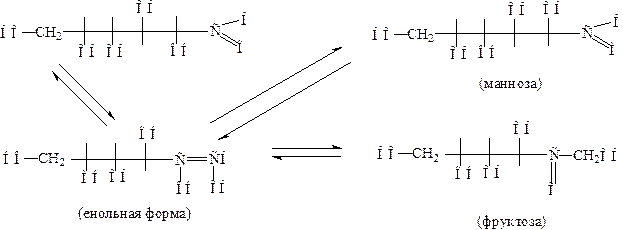
4б) Окислительное расщепление моносахаридов
При нагревании в разбавленных щелочах наблюдается побурение раствора, сопровождающееся окислением моносахаридов. При этом идет разрыв углеродной цепи с образованием большого числа разнообразных продуктов.
Главным продуктом расщепления глюкозы и фруктозы с разбавленными щелочами является молочная кислота. Образуются и другие продукты с трехуглеродной цепью, а также муравьиная кислота и другие вещества.
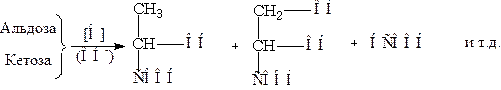
В организме высших животных непрерывно протекают процессы биохимического (ферментативного) расщепления и синтеза моносахаридов.
Аналогичные процессы идут и при хранении пищевого сырья (особенно растительного).
Реакции гидроксильных групп
Монозы принято рассматривать, как многоатомные спирты и для них характерны все свойства, присущие спиртам. К ним относятся, прежде всего, способность давать простые эфиры со спиртами (в том числе и с сахарами) и сложные эфиры с кислотами.
Все названные компоненты всегда присутствуют в пищевых продуктах и при благоприятных условиях вступают в реакцию.
1 Образование простых эфиров
В присутствии ионов водорода (источниками их являются кислоты) и высоких температур (выше 100°С) углеводы вступают в реакцию этерификации с другими спиртами, образуя “простые” эфиры (а). Наиболее реакционной группой циклических моноз является, как правило, “глюкозидная” гидроксильная группа и углеродного атома –  . Образовавшиеся соединения в этом случае называются глюкозидами (б).
. Образовавшиеся соединения в этом случае называются глюкозидами (б).
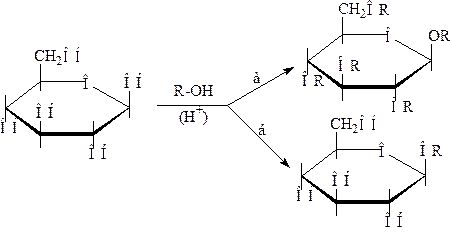 ,
,
где R - алкил; остатки моноз, диоз, полиоз; оксикислот и других спиртов.
2 Образование сложных эфиров
Сложные эфиры образуются в тех же условиях, что и простые эфиры.
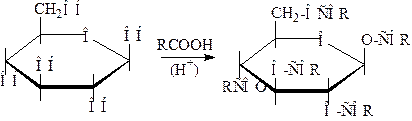 ,
,
где R – алкил, остатки аминокислот, полипептидов, остатки многих пищевых и минеральных кислот.
Образование простых и сложных эфиров идет и при обычных температурах с помощью ферментов.
Другие реакции моноз
1 Действие на моносахариды температуры
1а Циклизация пентоз
При нагревании пентоз в присутствии кислот, пентозы отщепляют три молекулы воды и циклизуются в фурфурол:
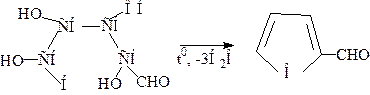
Фурфурол – один из компонентов, который входит в состав веществ, создающих аромат хлеба.
Б Карамелизация сахаров
Нагревание моно- и дисахароз до 100°С и выше приводит к существенному изменению их химического состава, соответственно повышается цветность продукта. В пищевой промышленности этот процесс называется “ карамелизацией” cахаров.
Глубина карамелизации зависит от состава cахаров, их концентрации, рН-среды, степени и продолжительности теплового воздействия, присутствия примесей. Особенно чувствительна к нагреванию фруктоза и карамелизация ее протекает в 6-7 раз быстрее, чем глюкозы.
Основной углеводный компонент кондитерских изделий – сахароза. При нагревании в ходе технологического процесса в слабокислой среде сахароза подвергается частичному гидролизу до глюкозы и фруктозы, последние претерпевают дальнейшие превращения. Например, глюкоза теряет (дегидратация) последовательно одну, две и три молекулы воды образуя внутренние ангидриды:

Ангидриды моноз могут конденсироваться с исходной сахарозой с образованием простых эфиров по типу крахмала, целлюлозы.
Фурфуролы могут полимеризоваться в цепочки по непредельным связям, по схеме:
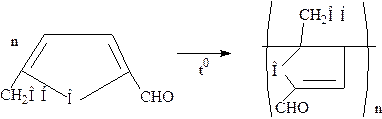
Сахароза при отщеплении двух молекул воды образует карамелен 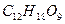 – желтое соединение, растворимое в воде; при отщеплении трех молекул воды она тримеризуется с образованием карамелена
– желтое соединение, растворимое в воде; при отщеплении трех молекул воды она тримеризуется с образованием карамелена  – ярко-коричневый цвет; при дальнейшей дегидратации и поликонденсации образуется карамелин не установленного строения - трудно растворим в воде.
– ярко-коричневый цвет; при дальнейшей дегидратации и поликонденсации образуется карамелин не установленного строения - трудно растворим в воде.
Дальнейшая дегидратация приводит к частичному разрушению углеродного скелета как монопродуктов, так и полимерных, с образованием муравьиной, левуленовой кислоты и других продуктов.
Карамелизация сахаров широко используется в кондитерской промышленности.
2 Укорочение углеродной цепи алъдоз
Реакция представляет собой еще один вариант окислительного расщепления моноз и имеет место в природе.
Окисление кальциевой соли альдоновой кислоты перекисью водорода в присутствии солей Fe 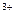 приводит к образованию непосредственно альдозы с более короткой (на один атом углерода) углеродной цепью. Реакция – многостадийная, идет через стадию декарбоксилирования с последующим окислением первичной спиртовой группировки до альдегидов, по суммарной схеме:
приводит к образованию непосредственно альдозы с более короткой (на один атом углерода) углеродной цепью. Реакция – многостадийная, идет через стадию декарбоксилирования с последующим окислением первичной спиртовой группировки до альдегидов, по суммарной схеме:
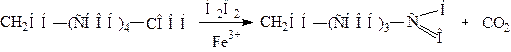
3 Брожение моносахаридов
Другим вариантом окислительно-восстановительного расщепления моноз является “брожение” – сложный ферментативный процесс со множеством промежуточных стадий, в ходе которого выделяются СО  , Н и другие. В зависимости от конечного продукта различаются несколько видов брожения:
, Н и другие. В зависимости от конечного продукта различаются несколько видов брожения:
а) Спиртовое брожение
б) Молочнокислое брожение
в) Маслянокислое брожение
г) Лимоннокислое брожение
д) Уксуснокислое брожение
и другие.
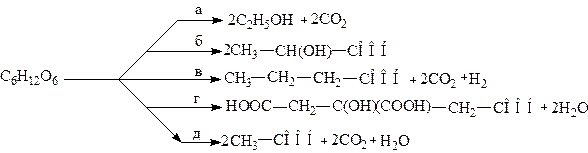
Процесс брожения занимает значительное место в пищевой промышленности для изготовления спирта, вин, пива, хлебобулочных и молочных изделий, консервантов, пищевых добавок.
В ходе ферментативной обработки пищи, наряду с основными продуктами, образуются побочные продукты, такие как глицерин, янтарная кислота, уксусная кислота, изопропиловые и изоамиловые спирты, их производные, которые существенно влияют на вкус и аромат пищевых продуктов.
Дисахариды
Дисахаридами называются такие углеводы, молекулы которых при гидролизе расщепляются на две молекулы моносахаридов.
Простейшими природными диозами являются свекловичный или тростниковый сахар – сахароза; солодовый сахар – мальтоза: молочный сахар – лактоза и целлобиоза. Все эти дисахариды имеют одну и ту же брутто-формулу 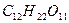 .
.
Состав дисахаридов определяется их гидролизом кислотами или ферментами. Сахароза гидролизуется на Д-глюкозу и Д-фруктозу:
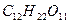 +
+ 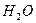 ®
® 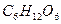 +
+ 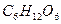
Мальтоза и целлобиоза гидролизуются на две молекулы Д-глюкозы:
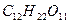 +
+ 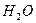 ®2
®2 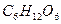
Дисахариды образуются из двух молекул моносахаридов за счет отщепления воды:
2 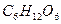 ®
® 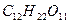 +
+ 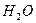
В живой клетке синтез контролируется специфическими ферментами.
Для осуществления связи между молекулами моноз обязательно принимает участие гликозидный гидроксил, а второй может быть и спиртовой гидроксил.
В зависимости от того, заняты гликозидные гнлроксилы связью или нет, они делятся на невосстанавливающие н восстанавливающие. Например, невосстанавливающий дисахарид сахароза:
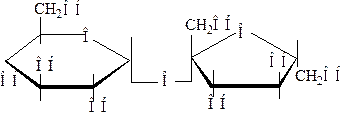
В сахарозе гликозидная гидроксилъная группа у атома С занята эфирной связью с фруктозой.
К восстанавливающим сахарам относятся, например, мальтоза и целлобиоза.
Все химические свойства, рассмотренные для моноз характерны и для диоз, но добавляется еще одна реакция - гидролиз.
Диозы гидролизуются кислотами или ферментами на монозы. Например, сахароза:
Сахароза + 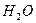 ®D-Глюкоза (a,b) + D-Фруктоза(a,b)
®D-Глюкоза (a,b) + D-Фруктоза(a,b)
Полисахариды
Полисахариды представляют собой продукты поликонденсации большого числа (от нескольких десятков до сотен тысяч) молекул моносахаридов.
Остатки моноз соединены между собой кислородными мостиками в длинные (неразветвленные или разветвленные) цепи. Их можно рассматривать как полигликозы или полиэфиры.
В образовании полисахаридов могут принимать участие, как пентозы, так и гексозы. В первом случае образуются пентозаны: арабаны из арабанозы, ксиланы из ксилозы и т.д. Во втором случае – гексозаны: крахмал, гликоген, клетчатка из глюкозы, инулин из фруктозы.
Наибольшее значение для пищевой промышленности имею крахмал и клетчатка. Их строение имеет следующий общий вид:
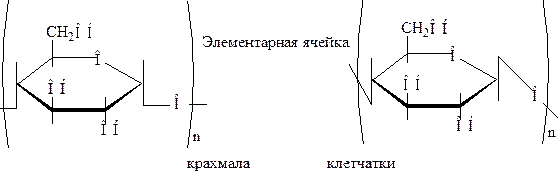
Крахмал
Является главным запасным питательным веществом растений. По составу он неоднороден и представляет собой смесь нескольких полисахаридов. Все они образуются из a-Д-глюкозы и отличаются строением цепи, числом входящих в их состав остатков и фосфорной кислоты.
Полисахариды крахмала делятся на две фракции: амилазу, содержание ее в крахмале от 15 до 25% и амилопектин - от 75 до 85%.
1 Амилоза ( 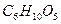 )
) 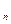
Полисахарид амилозы представляет собой неразветвленные или малоразветвленные цепочки, содержащие от 1000 до 6000 фрагментов глюкозы, связанных между собой эфирной связью по 1-4a атомам углерода, и фрагментов фосфорной кислоты (0,05%).
Амилоза имеет кристаллическое строение, растворима в воде, при стоянии вскоре выпадает в осадок, йод окрашивает ее в синий цвет.
2 Амилопектин ( 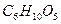 )
) 
Молекулы амилопектина сложнее, чем амилазы. Они представляют собой разветвленные цепи, содержащие от 5000 до 6000 остатков глюкозы и 0,4% фосфорной кислоты. Последняя связана с некоторыми спиртовыми гидроксилами сложноэфирной связью.
В составе амилопектина содержится до 0,6% высокомолекулярных жирных кислот.
Связь между остатками a-Д-глюкопиранозы 1-4a, 1-бa, 1-Зa.
С йодом образует фиолетовую окраску с красноватым оттенком.
Амилопектин в горячей воде не растворяется, но сильно набухает и дает клейстер (устойчивый гель).
Под действием ферментов или кислот крахмал гидролизуется. В общем виде схему превращения крахмала при гидролизе можно представить следующим образом:
( 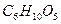 )
)  + n
+ n 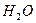 ® (
® ( 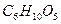 )
) 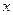 + n
+ n 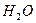 ®
® 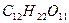 +
+ 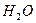 ®
® 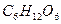 .
.
Гидролиз принят на вооружение промышленностью для получения многих пищевых продуктов: патока, глюкоза, хлебобулочные изделия, спирт, молочная кислота, лимонная кислота, аминокислоты.
3 Гликоген
Животный крахмал, состоит из остатков глюкозы, связанных между собой по 1-4a (до 90%), 1-6a (до 10%) и 1-Зa (до 1%). Он является энергетическим запасным материалом животных (в печени до 10%, мышцах 0,3-1% гликогена). Присутствует в некоторых растениях, например в зернах кукурузы.
По своему строению напоминает амилопектин, но более разветвлен. Хорошо растворяется в горячей воде, но при охлаждении не образует клейстер.
По своей химической сущности крахмалы представляют собой полиэфиры и полиспирты одновременно, и обладают всеми свойствами как эфиров (гидролиз, переэтерификация), так и спиртов (образование простых и сложных эфиров, реакции аминирования, окисления и др.).
Например, гидролиз крахмалов до a-Д-глюкозы по эфирным группировкам:
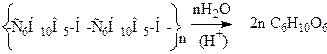
или реакции по спиртовым группам со спиртами и кислотами, с образованием простых и сложных эфиров, соответственно, окисление крахмалов до альдегидов и кислот, по схеме:
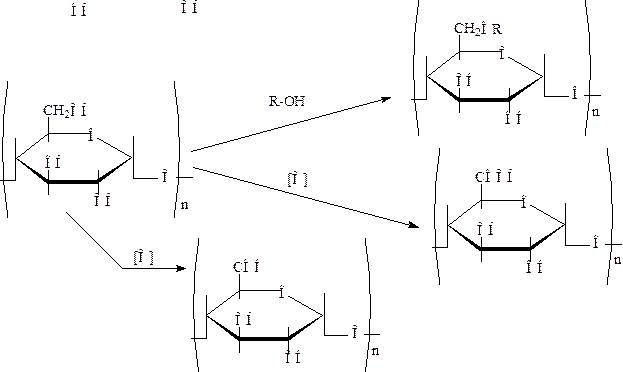
где R – остатки спиртов и кислот.
Естественно, при модификации крахмалов для пищевых целей этерификацию и окисление проводят частично (не полностью).
В последние годы в пищевой промышленности нашли применение модифицированные крахмалы типа “диальдегидные”, ”окисленные”, “ацетилированные”и другие.
1.4.2 Клетчатка ( 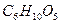 )
) 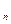
Клетчатка является главной составной частью оболочек растительных клеток. Содержание клетчатки в древесине 40-50%, зернах пшеницы – 3, ржи и кукурузе – 2,2, в подсолнечнике с плодовой оболочкой – до 15.
Молекула клетчатки имеет линейное строение и состоит из 2000-3000 остатков р-Д-глюкопиранозы, связь между ними 1-4b, т.е. соединены между собой 1-й и 4-й углеродные атомы моноз.
Клетчатка нерастворима в воде и при обычных условиях не гидролизуется кислотами. Гидролизуется только при повышенных температурах до Д-глюкозы, по схеме:
( 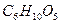 )
) 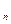 + n
+ n 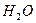 ®
® 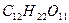 +
+ 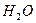 ®
®  .
.
Глюкозу из клетчатки широко используют для производства кормовых дрожжей, спирта, аминокислот, органических кислот и других продуктов (до 100 продуктов).
В желудочно-кишечном тракте человека нет фермента, расщепляющего клетчатку и ее относят к балластным веществам. Последние, вместе с пектинами, рекомендованы в качестве обязательных составляющих рациона человека. Они улучшают моторные функции желудочно-кишечного тракта и способствуют ликвидации застойных явлений в кишечнике.
Гемицеллюлозы
Высокомолекулярные полисахариды, участвующие совместно с целлюлозой в построении клеточных стенок растительных тканей. Содержатся в зерне, соломе, кукурузных початках, подсолнечной лузге. Содержание гемицеллюлоз зависит от сырья и достигает 40% (кукурузные початки), в пшенице и ржи –до 10%.
В их состав входят пентозаны (остатки арабинозы, ксилозы), гексозаны (остатки маннозы, галактозы, глюкозы, фруктозы) и группа смешанных полисахаридов (остатки пентоз, гексоз и урановых кислот).
Гемицеллюлозы имеют разветвленное строение, связи моноз осуществляются с участием полуацетального гидроксила и гидроксильных групп у 2,3,4,6 - ого углеродных атомов.
Кислотный гидролиз гемицеллюлоз обычно протекает легче, чем целлюлозы.
В гемицеллюлозы иногда включают группу агара (смесь сульфированных полисахаридов – агарозы и агаропектина) полисахарида, присутствующего в водорослях и применяемого в кондитерской промышленности.
Гемицеллюлозы широко применяют в разных отраслях промышленности, в том числе для получения пищевых продуктов: агар, агароза, ксилит.
Пектиновые вещества
Группа высокомолекулярных полисахаридов, входящих о состав клеточных стенок и межклеточных образований растений совместно с целлюлозой, гемицеллюлозой и лигнином. Содержатся в клеточном соке. Наибольшее количество пектиновых веществ содержится в плодах и корнеплодах. Получают их из яблочных выжимок, свеклы, корзинок полсолнечника.
Различают нерастворимые пектины (протопектины) и растворимые, содержащиеся в клеточном соке.
В основе полисахаридов пектинов лежит цепь из остатков a-Д-галактуроновой кислоты, связанных между собой связями 1-4a, причем часть карбоксильных групп этерифицирована метанолом, а гидроксильные группы могут служить точками присоединения боковых разветвленных цепей из остатков Д - галактозы, L - арабинозы, Д - ксилозы, L - рамнозы.
Пектины можно написать общей формулой:
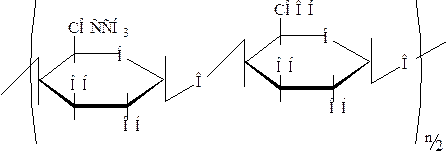
Часть кислотных групп находится в виде солей. Молекулярная масса пектинов от 20000 до 50000.
При созревании и хранении плодов нерастворимые формы пектина переходят в растворимые, с этим связано размягчение плодов при созревании и хранении. То же происходит и при теплой обработке растительного сырья, осветлении плодово-ягодных соков.
Пектиновые вещества способны образовывать гели в присутствии кислоты и сахара, и используются в качестве студнеобразующего вещества в кондитерской и консервной промышленности для производства мармелада, пастилы, желе и джемов, а также в хлебопечении, сыроделии.
Основное свойство пектинов - выводить из организма тяжелые металлы, токсичные вещества, сельскохозяйственные яды - в настоящее время оценено в недостаточной степени.
Порядок выполнения работы
В пробирку наливают 10 мл раствора крахмала и несколько капель концентрированной соляной кислоты. Перемешивают, кипятят на открытом огне. Через 1-2 мин после начала кипения берут пробу для реакции с йодом (несколько капель раствора пипеткой). Пробу выливают в пробирку, в которой налито 5-6 мл дистиллированной воды, а затем приливают 1-2 капли раствора Люголя.
Появившееся сине-фиолетовое окрашивание указывает на наличие в растворе амилодекстринов. Пробирку с раствором крахмала кипятят еще 1-2 минуты и снова проводят такую же пробу с йодом; появляется красно-бурое окрашивание от присутствия эритродекстринов. Пробирку с раствором снова кипятят и через 2-3 минуты повторяют опыт с йодом.
Крахмал через ахродекстрины, мальтодекстрины и мальтозу расщепляется до глюкозы. Реакция с йодом будет отрицательная – жидкость окрашивается в желтый цвет за счет окраски раствора Люгаля.
Гидролизат крахмала нейтрализуют по лакмусовой бумаге раствором гидроксида натрия, прибавляют реактив Фелинга и нагревают. Выпавший желтый осадок гидроксида меди (I) или красный оксида меди (I), укажет на присутствие в растворе продуктов гидролиза, обладающих восстановительными свойствами.
Сделайте выводы. Напишите уравнения реакций.
Опыт 2. Гидролиз крахмала в уксусной кислоте
Реактивы: 1) Крахмал 1 % раствор
2) Реактив Фелинга
3) Уксусная кислота, 6 % раствор
4) Универсальный индикатор
5) Лакмусовая бумага
6) Гидроксид натрия 10 % раствор
Оборудование: 1) Пробирки
2) Пипетка
Порядок выполнения работы
В пробирку наливают 10 мл раствора крахмала и добавляют 2 мл 6 % уксусной кислоты. Замеряют рН раствора универсальным индикатором.
Опыт проводят так же, как и опыт 1. Пробы на йод берут через 5-6 минут, т.к. гидролиз идет медленнее (слабая кислота).
Запишите наблюдения в лабораторный журнал. Сделайте выводы. Напишите уравнения реакции гидролиза и «цветной» реакции на глюкозу с реактивом Фелинга.
Опыт 3. Гидролиз крахмала пищевой содой
Реактивы: 1)Крахмал 1 % раствор
2)Реактив Фелинга
3)Гидрокарбонат натрия, кристаллический
4)Универсальный индикатор
5)Соляная кислота 0,1 н раствор
6)Гидроксид натрия 10 % раствор
Оборудование: 1)Пробирки
2)Пипетка
Порядок выполнения работы
В пробирку наливают 10 мл раствора крахмала и добавляют 0,2 г кристаллической пищевой соды. Соду растворяют встряхиванием, измеряют рН раствора. Далее гидролиз ведут как в опыте 1. Перед добавлением раствора йода пробу нейтрализуют несколькими каплями 0,1 н соляной кислоты.
Наблюдения занесите в журнал. Сделайте выводы. Напишите уравнения реакций.
1.6 КОНТРОЛЬНЫЕ ВОПРОСЫ:
1 При помощи каких реакций можно отличить альдозы от кетоз?
2 Что такое мутаротация? Каковы причины ее возникновения? Ответ иллюстрировать конкретными примерами.
3 Показать важнейшие способы получения производных аль-моноз (альдегидных форм).
4 На конкретных примерах показать способы, используемые для взаимопревращений альдоз в кетозы и обратно.
5 Написать общие формулы теоретически возможных дисахаридов, состоящих из остатков a-глюкозы.
6 Объяснить сущность инверсии сахарозы.
7 Написать схемы процессов окисления глюкозы: а) Аммиачным раствором оксида серебра, б) Реактивом Фелинга.
8 Написать структурные формулы целлобиозы по ее названию: 1–b–глюкозидо–4–b–глюкоза
9 Что такое эпимеризация моноз?
10 Превращения моноз в щелочной среде.
11 Вероятные реакции моноз с аминокислотами и белками при температуре больше 100°С.
12 Вероятные реакции моноз с пищевыми кислотами при температуре больше 100°С.
13 В чем заключается основное отличие животного крахмала от растительного?
14 Строение крахмала применение.
15 Вероятные реакции крахмала в кислой среде при температуре больше 100°С.
16 Строение клетчатки. Ее функции в пищеварении.
17 Что такое гемицеллюлоза, ее строение.
18 Пектиновые вещества. Строение. Их роль. Применение.
ВИТАМИНЫ
Общие сведения о витаминах
Витамины – низкомолекулярные органические вещества различной химической природы, объединяемых по признаку их строгой необходимости для питания животного и человеческого организма.
По сравнению с основными питательными веществами – белками, жирами и углеводами – витамины требуются в ничтожно малых количествах.
Слово “витамины” происходит от двух латинских слов: «vita», что означает «жизнь» и химического названия «amine», т.е. азотистые соединения. Основоположником учения о витаминах является русский ученый – врач Н.И. Лунин.
Основными поставщиками витаминов для человека является растительная и животная пища.
Установлено, что витамины входят в состав более 100 ферментов, тех могучих катализаторов химических превращений в организме. И, естественно ОТСУТСТВИЕ или НЕДОСТАТОК В ПИЩЕ ВИТАМИНОВ приводит к глубоким нарушениям обмена веществ и, в конечном счете, к заболеваниям, получившим название авитаминозы и гиповитаминозы.
Сейчас известно свыше тридцати соединений, относящихся к витаминам. Различают собственно витамины и витаминоподобные соединения.
К витаминоподобным относятся:
– биофлавоноиды (витамин Р),
– пангамовая кислота (витамин B 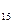 ),
),
– парааминобензойная кислота (витамин H 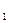 ),
),
– оротовая кислота (витамин B 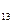 ),
),
– холин (витамин B 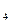 ),
),
– инозит (витамин B 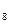 ),
),
– метилметионинсульфоний хлорид (витамин U),
– липоевая кислота, карнитин (витамин B 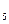 ).
).
Некоторые пищевые продукты содержат провитамины, т.е. соединения, способные в организме превращаться в витамины. Например, b-каротин (красящее вещество моркови) переходит в витамин А, эргостеролы (содержатся в дрожжах, в плесневых грибах, в пшеничном зерне) под действием ультрафиолетовых лучей превращаются в витамин Д в организме человека.
В процессе исследования химической природы и биологического действия витаминов был обнаружен ряд веществ, инактивирующих витамины и оказывающих на организм действие, противоположное действию витаминов. Такие вещества получили название антивитаминов. По своему строению они конкурируют с витаминами и могут занять их место в ферментных системах, но не в состоянии выполнять их функции. Например, стрептоцид – структурный аналог парааминобензойной кислоты; пантоилтаурин – аналог пантотеновой кислоты; пиритиамин – аналог тиамина, глюкоаскорбиновая кислота – аналог витамина С.
Так как химическая природа витаминов была открыта после установления их биологической роли, то их условное обозначение буквами латинского алфавита (А, В, С, Д и т.д.) сохранилось и до настоящего времени.
Рассмотрим строение и свойства наиболее важных витаминов.
Водорастворимые витамины
1 Витамин В 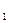 (тиамин)
(тиамин)
Признаками гиповитаминоза В 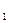 являются: полиневрит, нарушение сердечной деятельности, пищеварения и водного обмена.
являются: полиневрит, нарушение сердечной деятельности, пищеварения и водного обмена.
Витамин В 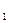 в виде пирофосфорного эфира (тиаминопирофосфата) входит в состав ферментов декарбоксилаз кетокислот, катализирующих процесс декарбоксилирования пировиноградной и a-кетоглутаровой кислот. И играет важную роль в процессах превращения углеводов в организме животных, растений и микроорганизмов.
в виде пирофосфорного эфира (тиаминопирофосфата) входит в состав ферментов декарбоксилаз кетокислот, катализирующих процесс декарбоксилирования пировиноградной и a-кетоглутаровой кислот. И играет важную роль в процессах превращения углеводов в организме животных, растений и микроорганизмов.
Витамин синтезируется зелеными растениями и микроорганизмами.
Богатым источником витаминов В 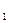 являются пшеничные и рисовые отруби, зародыши злаков, внутренние органы животных (печень, почки и сердце). Особенно богаты этим витамином дрожжи. Витамин В
являются пшеничные и рисовые отруби, зародыши злаков, внутренние органы животных (печень, почки и сердце). Особенно богаты этим витамином дрожжи. Витамин В 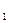 имеет следующее строение:
имеет следующее строение:
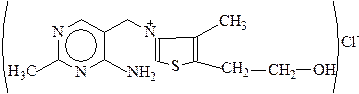
Витамин устойчив к действию света, в кислой среде стоек к нагреванию и кипячению, но очень легко разрушаются при нагревании в нейтральной и особенно щелочной среде.
Вследствие этого витамин В 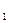 мало разрушается при обработке пищевых продуктов теплом (варка, выпечка хлеба), но чрезвычайно быстро разрушается при выпечке кондитерских мучных изделий, изготовляемых на щелочных разрыхлителях (сода, карбонат аммония).
мало разрушается при обработке пищевых продуктов теплом (варка, выпечка хлеба), но чрезвычайно быстро разрушается при выпечке кондитерских мучных изделий, изготовляемых на щелочных разрыхлителях (сода, карбонат аммония).
Причина химической неустойчивости витамина в щелочах – разрушение соли, за которым следует развал витамина, по связи (С-S) с образованием тиамин-тиола, строения:

2 Витамин В 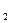 (рибофлавин)
(рибофлавин)
При недостатке витамина В2 возникают заболевания кожи, воспаление слизистой оболочки ротовой полости, появления трещин в уголках рта, развиваются заболевания кроветворной системы и желудочно-кишечного тракта.
Рибофлавин принимает участие в окислительно-восстановительных реакциях обмена веществ
Источники витамина В 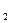 : молочные продукты, яйца, хлеб, печень животных, бобовые культуры. Некоторое количество рибофлавина поступает в организм в результате деятельности кишечной микрофлоры.
: молочные продукты, яйца, хлеб, печень животных, бобовые культуры. Некоторое количество рибофлавина поступает в организм в результате деятельности кишечной микрофлоры.
Витамин В 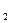 состоит из изоаллосазинового цикла и радикала Д-рибита и имеет следующее строение:
состоит из изоаллосазинового цикла и радикала Д-рибита и имеет следующее строение:
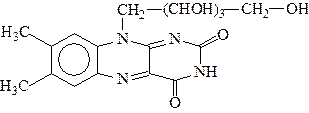
Он устойчив к повышенным температурам, но разрушается на свету и в щелочной среде. Последнее обусловлено щелочным гидролизом по циклическому амиду с разрывом связи (-CO-NH-) между С 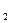 - атомом и N
- атомом и N 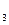 - атомом.
- атомом.
Исходя из энергий делокализации электронной плотности в птеридиновой системе рибофлавина, нуклеофильная атака ионом (ОН-) при гидролизе идет по С2 - атому (Еделок С2=165 КДж/моль) и при радикальной (О.) реакции - также по С2-атому (Еделок С2=187,5 КДж/моль).
3 Витамин В3 (пантотеновая кислота)
Отсутствие витамина B3 в организме вызывает вялость,онемение пальцев ног.
Он входит в состав ферментов биологического ацилирования, участвует в окислении и биосинтезе жирных кислот, липидов, в превращениях сахаров.
Основные источники: печень, почки, яйца, злаки (гречиха, рис, овес). Синтезируется в зеленых листьях, микроорганизмами, в том числе кишечной микрофлорой животных.
По химической структуре витамин В3 - амид между b-аминопропионовой кислотой и диметильным производным диоксимасляной кислоты, строения:
СН2–(ОН)-С(СН3)2-СН(ОН)2-СО-NH-СН2-СН2-СООН
Кулинарная обработка не приводит к существенному разрушению витамина. Гидролиз амидной связи (NH-CO) идет, но незначительно, как и в белке.
4 Витамин РР (ниацин, витамин В5)
При недостатке витамина РР в пище наблюдается вялость, быстрая утомляемость, бессонница, сердцебиение, пониженная сопротивляемость к инфекционным заболеваниям. При значительном недостатке развивается пеллагра.
Ниацин является коферментом большой группы ферментов (дегидрогеназы), участвующих в окислительно-восстановительных реакциях. Коферменты играют важную роль в тканевом дыхании.
Источники витамина РР - мясные продукты, особенно печень, почки, рыба. В других продуктах содержание витамина невелико.
Под витамином РР понимается группа соединений пиридина. Важнейшие из них - пиридин-3-карбоновая кислота (никотиновая) и амид никотиновой кислоты, строения:

Витамин РР хорошо сохраняется в продуктах питания, не разрушается под действием света, кислорода, в щелочных растворах.
Кулинарная обработка не приводит к значительным потерям ниацина. С химической точки зрения устойчивость объясняется прочностью ароматического кольца, а в случае гидролиза амида -имеет место в кислой среде – образуется витамин – никотиновая кислота.
Витамины РР восстанавливаются солями сернистой кислоты (цветорегулирующие материалы, применяемые в пищевой промышленности) до дигидропиридинпроизводных, утрачивая свои витаминные свойства.
5 Витамин В6 (пиридоксин)
Отсутствие или недостаток витамина В6 в пище приводит к нарушению белкового обмена и синтеза жиров в организме. Развивается сухой себорейный дерматит, стоматит, глоссит, анемия, возникают судороги.
Роль его в обмене веществ заключается в том, что его производное в виде фосфорнокислого эфира входит в состав ферментов, катализирующих превращения аминокислот, в частности, их декарбоксилирования, а также реакции переаминирования. При авитаминозе В6 отмечаются также глубокие нарушения в синтезе и обмене триптофана.
Наибольшим содержанием витамина В6 отличаются дрожжи, рисовые отруби, пшеничные зародыши. Другие его источники: мясные, рыбные продукты, бобовые культуры (соя, фасоль) крупы, картофель.
Под витамином В6 подразумевается группа производных 2 - метилпиридина. Важнейший из них - пиридоксин, строения:
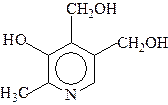
Витамин устойчив к щелочам, кислотам, повышенной температуре, но инактивируется на свету. Последнее, возможно связано с образованием перекисей по оксиметиленовым группировкам в положениях 4,5.
6 Витамин В9 (фолиевая кислота, фолацин)
При недостатке фолиевой кислоты в пище наблюдается нарушение кроветворения, пищевой системы, снижение сопротивляемости организма к заболеваниям.
Витамин В9 участвует в процессах кроветворения, синтезе аминокислот, нуклеиновых кислот, холина, пуриновых и пиримидиновых оснований.
Основные источники витамина - листовые овощи (петрушка, салат, фасоль, шпинат), печень и почки животных, творог, хлеб, дрожжи.
Интересно, что из всех плодов и овощей наиболее богата фолиевой кислотой земляника и этим объясняется ее благоприятное действие при малокровии.
По химической структуре фолиевая кислота состоит из (остатков глютаминовой кислоты, парааминобензойной кислоты и пуринового основания, строения:
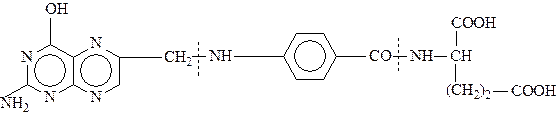
Фолиевая кислота легко разрушается при термообработке и действии света. При пастеризации молока разрушение витамина В9 составляет 75%, при переработке овощей - 90%. В мясопродуктах и яйцах потери незначительны.
С химической точки зрения за разрушение витамина в водных растворах ответственна реакция гидролиза по амидной связи (-СО-NH-); на свету (hn) идет, вероятно, разрыв связи (-CH2-NH-).
Незначительные разрушения витамина В9 в мясопродуктах объясняются, вероятно, ограниченным доступом реагентов гидролиза (Н20 и Н+) к внутренним волокнам мясопродуктов и разрушение идет лишь в поверхностных слоях.
7 Витамин В12 (цианкобаламин)
При недостатке витамина В12 появляется слабость, падает аппетит, развивается злокачественное малокровие, нарушается действие нервной системы.
Витамин B12 участвует в процессах кроветворения, превращениях аминокислот, биосинтезе нуклеиновых кислот.
Витамин В12 содержится в продуктах животного происхождения: печени, почках, говядине, рыбе, молочных продуктах. Разрушается витамин при длительном воздействии световых лучей.
По химическому составу является сложным комплексным соединением, где в качестве координирующего иона выступает ион Со, координирующий шесть разновидных лигандов. Схематически его можно представить следующей схемой:
[Со3+(CN-)R1- R2- R30 R40 R50],
где лиганды Rх = замещенный порфин, -бензимидазольное производное, соединенное с фосфорным эфиром рибозы.
8 Витамин С (аскорбиновая кислота)
Недостаточное содержание этого витамина в пище приводит к нарушению обмена в соединительных тканях, повышенную проницаемость капилляров, что ведет к кровоизлияниям и цинге.
Биологические функции витамина связаны с участием в биосинтезе стероидов, в реакциях гидроксилирования, в частности, в превращении пролина в оксипролин.
Он участвует в окислительно-восстановительных процессах, положительно действует на центральную нервную систему, повышает сопротивляемость человека к экстремальным воздействиям.
Витамин С необходим для нормальной жизнедеятельности человека. Организм человека не способен синтезировать аскорбиновую кислоту и должен получать ее в готовом виде с пищей.
Витамин С содержится во многих растениях, особенно им богаты свежие овощи и фрукты. Он крайне нестоек, легко разрушается на свету, кислородом воздуха, в присутствии следов железа и меди, более устойчив в кислой среде, чем в щелочной.
При хранении его содержание в продуктах резко снижается. При тепловой обработке пищи разрушается от 25 до 60% витамина С. Неустойчивость витамина С объясняется его “хрупкой” химической структурой. Он является производным L(+) гулоновой кислоты, в частности, g-лактамом, 2,3-дегидрогулоновой кислоты, строения:
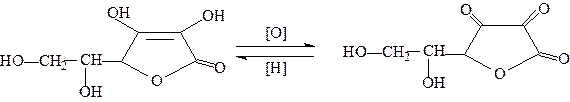
При окислении переходит в дегидроаскорбиновую кислоту, при восстановлении - в исходный витамин.
Витамин С содержит три функциональные группировки: спиртовые(-ОН), карбоксильную(-СООН), занятую внутриэфирной связью и этиленовую группу(>С=С<), и для него характерны все химические свойства спиртов, сложных эфиров, карбоновых кислот и этиленовых соединений: образование простых и сложных эфиров по спиртовым группировкам; гидролиз циклического эфира, с раскрытием кольца, и дальнейшими реакциями карбоксильной группы гулоновой кислоты со спиртами или ионами металлов; присоединение по непредельной связи атомов кислорода (окисление) или водородов (восстановление) и т.д.
При хранении и термических обработках, разрушение витамина связано с любой из перечисленных реакций.
9 Витамин Н (биотин)
Недостаток биотина в диете приводит к поражениям кожи, выпадению волос, поражению ногтей. Возникают пигментация, дерматит, нервные расстройства, шелушистая кожа.
Витамин Н входит в состав ферментов, катализирующих обратимые реакции переноса (карбоксилирование, декарбоксилирование), участвуя в обмене липидов, аминокислот, углеводов, нуклеиновых кислот.
Потребность организма человека в биотине удовлетворяется за счет продуктов питания и биосинтеза его микрофлорой кишечника.
Биотин содержится в большинстве продуктов питания. Основные источники: печень, мясо, почки, яйца, молоко. Из растительных продуктов – пшеница, овес, соя, горох.
По химической структуре биотин - бигетероциклическое соединение с конденсированными циклами тиофана и мочевины. Достаточно прочное соединение и в процессе кулинарной обработки практически не разрушается, строения:
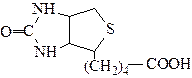
10 Витамины Р (биофлавоноиды)
При недостатке витаминов Р нарушается проницаемость капилляров, развивается геморрагия.
Это название объединяет целый ряд биологически активных флавоноидов, укрепляющих стенки сосудов. Важнейшие из них: катехин и эпикатехин; кверцетии и его глюкозид – рутин, гесперетин и его 7-рамноглюкозид – гесперидин.
Большинство биофлавоноидов желтые кристаллические вещества. Содержатся в растениях: особенно богаты им листья чая, плоды цитрусовых, шиповника, черноплодной рябины.
Многие биофлавоноиды – пигменты, придающие окраску цветам и плодам растений. В животных тканях не обнаружены.
Применяются как капилляроукрепляющие средства, красители, пищевые антиоксиданты и дубильные вещества.
Чрезвычайно высокой Р-витаминной активностью обладают концентраты, получаемые из черной смородины.
Флавоноиды относительно устойчивы к технологическим переработкам пищевых продуктов.
Строение флавоноидов можно представить следующими общими формулами:
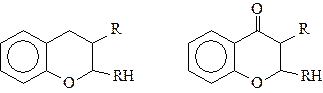 ,
,
где R = Н, ОН,RН - замещенные фенолы.
Например:
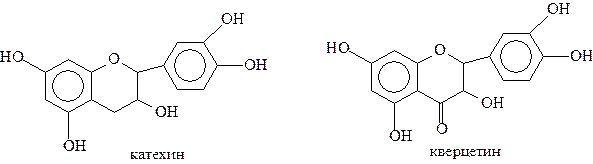
2.3 Практическая часть: Исследование устойчивости витамина В2 и определение содержания витамина С
2.3.1 Лабораторная работа №8 "Исследование устойчивости витамина В2 в щелочной среде"
Сущность метода. В основу метода анализа положена цветность самого витамина В2.
Рибофлавин, как представитель класса птеридинов, является типичным пигментом желтого цвета.
В частности, именно ему обязана окраска яичного желтка.
По падению плотности красителя (Д) можно количественно оценить степень разрушения рибофлавина.
Реактивы: 1. Витамин В2, 0,005%-ный раствор
2. Гидрокарбонат натрия, 2%-ный раствор
Оборудование: 1. Колба круглодонная с обратным холодильником, 0,2 л
2. Водяная баня
3. Плоскодонные колбы, 0,1л
4. ФЭК
Порядок выполнения работы
В колбу с 50 мл раствора витамина В2 приливают 20 мл раствора пищевой соды, перемешивают, отбирают пробу (п. 1) закрывают холодильником и ставят в баню с кипящей водой на 1 час.
Последующие пробы отбирают через 10-15 минут. Для оценки степени разрушения витамина В2 замеряют плотность раствора красителя (Д) в каждой пробе.
Постройте график в координатах: плотность (Д) – время (t). Приняв плотность раствора красителя за 100% оцените в процентах степень деструкции рибофлавина. Напишите уравнение реакции деструкции витамина В2.
2.3.2 Лабораторная работа №9 "Определение содержания аскорбиновой кислоты в некоторых продуктах питания"
Реактивы: 1) NаОН 0,01 н раствор
2) Тиосульфат натрия 0,01 М раствор
3) Йод 0,01 М раствор
4) Крахмал 1 % раствор
Оборудование: 1) Колбы конические
2) Пипетка на 10 мл
3) Бюретки 50 мл
Порядок выполнения работы
В коническую колбу вносят 1 мл пробы продукта и 9 мл воды. Для определения общей кислотности подготовленную пробу титруют 0.01 н раствором NaOH (индикатор – фенолфталеин).
Для определения содержания аскорбиновой кислоты в коническую колбу вносят 1 мл пробы продукта и 9 мл воды, прибавляют 1 мл раствора крахмала и титруют 0,01 М раствором йода до слабо синего окрашивания жидкости.
1 мл 0,01 М раствора йода соответствует 0,00088 г аскорбиновой кислоты
Примечание: В колбу с притертой пробкой вносят 1 мл пробы и 9 мл воды, добавляют 10 мл 0,01 М раствора йода, перемешивают и ставят в темное место на 10 мин. Затем пробу титруют 0,01 М раствором тиосульфата натрия до появления светло-желтою окрашивания, добавляют 1 мл крахмала и титруют до исчезновения синего окрашивания.
2.4 КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Классификация витаминов.
2. Строение, химические и физические свойства, биохимические функции и источники и потребность в витаминах: А, Д, Е, К, В1, В2, РР, В5, В6, В9, В12, С.
3. Связь витаминов с ферментами.
4. Что такое витаминоподобные вещества? Приведите примеры.
5. Что такое провитамины? Приведите примеры.
6. Что такое антивитамины? Приведите примеры.
7. Какие витамины будут инактивироваться (уничтожаться) при гидрогенизации растительных масел с целью получения «саломасс»? Исходя из строения предложенного витамина, объяснить его устойчивость или неустойчивость при хранении и кулинарной обработке пищевых продуктов:
8. Витамин А (ретинол).
9. Витамин Д (кальциферолы).
10. Витамин Е (токоферолы).
11. Витамин К (филлохиноны).
12. Витамин С (аскорбиновая кислота).
13. Витамин В1 (тиамин).
14. Витамин В2 (рибофлавин).
15. Витамин B3 (пантотеновая кислота).
16. Витамин В5 (витамин РР).
17. Витамин В6 (пиридоксин).
18. Витамин В9 (фолиевая кислота).
19. Витамин В12 (цианкобаламин).
20. Витамин Н (биотин).
21. Витамин Р (рибофлавоноиды)
ПИЩЕВЫЕ ДОБАВКИ
Питательные добавки
У этих добавок блестящая история, так как с их помощью в развитых странах удалось практически ликвидировать болезни, вызываемые недостатком в рационе того или иного элемента или вещества, а именно: зоб (недостающий фактор – иод), цингу (витамин C), пеллагру (ниацин), рахит (витамин D, кальций, фосфор) и другие подобные заболевания. В пищевые продукты для повышения их питательной ценности добавляют почти все микроэлементы и макрокомпоненты пищи (жиры, углеводы, белки и клетчатку). Чтобы повысить питательную ценность пищи, очень важно добавлять в нее те вещества, которые в обычном рационе присутствуют в количествах ниже оптимальных.
Консерванты
Это антимикробные агенты, предназначенные для того, чтобы долгое время сохранять продукты годными к употреблению. С самых давних пор люди использовали для этой цели соль, сахар, кислоты и дым, в котором продукты коптили. В качестве консервантов для фруктов и овощей используют бензоат натрия и бензоат калия. В хлебопечении и производстве молочных продуктов применяются пропионаты, подавляющие развитие плесневых грибов. Многие продукты консервируют с помощью уксусной кислоты (уксуса). Нитриты и нитраты тоже служат консервантами. Сухие фрукты и овощи обрабатывают сернистым газом (диоксидом серы) и сульфитами. Для стерилизации зерновых продуктов и пряностей с целью уничтожения насекомых-вредителей и микроорганизмов применяется ряд газов.
По мере роста населения консерванты приобретают все большее значение, поскольку обеспечить 10%-й прирост запасов пищевых продуктов с их помощью гораздо легче, нежели путем расширения сельскохозяйственного производства.
Пряности
Во времена, когда не было постоянных торговых путей, обеспечивающих ввоз пряностей, пища европейцев была крайне однообразной и неудовлетворительной не только в количественном, но и в качественном отношении. В наше время в ходу свыше 2000 различных пряностей для любого мыслимого употребления. Природные пряности имеют очень сложный состав; в кофе, например, содержится свыше 1000 различных соединений (впрочем, обычно пряности далеко не столь сложны). Большинство пряностей, которыми мы пользуемся теперь, – это смеси, составленные из синтетических веществ.
Красители
Назначение пищевых красителей состоит в том, чтобы придать прошедшим обработку продуктам более привлекательный вид. Красители делятся на две главные группы: природные и синтетические. Теперь во всем мире ощущается тяга ко всему «натуральному» в пище, и потому в качестве пищевых красителей все чаще стремятся использовать очищенные пигменты многих растений, животных (в частности насекомых) и микроорганизмов.
Текстуранты
Так называют различные добавки, предназначенные для улучшения текстуры пищевых продуктов. Соединения кальция делают консервированные томаты более плотными и крепкими. Фосфаты улучшают вкус консервированных груш, делая их более нежными. Пирофосфаты улучшают текстуру пудингов быстрого приготовления и молочных продуктов. Эмульгаторы придают стабильность водным и масляным эмульсиям в заправках для салата. Разнообразное применение находят вещества типа крахмала, придающие продуктам большую плотность. Разрыхлители обеспечивают соответствующую текстуру выпекаемых хлебобулочных и кондитерских изделий.
Подсластители
Природные подсластители, такие, как сахар, известны людям на протяжении тысячелетий. Их всегда добывали в больших количествах. Однако забота о снижении калорийности пищи вынудила обратиться к непищевым подсластителям. В США в настоящее время разрешены к применению пять таких веществ: сахарин, аспартам, ацесульфам, тауматин и глициризин. Рассматривается и возможность применения ряда веществ, разрешенных в других странах. Аспартам и ацесульфам приблизительно в 200 раз слаще сахарозы, и ведутся работы по созданию новых, более эффективных искусственных подсластителей.
Наполнители
Эта тенденция к применению непищевых подсластителей заставила искать вещества, которые могли бы выполнять роль, традиционно выполняемую сахарами в напитках, джемах, желе и копченостях. Желатинированный крахмал люди употребляют на протяжении веков, теперь же получен ряд производных крахмала и целлюлозы. Используется полидекстроза – также одно из производных сахара.
Прочие
В эту категорию входит целый ряд веществ. К пищевой соли добавляют, например, алюмосиликат, чтобы она не сбивалась в комки, а сорбит добавляют к кокосовой стружке для того, чтобы она оставалась мягкой.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Пищевые добавки. Деление на группы. Их назначение.
2. Пищевые красители. Природные, синтетические.
3. Цветорегулирующие материалы. Их назначение.
4. Вещества, изменяющие консистенцию пищевых продуктов Примеры.
5. Загустители, желе- и студнеобразователи. Их назначение. Примеры.
6. Что такое пектиновые вещества. Источники. Строение. Применение.
7. Агароиды, альгиновые кислоты, эфиры целлюлозы. Строение. Применение.
8. Пищевые поверхностно-активные вещества. Их назначение. Механизм действия. Основные типы пищевых ПАВ.
9. Моно-, диацилглицериды; фосфолипиды, используемые в качестве ПАВ. Их строение.
10. Эфиры полиглицерина, сахарозы, сорбита, высших жирных кислот, применяемых в качестве ПАВ. Их строение.
11. Подслащивающие вещества. Природные, синтетические. Строение.
12. Консерванты. Типы. Строение. Их действие.
13. Пищевые антиокислители. Примеры.
14. Ароматизаторы. Их назначение. Примеры.
15. Перечислите органические кислоты, применяемые в качестве консервантов. Их строение.
16. Объясните с химической точки зрения обесцвечивание пигментов полиенового типа (например, каротинов) под действием сульфата натрия.
17. Объясните роль органических кислот и сахарозы в желеобразовании пектинов.
18. Объясните причины деструкции витаминов В1, РР при отбеливании муки броматом калия KBrO3.
19. Объясните причины деструкции витаминов В1, С, B5 при консервации продуктов сульфитами.
Моносахариды. Химические свойства
Свойства моноз обусловлены наличием в составе молекулы карбонила и гидроксильных групп, для них характерны реакции как альдегидов и кетонов, так и спиртов.
Целесообразно рассмотреть химические свойства в названном порядке.
Реакции карбонильной группы
1) Окисление
Все моносахариды, как типичные альдегиды или кетоны, окисляются сравнительно легко под действием перекисей природного происхождения, кислорода воздуха и других органических окислителей, присутствующих в живой клетке.
В качестве инициаторов окисления (здесь необходимо употреблять именно этот термин, т.к. окисление идет по радикальному механизму!) могут выступать оксидоредуктазы (ферменты), ионы металлов, температура, световые кванты, другие соединения. В технике используют более жесткие окислители: кислоты, оксиды, гидроксиды тяжелых металлов и другие окислители.
Реакция идет по схеме:
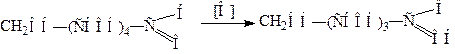
При более энергичном окислении в кислой среде одновременно с альдегидной группой окисляется и первичная спиртовая группа до карбоксильной группы:

В технике для этой цели используется азотная кислота. Для альдоз характерна и реакция альдегидов: "реакция серебренного зеркала" и восстановления меди (реактив Фелинга).
2) Восстановление
При восстановлении моносахариды переходят в многоатомные спирты. В природе за эту реакцию ответственны ферменты. В технике применяют амальгаму натрия или гидрид лития:
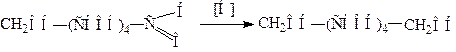
Реакция широко используется для производства пищевого сорбита – заменителя сахара для диабетиков.
3) Взаимодействие с аминами
Альдозы и кетозы вступают в реакцию с аммиаком и его производными (аминокислоты; полипептиды, белки, витамины, содержащие свободные аминогруппы; алифатические и ароматические амины биогенного происхождения и др.) образуя азометины, которые в дальнейшем легко циклизуются в гетеросистемы, и вторичные амины, по схеме:
 ,
,
где R – остатки аминокислот, пептидов, белков, аминов, витаминов и др.
Последующие многочисленные реакции, носящие окислительно-восстановительный характер и идущие параллельно, приводят к образованию темно-окрашенных продуктов – меланоидов. Строение красителя(лей) и механизм практически не изучены.
Образующиеся в ходе реакции промежуточные и побочные продукты (фурфурол, оксиметилфурфурол, уксусный альдегид, изовалериановый альдегид, диацетил и др.) принимают участие в формировании аромата и вкуса готовых продуктов.
Эта реакция играет большую роль в процессах, происходящих при переработке пищевого сырья.
Особенно интенсивно эти процессы идут при повышенной температуре: выпечка хлеба, сушка овощей, фруктов, получение сухого молока.
С реакцией меланоизации связано: потемнение сахарного сиропа при упаривании; образование цвета и аромата при "томлении" красного солода; образование вкусной, хрустящей, золотисто-коричневой корочки хлеба и его вкуса и аромата; цвет, вкус и аромат вин, шампанского, коньяка; потемнение фруктовых соков при хранении; внешний вид, вкус и запах готовых мясных изделий.
4) Превращение моноз в щелочной среде
4а) Эпимеризация моносахаридов
Изменение конфигурации у второго атома углерода альдоз называется эпимеризацией. Моносахариды крайне легко изменяются под действием щелочей. Так, уже на холоду разбавленные щелочи (например, водный раствор пищевой соды!) вызывают частичное превращение глюкозы во фруктозу и маннозу. Аналогично фруктоза превращается в глюкозу и маннозу, а манноза - в глюкозу и фруктозу, по уравнению:
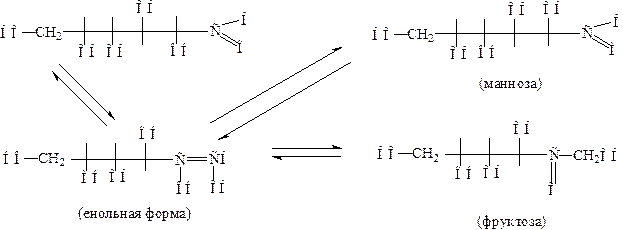
4б) Окислительное расщепление моносахаридов
При нагревании в разбавленных щелочах наблюдается побурение раствора, сопровождающееся окислением моносахаридов. При этом идет разрыв углеродной цепи с образованием большого числа разнообразных продуктов.
Главным продуктом расщепления глюкозы и фруктозы с разбавленными щелочами является молочная кислота. Образуются и другие продукты с трехуглеродной цепью, а также муравьиная кислота и другие вещества.
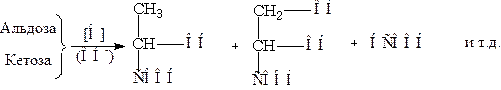
В организме высших животных непрерывно протекают процессы биохимического (ферментативного) расщепления и синтеза моносахаридов.
Аналогичные процессы идут и при хранении пищевого сырья (особенно растительного).
Реакции гидроксильных групп
Монозы принято рассматривать, как многоатомные спирты и для них характерны все свойства, присущие спиртам. К ним относятся, прежде всего, способность давать простые эфиры со спиртами (в том числе и с сахарами) и сложные эфиры с кислотами.
Все названные компоненты всегда присутствуют в пищевых продуктах и при благоприятных условиях вступают в реакцию.
1 Образование простых эфиров
В присутствии ионов водорода (источниками их являются кислоты) и высоких температур (выше 100°С) углеводы вступают в реакцию этерификации с другими спиртами, образуя “простые” эфиры (а). Наиболее реакционной группой циклических моноз является, как правило, “глюкозидная” гидроксильная группа и углеродного атома –  . Образовавшиеся соединения в этом случае называются глюкозидами (б).
. Образовавшиеся соединения в этом случае называются глюкозидами (б).
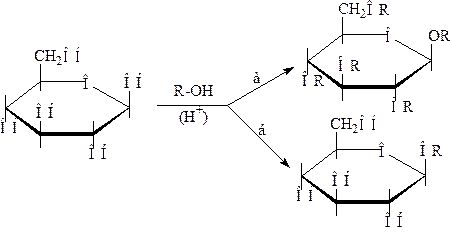 ,
,
где R - алкил; остатки моноз, диоз, полиоз; оксикислот и других спиртов.
2 Образование сложных эфиров
Сложные эфиры образуются в тех же условиях, что и простые эфиры.
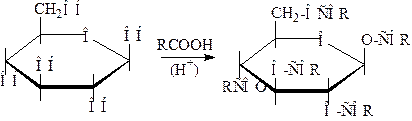 ,
,
где R – алкил, остатки аминокислот, полипептидов, остатки многих пищевых и минеральных кислот.
Образование простых и сложных эфиров идет и при обычных температурах с помощью ферментов.
Другие реакции моноз
1 Действие на моносахариды температуры
1а Циклизация пентоз
При нагревании пентоз в присутствии кислот, пентозы отщепляют три молекулы воды и циклизуются в фурфурол:
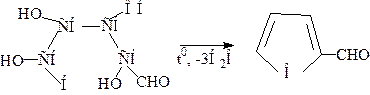
Фурфурол – один из компонентов, который входит в состав веществ, создающих аромат хлеба.
Б Карамелизация сахаров
Нагревание моно- и дисахароз до 100°С и выше приводит к существенному изменению их химического состава, соответственно повышается цветность продукта. В пищевой промышленности этот процесс называется “ карамелизацией” cахаров.
Глубина карамелизации зависит от состава cахаров, их концентрации, рН-среды, степени и продолжительности теплового воздействия, присутствия примесей. Особенно чувствительна к нагреванию фруктоза и карамелизация ее протекает в 6-7 раз быстрее, чем глюкозы.
Основной углеводный компонент кондитерских изделий – сахароза. При нагревании в ходе технологического процесса в слабокислой среде сахароза подвергается частичному гидролизу до глюкозы и фруктозы, последние претерпевают дальнейшие превращения. Например, глюкоза теряет (дегидратация) последовательно одну, две и три молекулы воды образуя внутренние ангидриды:

Ангидриды моноз могут конденсироваться с исходной сахарозой с образованием простых эфиров по типу крахмала, целлюлозы.
Фурфуролы могут полимеризоваться в цепочки по непредельным связям, по схеме:
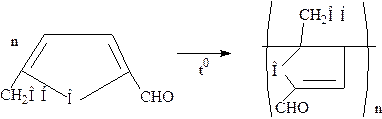
Сахароза при отщеплении двух молекул воды образует карамелен 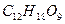 – желтое соединение, растворимое в воде; при отщеплении трех молекул воды она тримеризуется с образованием карамелена
– желтое соединение, растворимое в воде; при отщеплении трех молекул воды она тримеризуется с образованием карамелена 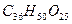 – ярко-коричневый цвет; при дальнейшей дегидратации и поликонденсации образуется карамелин не установленного строения - трудно растворим в воде.
– ярко-коричневый цвет; при дальнейшей дегидратации и поликонденсации образуется карамелин не установленного строения - трудно растворим в воде.
Дальнейшая дегидратация приводит к частичному разрушению углеродного скелета как монопродуктов, так и полимерных, с образованием муравьиной, левуленовой кислоты и других продуктов.
Карамелизация сахаров широко используется в кондитерской промышленности.
2 Укорочение углеродной цепи алъдоз
Реакция представляет собой еще один вариант окислительного расщепления моноз и имеет место в природе.
Окисление кальциевой соли альдоновой кислоты перекисью водорода в присутствии солей Fe 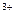 приводит к образованию непосредственно альдозы с более короткой (на один атом углерода) углеродной цепью. Реакция – многостадийная, идет через стадию декарбоксилирования с последующим окислением первичной спиртовой группировки до альдегидов, по суммарной схеме:
приводит к образованию непосредственно альдозы с более короткой (на один атом углерода) углеродной цепью. Реакция – многостадийная, идет через стадию декарбоксилирования с последующим окислением первичной спиртовой группировки до альдегидов, по суммарной схеме:
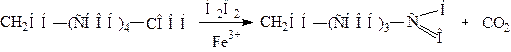
3 Брожение моносахаридов
Другим вариантом окислительно-восстановительного расщепления моноз является “брожение” – сложный ферментативный процесс со множеством промежуточных стадий, в ходе которого выделяются СО  , Н и другие. В зависимости от конечного продукта различаются несколько видов брожения:
, Н и другие. В зависимости от конечного продукта различаются несколько видов брожения:
а) Спиртовое брожение
б) Молочнокислое брожение
в) Маслянокислое брожение
г) Лимоннокислое брожение
д) Уксуснокислое брожение
и другие.
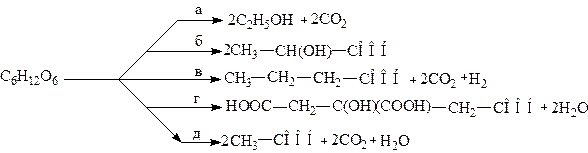
Процесс брожения занимает значительное место в пищевой промышленности для изготовления спирта, вин, пива, хлебобулочных и молочных изделий, консервантов, пищевых добавок.
В ходе ферментативной обработки пищи, наряду с основными продуктами, образуются побочные продукты, такие как глицерин, янтарная кислота, уксусная кислота, изопропиловые и изоамиловые спирты, их производные, которые существенно влияют на вкус и аромат пищевых продуктов.
Дисахариды
Дисахаридами называются такие углеводы, молекулы которых при гидролизе расщепляются на две молекулы моносахаридов.
Простейшими природными диозами являются свекловичный или тростниковый сахар – сахароза; солодовый сахар – мальтоза: молочный сахар – лактоза и целлобиоза. Все эти дисахариды имеют одну и ту же брутто-формулу 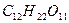 .
.
Состав дисахаридов определяется их гидролизом кислотами или ферментами. Сахароза гидролизуется на Д-глюкозу и Д-фруктозу:
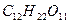 +
+ 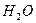 ®
® 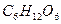 +
+ 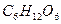
Мальтоза и целлобиоза гидролизуются на две молекулы Д-глюкозы:
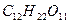 +
+ 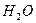 ®2
®2 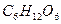
Дисахариды образуются из двух молекул моносахаридов за счет отщепления воды:
2 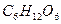 ®
® 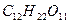 +
+ 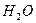
В живой клетке синтез контролируется специфическими ферментами.
Для осуществления связи между молекулами моноз обязательно принимает участие гликозидный гидроксил, а второй может быть и спиртовой гидроксил.
В зависимости от того, заняты гликозидные гнлроксилы связью или нет, они делятся на невосстанавливающие н восстанавливающие. Например, невосстанавливающий дисахарид сахароза:
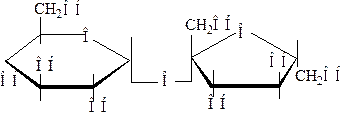
В сахарозе гликозидная гидроксилъная группа у атома С занята эфирной связью с фруктозой.
К восстанавливающим сахарам относятся, например, мальтоза и целлобиоза.
Все химические свойства, рассмотренные для моноз характерны и для диоз, но добавляется еще одна реакция - гидролиз.
Диозы гидролизуются кислотами или ферментами на монозы. Например, сахароза:
Сахароза + 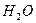 ®D-Глюкоза (a,b) + D-Фруктоза(a,b)
®D-Глюкоза (a,b) + D-Фруктоза(a,b)
Полисахариды
Полисахариды представляют собой продукты поликонденсации большого числа (от нескольких десятков до сотен тысяч) молекул моносахаридов.
Остатки моноз соединены между собой кислородными мостиками в длинные (неразветвленные или разветвленные) цепи. Их можно рассматривать как полигликозы или полиэфиры.
В образовании полисахаридов могут принимать участие, как пентозы, так и гексозы. В первом случае образуются пентозаны: арабаны из арабанозы, ксиланы из ксилозы и т.д. Во втором случае – гексозаны: крахмал, гликоген, клетчатка из глюкозы, инулин из фруктозы.
Наибольшее значение для пищевой промышленности имею крахмал и клетчатка. Их строение имеет следующий общий вид:
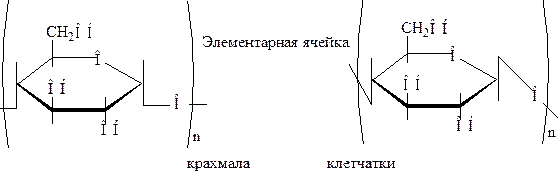
Крахмал
Является главным запасным питательным веществом растений. По составу он неоднороден и представляет собой смесь нескольких полисахаридов. Все они образуются из a-Д-глюкозы и отличаются строением цепи, числом входящих в их состав остатков и фосфорной кислоты.
Полисахариды крахмала делятся на две фракции: амилазу, содержание ее в крахмале от 15 до 25% и амилопектин - от 75 до 85%.
1 Амилоза ( 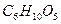 )
) 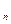
Полисахарид амилозы представляет собой неразветвленные или малоразветвленные цепочки, содержащие от 1000 до 6000 фрагментов глюкозы, связанных между собой эфирной связью по 1-4a атомам углерода, и фрагментов фосфорной кислоты (0,05%).
Амилоза имеет кристаллическое строение, растворима в воде, при стоянии вскоре выпадает в осадок, йод окрашивает ее в синий цвет.
2 Амилопектин ( 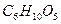 )
) 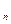
Молекулы амилопектина сложнее, чем амилазы. Они представляют собой разветвленные цепи, содержащие от 5000 до 6000 остатков глюкозы и 0,4% фосфорной кислоты. Последняя связана с некоторыми спиртовыми гидроксилами сложноэфирной связью.
В составе амилопектина содержится до 0,6% высокомолекулярных жирных кислот.
Связь между остатками a-Д-глюкопиранозы 1-4a, 1-бa, 1-Зa.
С йодом образует фиолетовую окраску с красноватым оттенком.
Амилопектин в горячей воде не растворяется, но сильно набухает и дает клейстер (устойчивый гель).
Под действием ферментов или кислот крахмал гидролизуется. В общем виде схему превращения крахмала при гидролизе можно представить следующим образом:
( 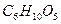 )
) 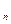 + n
+ n 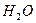 ® (
® ( 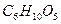 )
) 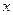 + n
+ n 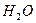 ®
® 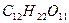 +
+ 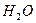 ®
® 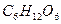 .
.
Гидролиз принят на вооружение промышленностью для получения многих пищевых продуктов: патока, глюкоза, хлебобулочные изделия, спирт, молочная кислота, лимонная кислота, аминокислоты.
3 Гликоген
Животный крахмал, состоит из остатков глюкозы, связанных между собой по 1-4a (до 90%), 1-6a (до 10%) и 1-Зa (до 1%). Он является энергетическим запасным материалом животных (в печени до 10%, мышцах 0,3-1% гликогена). Присутствует в некоторых растениях, например в зернах кукурузы.
По своему строению напоминает амилопектин, но более разветвлен. Хорошо растворяется в горячей воде, но при охлаждении не образует клейстер.
По своей химической сущности крахмалы представляют собой полиэфиры и полиспирты одновременно, и обладают всеми свойствами как эфиров (гидролиз, переэтерификация), так и спиртов (образование простых и сложных эфиров, реакции аминирования, окисления и др.).
Например, гидролиз крахмалов до a-Д-глюкозы по эфирным группировкам:
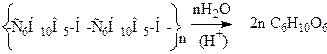
или реакции по спиртовым группам со спиртами и кислотами, с образованием простых и сложных эфиров, соответственно, окисление крахмалов до альдегидов и кислот, по схеме:
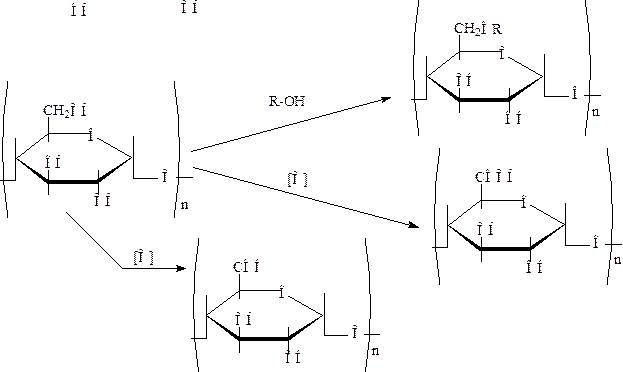
где R – остатки спиртов и кислот.
Естественно, при модификации крахмалов для пищевых целей этерификацию и окисление проводят частично (не полностью).
В последние годы в пищевой промышленности нашли применение модифицированные крахмалы типа “диальдегидные”, ”окисленные”, “ацетилированные”и другие.
1.4.2 Клетчатка ( 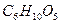 )
) 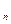
Клетчатка является главной составной частью оболочек растительных клеток. Содержание клетчатки в древесине 40-50%, зернах пшеницы – 3, ржи и кукурузе – 2,2, в подсолнечнике с плодовой оболочкой – до 15.
Молекула клетчатки имеет линейное строение и состоит из 2000-3000 остатков р-Д-глюкопиранозы, связь между ними 1-4b, т.е. соединены между собой 1-й и 4-й углеродные атомы моноз.
Клетчатка нерастворима в воде и при обычных условиях не гидролизуется кислотами. Гидролизуется только при повышенных температурах до Д-глюкозы, по схеме:
( 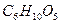 )
) 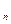 + n
+ n 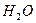 ®
® 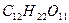 +
+ 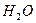 ®
®  .
.
Глюкозу из клетчатки широко используют для производства кормовых дрожжей, спирта, аминокислот, органических кислот и других продуктов (до 100 продуктов).
В желудочно-кишечном тракте человека нет фермента, расщепляющего клетчатку и ее относят к балластным веществам. Последние, вместе с пектинами, рекомендованы в качестве обязательных составляющих рациона человека. Они улучшают моторные функции желудочно-кишечного тракта и способствуют ликвидации застойных явлений в кишечнике.
Гемицеллюлозы
Высокомолекулярные полисахариды, участвующие совместно с целлюлозой в построении клеточных стенок растительных тканей. Содержатся в зерне, соломе, кукурузных початках, подсолнечной лузге. Содержание гемицеллюлоз зависит от сырья и достигает 40% (кукурузные початки), в пшенице и ржи –до 10%.
В их состав входят пентозаны (остатки арабинозы, ксилозы), гексозаны (остатки маннозы, галактозы, глюкозы, фруктозы) и группа смешанных полисахаридов (остатки пентоз, гексоз и урановых кислот).
Гемицеллюлозы имеют разветвленное строение, связи моноз осуществляются с участием полуацетального гидроксила и гидроксильных групп у 2,3,4,6 - ого углеродных атомов.
Кислотный гидролиз гемицеллюлоз обычно протекает легче, чем целлюлозы.
В гемицеллюлозы иногда включают группу агара (смесь сульфированных полисахаридов – агарозы и агаропектина) полисахарида, присутствующего в водорослях и применяемого в кондитерской промышленности.
Гемицеллюлозы широко применяют в разных отраслях промышленности, в том числе для получения пищевых продуктов: агар, агароза, ксилит.
Пектиновые вещества
Группа высокомолекулярных полисахаридов, входящих о состав клеточных стенок и межклеточных образований растений совместно с целлюлозой, гемицеллюлозой и лигнином. Содержатся в клеточном соке. Наибольшее количество пектиновых веществ содержится в плодах и корнеплодах. Получают их из яблочных выжимок, свеклы, корзинок полсолнечника.
Различают нерастворимые пектины (протопектины) и растворимые, содержащиеся в клеточном соке.
В основе полисахаридов пектинов лежит цепь из остатков a-Д-галактуроновой кислоты, связанных между собой связями 1-4a, причем часть карбоксильных групп этерифицирована метанолом, а гидроксильные группы могут служить точками присоединения боковых разветвленных цепей из остатков Д - галактозы, L - арабинозы, Д - ксилозы, L - рамнозы.
Пектины можно написать общей формулой:
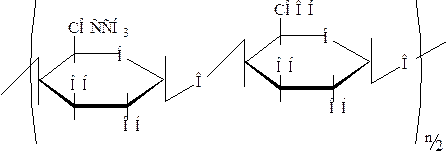
Часть кислотных групп находится в виде солей. Молекулярная масса пектинов от 20000 до 50000.
При созревании и хранении плодов нерастворимые формы пектина переходят в растворимые, с этим связано размягчение плодов при созревании и хранении. То же происходит и при теплой обработке растительного сырья, осветлении плодово-ягодных соков.
Пектиновые вещества способны образовывать гели в присутствии кислоты и сахара, и используются в качестве студнеобразующего вещества в кондитерской и консервной промышленности для производства мармелада, пастилы, желе и джемов, а также в хлебопечении, сыроделии.
Основное свойство пектинов - выводить из организма тяжелые металлы, токсичные вещества, сельскохозяйственные яды - в настоящее время оценено в недостаточной степени.
Дата: 2019-03-05, просмотров: 621.